Резюме
Инсулинът е необходим за поддържане на хомеостазата на глюкозата. Въпреки важността на инсулиновата чувствителност за метаболитното здраве, механизмите, които предизвикват инсулинова резистентност, остават неясни. Аминокиселините с разклонена верига (BCAA) принадлежат към основните аминокиселини, които са както преки, така и непреки хранителни сигнали. Въпреки че се съобщава, че BCAA подобряват метаболитното здраве, повишеното ниво на BCAA в плазмата е свързано с висок риск от метаболитно разстройство и бъдеща инсулинова резистентност или захарен диабет тип 2 (T2DM). Предполага се, че активирането на мишена от бозайници на рапамицин комплекс 1 (mTORC1) от BCAAs причинява инсулинова резистентност. В допълнение, дефектен метаболизъм на BCAA може да възникне при затлъстяване, което води до по-нататъшно натрупване на BCAA и токсични междинни продукти. Този преглед предоставя настоящото разбиране на механизма на BCAA-индуцирано активиране на mTORC1, както и ефекта от активирането на mTOR върху метаболитното здраве по отношение на инсулиновата чувствителност. Освен това, ефектите от нарушен метаболизъм на BCAA ще бъдат обсъдени подробно.
1. Въведение
2. Положителните ефекти на BCAA върху метаболитното здраве
Въпреки че връзката между високо ниво на BCAA и IR е доказана в многобройни проучвания при хора и в модели на гризачи, повишаването на нивото на BCAA води до положителни ефекти, които подобряват метаболитните параметри като телесен състав, нива на гликемия и ситост.
Хипоталамусният левцин е потенциален хранителен сигнал, който може да намали приема на храна чрез активиране на целта на рапамицин при бозайници (mTOR) [5]. mTOR се активира стабилно и селективно в медиобазалните хипоталамусни (MBH) неврони на дъгообразното ядро (ARC), експресиращи анорексигенен, про-опиомеланокортин (POMC) и орексигенен невропептид Y/свързани с агути пептидни неврони в ARC по време на рефериране след бърз [5]. Нивото на левцин в MBH ангажира невроциркулацията на предния/задния мозък, което осигурява отрицателна обратна връзка към енергийния баланс чрез намаляване на приема на храна [6]. Cota et al. предполага, че тези чувствителни към хипоталамуса BCAA реакции поддържат организмите в състояние на метаболитен баланс [5].
BCAA контролират отделянето на хормони както в стомашно-чревния тракт, така и в мастните депа. Лечението с левцин в продължение на шест седмици повишава адипонектина и намалява холестерола в плазмата на мишки със затлъстяване преди, без промяна на телесното тегло или мастната маса [7]. BCAA и диетичният протеин подобряват освобождаването на глюкагон като пептид-1 (GLP-1) и понижават нивата на експресия на гените, необходими за синтез и адсорбция на мастни киселини в човешката чревна клетъчна линия (NCI-H716), което предполага чревен механизъм за благоприятен ефект на BCAA [8]. В допълнение, повишените нива на BCAA индуцират инсулинемични отговори и инсулинтропни ефекти при мишки [9,10].
Взети заедно, както богатите на BCAA диети, така и добавките на BCAA имат положителни роли в метаболизма, подкрепяйки диетичните препоръки за протеини за повишаване нивата на BCAA.
3. Отрицателните ефекти на BCAA върху метаболизма
Последните метаболомични проучвания и цялостни метаболитни профилиращи проучвания постоянно показват нарушение на нормалния метаболизъм на аминокиселини и увеличаване на специфични аминокиселини, често BCAA, при някои модели на затлъстяване или T2DM при гризачи и при пациенти със затлъстяване или T2DM [17,18, 19,20,21]. Имайки предвид цитираните по-горе ползи за здравето от BCAA, корелацията на високите нива на BCAA с инсулиновата резистентност, затлъстяването и T2DM изглежда противоречива.
Предполага се, че BCAA влияят върху мозъчната функция, като се конкурират с поглъщането на аминокиселинните прекурсори на допамин и 5-хидрокситриптамин в мозъка [26]. Транспортът на големи неутрални аминокиселини (LNAA) се споделя от BCAA и ароматни аминокиселини, което ги кара да се конкурират помежду си. Повишаването на нивото на BCAA намалява нивото на ароматните аминокиселини, което води до намаляване на синтеза и освобождаването на невротрансмитери, получени от ароматни аминокиселини, което вероятно допринася за повишен риск от депресия [2].
Въпреки положителните ефекти на BCAA върху метаболизма, силната връзка на нивата на BCAA с инсулиновата резистентност и метаболитния синдром предполага, че повишените нива на BCAA могат да причинят инсулинова резистентност и T2DM, въпреки че засега това остава спекулация. Механизмът, лежащ в основата на тази корелация, все още не е напълно разбран. Възможният механизъм, чрез който BCAA допринасят за IR, ще бъде разгледан в следващия раздел.
4. Механизъм на IR от mTOR
Въпреки че все още не е ясно дали BCAA са причиняващи фактори за развитието на IR или те са биомаркери на нарушено инсулиново действие, се появи участието на хранителни сигнали в инсулиновата резистентност. Високите нива на BCAA постоянно активират mTORC1 (mTOR комплекс 1), което води до инсулинова резистентност чрез фосфорилиране на инсулиновия рецепторен субстрат 1 (IRS-1).
4.1. Механизмът на индуцирано от аминокиселини mTORC1 активиране
mTOR е серин/треонин киназа, принадлежаща към семейството на протеин киназата, свързана с фосфатидилинозитол (PI) киназа [27]. MTOR сигналната мрежа регулира критични клетъчни процеси и процеси на развитие като клетъчен растеж, диференциация, оцеляване на клетките и метаболизъм [28]. mTOR съществува поне в два биохимично и функционално различни комплекса, mTOR комплекс 1 (mTORC1) и mTOR комплекс 2 (mTORC2) [29]. mTORC1 регулира клетъчния растеж в отговор на няколко извънклетъчни и вътреклетъчни сигнали, включително растежни фактори, клетъчен енергиен статус, клетъчно ниво на кислород и наличност на аминокиселини. mTORC1 се състои от „регулаторно свързан протеин на mTOR“ (раптор), който набира субстрати и подпомага локализацията на mTOR; „40 kDa Pro-богат Akt субстрат“ протеин (PRAS40), „DEP домейн-съдържащ mTOR-взаимодействащ“ протеин (DEPTOR), всички от които са отрицателни регулатори на mTORC1; и „смъртоносен бозайник с SEC13 протеин 8“ (mLST8; известен също като GβL), който регулира положително mTORC1. Две най-известни мишени надолу по веригата на mTORC1 са 4EBP1 и S6K1, които регулират инициирането и прогресирането на транслацията на иРНК, следователно синтеза на протеин [28].
Комплексът от туберкулозна склероза 1/2 (TSC1/2) трансдуцира сигнала нагоре по веригата към mTORC1 [30]. TSC е гуанозин трифосфатен (GTP) аза-активиращ протеин (GAP) за малкия GTPase Rheb (Ras хомологично обогатен в мозъка), който отрицателно регулира mTORC1 чрез увеличаване на скоростта на GTP хидролиза на Rheb. Аминокиселинната сигнализация обаче активира mTORC1 независимо от регулацията на TSC, чрез регулиране на вътреклетъчната локализация на mTORC1 [31]. По време на дефицит на аминокиселини, mTORC1 се разпространява в цялата цитоплазма. При аминокиселинна стимулация, mTORC1 се транслоцира до лизозомната повърхност, където се намира малката GTPase Rheb [29]. Zoncu и сътр. съобщава, че аминокиселините се натрупват в лизозомата след извънклетъчното им добавяне, което предполага, че лизозомата е ключово място за индуцирано от аминокиселини mTOR активиране [32].
Неотдавнашен доклад идентифицира комплексите GATOR като отрицателни регулатори на Rag протеини. GATOR1 взаимодейства директно с Rag протеини, функционирайки като GAP към Rag A и Rag B, което води до инхибиране на активирането на mTORC1 [37]. GATOR2 инхибира GATOR1, блокирайки инхибиторната регулация на mTORC1, което води до активиране на mTORC1 [37]. По-специално, Sestrin 2, левцинов сензор, също се свързва с GATOR2, като по този начин инхибира mTORC1 при липса на левцин, въпреки че как неговото взаимодействие инхибира mTORC1 е неизвестно [38]. И накрая, беше показано, че левцинът се свързва директно със Sestrin 2, нарушавайки взаимодействието с GATOR2 и активирайки mTORC1 [39].
Независимо от идентифицирането на аминокиселинни медиатори при транслокация на mTORC1 към повърхността на лизозомата, се препоръчва също ос Vps34-фосфолипаза D1 (PLD1) да активира mTORC1 върху лизозомата [40]. Известно е, че фосфатидната киселина (PA), продукт на фосфолипаза D1, е критичен регулатор на активирането на mTOR. PA се свързва с FKBP рапамицин свързващия (FRB) домейн на mTOR, конкурирайки се с рапамицин и активирайки mTOR [41]. В допълнение, произведеният PLD1 PA е отговорен за активирането на mTOR по време на активиране на mTOR както от аминокиселини, така и от митоген [42]. Наскоро беше установено, че PI3P, продукт на Vps34, активира PLD1, насърчавайки транслокацията му в лизозомата, независимо от комплекса Rag-Ragulator [40]. PLD1 произвежда PA върху лизозомната повърхност, активирайки mTOR, в допълнение към RaTOR-индуцираната регулация на mTOR. Въпреки че се предполага участието на Ca 2 + -калмодулин по време на активиране на Vps34, горните регулатори, които активират Vps34, остават неизвестни.
4.2. Предложеният механизъм в основата на IR от индуцираното от BCAA активиране на mTORC1: Някои от възможните механизми
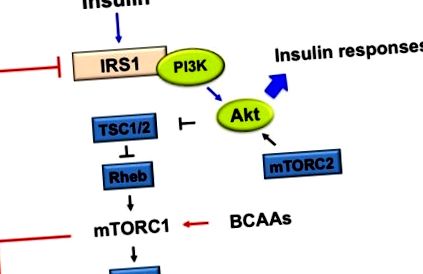
mTOR е централен сигнален медиатор на кръстосани взаимоотношения между аминокиселини и инсулин. Инсулинът активира mTOR, последвано от активиране на рибозомния S6K1, който регулира инициирането на транслация и удължаване чрез фосфорилиране на S6 [43]. Или активиран mTOR, или активиран S6K1 фосфорилат IRS-1, което води до блокирана инсулинова сигнализация [44,45] (Фигура 1).
Предложеният механизъм на стимулирана от разклонена верига аминокиселини (BCAA) при бозайници за активиране на рапамицин комплекс1 (mTORC1) при инсулинова резистентност (IR). BCORA-активиран mTORC1 и след S6K1 фосфорилиращ инсулинов рецепторен субстрат 1 (IRS-1) при серин 307, 636/639, 1101, 312, които инхибират IRS-1. Нарушената активация на протеин киназа В (ПКБ, известна още като Akt) чрез регулацията на отрицателната обратна връзка отслабва инсулиновите реакции, като увеличаване на усвояването на глюкозата и синтеза на гликоген и намаляване на синтеза на глюкоза.
5. Спорът за ролята на mTORC1 в IR
Въпреки няколко реда експериментални доказателства, подкрепящи виждането, че ефектът на BCAA върху инсулиновата резистентност се осъществява чрез активиране на mTORC1, някои наблюдения са противоречиви.
Повишаването на нивото на BCAA чрез добавяне или генетична модификация корелира с подобряване на метаболизма, въпреки активираната mTORC1 сигнализация. Делецията на аминотрансфераза с разклонена верига на митохондриите (BCATm) увеличава енергийните разходи и подобрява инсулиновата чувствителност [53]. BCATm катализира трансфера на α-амино група от BCAA към α-кетоглутарат, образувайки глутамат и трите съответни разклонени вериги α-кето киселини. Изчерпването на BCATm повишава нивата на BCAA 10 пъти спрямо мишки от див тип поради блокирането на катаболизма на BCAA. Неочаквано тези мишки консумират повече храна и показват повишена термогенеза, индуцирана от диета (DIT), последвана от увеличени скорости на протеинов синтез и разграждане, придружени от постно фенотип. Тези резултати предполагат, че повишените нива на BCAA при мишки с дефицитен катаболизъм на BCAA произтичат от повишена скорост на белтъчен оборот, което води до увеличен разход на енергия.
6. Процесите, които влияят на нивото на BCAA
Оборотът на протеините се контролира от инсулина, в допълнение към аминокиселините. Въпреки че инсулинът активира протеиновия синтез при новородени прасенца [64], засиленият протеинов синтез при хора в условия на хипераминоацидемия се дължи на инсулина, намаляващ скоростта на разграждане на протеините [65]. В съответствие с това, инсулинът намалява експресията на иРНК на MAFbx и протеазомни С2 субединични протеини в човешкия мускул [66]. Наличието на инсулин и аминокиселини активира протеиновия синтез адитивно, което предполага, че аминокиселините и инсулинът регулират синтеза на протеини независимо [66]. Това би могло да обясни наблюдението, че разграждането на протеините се увеличава при гладуващи индивиди със затлъстяване и инсулинова резистентност, без да се засяга синтеза на протеини [67,68,69]. Въпреки че BCAA не влияят директно на разграждането на протеина, BCAA могат да играят критична роля в модулирането на мускулната маса, когато индуцираното от инсулина разграждане на протеини намалява от инсулиновата резистентност [2].
В допълнение, чревната микробиота влияе върху нивото на BCAA в плазмата [70]. Чревната микробиота използва няколко аминокиселини, включително BCAA от гостоприемника, за да синтезира бактериални клетъчни компоненти или да ги катаболизира, за да генерира метаболитни продукти като мастна киселина с къса верига (SCFA) и мастни киселини с разклонена верига (BCFA), която играе роля в развитието на затлъстяването. За отбелязване е, че чревните бактерии повишават нивото на аминокиселините или чрез de novo биосинтеза [71], или повлиявайки абсорбцията на хранителни вещества [72]. Въпреки че е доказано, че чревните микроби допринасят за нивата на аминокиселини в гостоприемниците, значението на чревните микроби в нивата на BCAA трябва да бъде оценено допълнително.
7. BCAA дисметаболизъм
Наред с постоянното активиране на mTORC1, нарушенията в метаболизма на BCAA са свързани с инсулиновата резистентност и T2DM чрез натрупване на евентуално токсични междинни продукти и нива на BCAA в плазмата.
Митохондриалната изоформа на аминотрансфераза с разклонена верига (BCATm, кодирана от BCAT2) катализира първата стъпка в метаболизма на BCAA в повечето периферни тъкани. BCAA метаболитите са намалени в периферните тъкани на BCAT2 -/- мишки [53], както беше споменато в предишния раздел. Въпреки непрекъснатото им активиране на mTORC1, BCAT2 -/- мишките нямат инсулинова резистентност, което би се очаквало. Вместо това, мишките BCAT2 -/- показват подобрен гликемичен контрол и чувствителност към инсулин с високи енергийни разходи, вероятно поради загубата на глюконеогенни предшественици, което показва, че мускулните трансаминази играят критична роля в генерирането на глюконеогенни субстрати за черния дроб.
Следващата стъпка в метаболитния път на BCAA се катализира от мултиензимния митохондриален разклонен верижен α-кетокиселинен дехидрогеназен комплекс (BCKDC) [2]. BCKDC окислява BCAA необратимо до съответните им кетокиселини. Важно е, че експресията и активността на BCKDC могат да бъдат променени от множество метаболитни фактори, които са свързани със затлъстяването, инсулиновата резистентност и T2DM. Мутацията на BCKDC и неговия активатор, митохондриалната изоформа на протеинова фосфатаза 1K (PPM1K), води до натрупване на BCAA и разклонени вериги α-кетокиселини (BCKA), последвани от кленов сироп в урината (MSUD) [73,74,75] . Всъщност лечението на глиални клетки, мозъчната кора или клетките на черния дроб на плъхове с няколко BCKA или с ацетокиселината на левцин, а-кетоизокапроат (α-KIC), доведе до митохондриална дисфункция [73,76,77] . Видовете ацил-коензим А с разклонена верига (CoA) се произвеждат от BCKDC. Те се метаболизират допълнително чрез множество ензимни етапи в митохондриалната матрица, като в крайна сметка образуват липогенни, кетогенни или глюкогенни субстрати (ацетоацетил-КоА, ацетил-КоА и пропионил-КоА).
В мастната тъкан на пациенти със затлъстяване и T2DM с инсулинова резистентност, експресията на гени, кодиращи ензимите на метаболизма на BCAA, значително намалява чрез неопределен механизъм - поне тези гени, кодиращи ензими, катализиращи първите две стъпки - водещи до повишено ниво в плазмата на BCAA [78,79]. Като се има предвид, че метаболизмът на BCAA в цялото тяло зависи по същество от интероргани, трябва да се има предвид експресията на тези ензими в други органи, като черния дроб и мускулите. Експресията на гените, кодиращи ензимите на метаболизма на BCAA, беше намалена в мускулната и чернодробната тъкан на пациенти с T2DM [80,81]. Подобни открития са направени и при плъхове [82]. За разлика от това, активността на BCKDH в черния дроб всъщност се увеличава и може да компенсира намалената активност в мастната тъкан [83]. Следователно, получените плазмени нива на BCAA са или повишени, или непроменени, в зависимост от ензимната активност в други органи.
Променената генна експресия, причинена от мутации или епигенетична регулация, засяга всички ензимни дейности на метаболизма на BCAA. Tiffin et al. идентифицира BCKDH4, гена, кодиращ регулаторната субединица на BCKDC, като един от двата първични гена на податливост, които влияят на риска от развитие както на T2DM, така и на затлъстяване чрез изчислителни методи за приоритизиране на заболяването [84]. Освен това, същото проучване установи, че IVD е вторичен ген за чувствителност към T2DM. IVD кодира изовалерил-КоА дехидрогеназа, която участва в метаболизма на левцина [84]. PPM1K, BCKDHA фосфатазата, беше избран като един от 20-те най-добри гени за изследване на T2DM [85]. Променената активност на BCKDC, постигната чрез остри физически упражнения [86] или регулатора BCKA [87], също може да модулира нивата на BCAA в плазмата, както в краткосрочен, така и в дългосрочен план. Сред няколко фактора, дълговерижните мастни киселини и техните метаболити възпрепятстват активността на BCKDC или директно, като влияят или на окислително-редукционните състояния, или на концентрациите на ацетил-КоА, или индиректно чрез инхибиторно карбонилиране на ензими, което може да причини BCAA дисметаболизъм [88,89,90 91].
8. Заключения
В обобщение, последните проучвания предлагат тясна връзка между BCAA и инсулинова резистентност. Предложени са механизми, чрез които повишените BCAA индуцират инсулинова резистентност. Новите открития, свързани с BCAA сигналния път и метаболизма на BCAA, разширяват нашето разбиране за инсулиновата резистентност. Въпреки това дали BCAA са просто маркери за инсулинова резистентност, или те са директни участници в инсулиновата резистентност, остава несигурно и този въпрос привлича повишен интерес от научните изследвания. Освен това, сигналните пътища и метаболизмът на BCAA могат да бъдат терапевтични цели за лечение на инсулинова резистентност и T2DM.
Благодарности
Този преглед беше подкрепен от Програма за основни изследвания чрез Националната изследователска фондация на Корея (NRF), финансирана от Министерството на образованието (2015R1D1A1A01058313), и от Медицинския център на Университета Гашон в Гил (Номер на гранта: 2015-15).
- TYROSINE N-ACETYL-TYROSINE TYROSINE 500 MG (100 CAPS) АМИНОКИСЕЛИНИ ALiness iNatural - Здравословен магазин
- Твоето тяло; s Отговор на дъвченето и изплюването на ролята на инсулина; Наука за хранителните разстройства
- Терапевтични ефекти на аминокиселините при чернодробни заболявания Съвременни изследвания и бъдещи перспективи
- Какви са ползите за здравето на глициновите аминокиселини
- Висцерална мазнина (активна мазнина) - Видове мазнини, инсулинова резистентност; Здравословни рискове