Субекти
Порочен кръг, свързващ затлъстяването с хронично възпаление, подхранва развитието и обострянето на метаболитния синдром и други нарушения. Модулирането на енергийния метаболизъм на митохондриите чрез сигнализиране на интерлевкин-1β установява избягаща верига с положителна обратна връзка, която поражда и засилва последиците от диетата с високо съдържание на мазнини.
Затлъстяването бързо се превръща в глобална опасност за здравето 1. Според Световната здравна организация през последните години разпространението на затлъстяването в световен мащаб е достигнало епидемични размери 2. Обществените последици от това мрачно развитие са широки, като се има предвид, че затлъстяването също е основен рисков фактор и е тясно свързано с опустошителни човешки патологии, включително сърдечно-съдови заболявания, захарен диабет тип 2, рак, метаболитни нарушения, деменция и ускорено стареене, наред с други 2. По този начин разбирането на сложните сигнални пътища и молекулярните механизми, лежащи в основата и поддържането на сложната физиология на затлъстяването, се превръща в належащ приоритет.
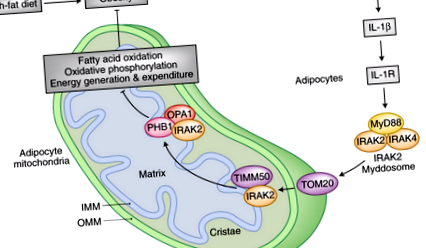
Отдавна е известно, че наднорменото тегло предизвиква различни възпалителни реакции 3,4. Обратната връзка също е постулирана; хроничното системно възпаление е състояние, което може да улесни развитието на метаболитен синдром и затлъстяване 5. Клетъчните и молекулярните основи на тази последна асоциация остават до голяма степен неуловими. В този брой на Природна имунология, Zhou и колегите 6 идентифицират сигнална каскада, която се задейства от провъзпалителния цитокин интерлевкин (IL) -1β, за да намали в крайна сметка производството и разхода на енергия в адипоцитните митохондрии (фиг. 1). Тази новооткрита асоциация по същество създава верига за положителна обратна връзка, при която диетата с високо съдържание на мазнини (HFD) води до затлъстяване и предизвиква хронично възпаление на ниско ниво, което от своя страна възпрепятства митохондриалния енергиен метаболизъм, за да засили допълнително натрупването на мазнини и увеличаването на теглото.
Индуцираното от затлъстяването възпаление отслабва генерирането и изразходването на енергия в адипоцитните митохондрии, като допълнително утежнява затлъстяването. Сигнализирането за възпалителен цитокин на IL-1β чрез IL-1R вербува IRAK2 – Myddosome в митохондрии, където се свързва с митохондриалната рецепторна субединица TOM20 на външната митохондриална мембрана. След това IRAK2 се транслоцира във вътрешната митохондриална мембрана, където взаимодейства с транслоказната субединица TIMM50 на вътрешната мембрана. Докато е във вътрешната митохондриална мембрана, IRAK2 се свързва с субединицата на прохибиновия комплекс PHB1. Асоциацията с PHB1 улеснява взаимодействието на IRAK2 с митохондриалната динамин-подобна GTPase OPA1. Свързването на IRAK2 с PHB1 и OPA1 променя морфологията на вътрешните митохондриални мембранни кристи и пречи на образуването и функционирането на дихателния комплекс. В резултат на това окислителното фосфорилиране и окисляването на мастните киселини в адипоцитите намаляват. В допълнение, несвързаното митохондриално дишане, което допринася за термогенезата, се нарушава, намалявайки енергийните разходи в клетките на кафявата мастна тъкан. По този начин IRAK2 е ключов компонент на механизма за положителна обратна връзка, който преследва енергийния метаболизъм на митохондриите, за да увеличи в крайна сметка натрупването на мазнини и затлъстяването.
В съответствие с предишни доклади, свързващи възпалението със затлъстяването, авторите установяват, че нивата на IL-1β са много по-високи в мастната тъкан на мишки, хранени с HFD, спрямо контролните животни, хранени с диета с ниско съдържание на мазнини. Повишеният IL-1β пречи на митохондриалното окислително фосфорилиране чрез потискане на образуването на суперкомплекс на дихателната верига, без да се засягат други аспекти на митохондриалната физиология и хомеостаза като митофагия, производство на реактивни кислородни форми (ROS), изтичане на калций или цитохром ° С освобождаване. Организирането на дихателните верижни комплекси I – IV в суперкомплекси във вътрешната митохондриална мембрана (IMM) е важно за установяването и поддържането на протонния градиент, необходим за генериране на енергия. Следователно, производството на АТФ и свързаната консумация на кислород, както и окисляването на мастни киселини (FAO), намаляват в адипоцитите при стимулиране на IL-1β.
Как тези промени в енергийния метаболизъм на митохондриалните адипоцити се предизвикват от IL-1β? Рецепторът за интерлевкин 1 (IL-1R) се активира от IL-1β и набира MyD88, вроден адаптер за трансдукция на имунитетен сигнал, който свързва комплекси IL-1R и Toll-like receptor (TLR) 7. Елиминирането на IL-1R в адипоцитите облекчава въздействието на лечението с IL-1β върху адипоцитните митохондрии. В допълнение, мишките, които нямат MyD88 специално в мастната тъкан, показват подобрена устойчивост към вредните ефекти на HFD. Тези животни са по-слаби и показват повишен термогенен капацитет на кафява мастна тъкан (НДНТ), с по-малко натрупване на липиди и повишено FAO в адипоцитите. Забележително е, че изчерпването на MyD88 предизвиква обширно преустройство на IMM в адипоцити, с повишено образуване на кристали и съпътстващо подобрено сглобяване на суперкомплекс на дихателната верига. Тези открития показват, че сигнализирането на IL-1β задейства митохондриални адаптации, които намаляват енергийните разходи в адипоцитите.
Мишките без IRAK2 бяха значително по-устойчиви на вредните HFD. Тези животни рекапитулираха мутанти с дефицит на MyD88 по отношение на наддаване на тегло, чувствителност към инсулин и физиология на мастната тъкан. По същия начин те показват повишена експресия на FAO и термогенен ген, в допълнение към разширяването на кристалите, в митохондриите на мастната тъкан. Освен това премахването на MyD88 или IRAK2 насърчава образуването на суперкомплекс на дихателната верига и увеличава енергийните разходи, особено в митохондриите на НДНТ, където се осъществява по-голямата част от термогенезата чрез отделяне на електронната транспортна верига от производството на АТФ и разсейване на електрохимичната енергия на протонния градиент като топлина 10. В резултат на това тези животни показват по-висока телесна температура и намалено натрупване на липиди. Колективно тези наблюдения показват, че HFD спира спирачките на митохондриалния енергиен метаболизъм чрез MyD88 и IRAK2, което допълнително изостря затлъстяването.
Сега възниква въпросът, как IRAK2 упражнява своята регулаторна функция върху свръхкомплекса на митохондриалната дихателна верига? Авторите идентифицират протеина на митохондриалния скелет прохибин 1 (PHB1) като взаимодействие на IRAK2 на IMM 6. PHB1 и свързаният с него протеин prohibinin 2 (PHB2) са субединици на голяма, подобна на пръстен макромолекулна структура в IMM, замесени в процеси, вариращи от митохондриална биогенеза до инсулин-инсулиноподобен растежен фактор 1 (IGF1) сигнализиране, рак и стареене 11,12 . Важно е, че прохибинините участват и в морфогенезата на кристали, като регулират обработката на оптичен атрофичен протеин 1 (OPA1), подобна на динамин GTP-аза, служеща като компонент на машината за сливане на митохондриите 13. Асоциацията на IRAK2 с PHB1, при стимулиране на IL-1β, също набира OPA1 в комплекса. В резултат на секвестрацията на OPA1 от IRAK2 и PHB1, кристалите се дестабилизират и образуването на суперкомплекс на дихателната верига намалява. В този контекст PHB1 улеснява взаимодействието на IRAK2 с OPA1. Съответно, загубата на PHB1 облекчава IRAK2-медиираната умереност на митохондриалния енергиен метаболизъм, причинена от IL-1β стимулация в адипоцитите.
За отбелязване е, че фосфорилирането на IRAK2 е необходимо за правилното му локализиране с TIMM50 в IMM и за взаимодействие с PHB1 и OPA1. Инактивирането на киназната функция на IRAK2 елиминира влиянието на лечението с IL-1β върху енергийния метаболизъм на митохондриите. Докато киназно неактивният вариант все още се свързва с TOM20 и навлиза в митохондриите при стимулация с IL-1β, фосфорилирането на IRAK2 се премахва, което предполага, че IRAK2 става автофосфорилиран. Тази модификация е предпоставка за взаимодействие с TIMM50 и за взаимодействие с PHB1 – OPA1. Като такъв, той е от съществено значение за IRAK2-потискащите функции в митохондриите. Фенотипът на неактивни към киназа IRAK2 мутантни животни напълно потвърждава тази верига от събития и до голяма степен наподобява този на нокаутиращите мишки IRAK2. Когато са подложени на HFD, тези животни са по-слаби и по-малко устойчиви на инсулин. Освен това, те показват повишена активност на ФАО и формиране на суперкомплекс на дихателната верига, както и по-висока телесна температура, което показва повишена термогенеза и енергийни разходи в НДНТ.
В комбинация констатациите на Zhou и колегите разкриват неочаквана сигнална ос, която определя митохондриалната активност в адипоцитите чрез препредаване на възпалителни IL-1β сигнали чрез Myddosome и IRAK2, за да модулира образуването на суперкомплекс на дихателната верига, като по този начин влияе на генерирането и разхода на енергия. Важно е, че тази трансдукционна каскада създава верига с положителна обратна връзка, която усилва вредните ефекти на HFD и влошава затлъстяването (фиг. 1). Подобен молекулярен механизъм може да управлява митохондриалния енергиен метаболизъм в човешката мастна тъкан. В действителност, HFD причинява ниско ниво на възпаление и секреция на провъзпалителни цитокини, включително IL-1, при хората 18. Освен това, в съответствие с други проучвания 19, авторите откриват това IL1B генната експресия е по-висока в мастната тъкан на пациенти с диабет 6. Следователно, проучването от Zhou и колеги предоставя достатъчно възможности за изследване на потенциални стратегии за намеса, насочени към IRAK2 и други компоненти на новооткрития път в адипоцитите, с цел подобряване на затлъстяването и свързаните с него метаболитни нарушения при хората.
Препратки
Blüher, M. Нат. Преподобен Ендокринол. 15, 288–298 (2019).
Световна здравна организация. Затлъстяване https://www.who.int/topics/obesity/en/ (2020).
Столарчик, Е. Curr. Становище. Pharmacol. 37, 35–40 (2017).
- Възпаление, затлъстяване и тромбоза Кръвно Американско общество по хематология
- IRhom2 служи като фасилитатор при затлъстяване, като засилва мастното възпаление и инсулиновата резистентност
- Затлъстяването при майки нарушава развитието на хипоталамуса Природни отзиви Ендокринология
- Лептин, невроинфламация и затлъстяване - Резюме - Ендокринна имунология - Издатели Karger
- Медицински изделия за лечение на затлъстяване Nature Reviews Гастроентерология; Хепатология