Джилиан Шнайдер
1 Факултет Сен Жан, Университет на Алберта, Едмънтън, Алберта, Канада
2 Катедра по физиология, Университет на Алберта, Едмънтън, Алберта, Канада
Ву Хюн Хан
1 Факултет Сен Жан, Университет на Алберта, Едмънтън, Алберта, Канада
3 Катедра по офталмология и визуални науки, Университет на Алберта, Едмънтън, Алберта, Канада
Ребека Матю
1 Факултет Сен Жан, Университет на Алберта, Едмънтън, Алберта, Канада
Ив Сове
2 Катедра по физиология, Университет на Алберта, Едмънтън, Алберта, Канада
3 Катедра по офталмология и визуални науки, Университет на Алберта, Едмънтън, Алберта, Канада
Hélène Lemieux
1 Факултет Сен Жан, Университет на Алберта, Едмънтън, Алберта, Канада
4 Катедра по медицина, Институт за изследвания на здравето на жените и децата, Университет на Алберта, Едмънтън, Алберта, Канада
Свързани данни
Резюме
Въведение
Стареенето е преобладаващ рисков фактор за диабет тип 2 (T2DM) и свързаните с него сърдечно-съдови заболявания [1, 2]. Световната честота на T2DM се е увеличила от 108 на 422 милиона индивида между 1980 и 2014 г. и възходящата тенденция продължава да съществува [3]. Сърдечно-съдовите усложнения са причина номер едно за смъртността при пациенти с Т2ДМ; усложненията включват ускорена атеросклероза, систолна и диастолна дисфункция, хипертрофия на лявата камера, предсърдна фиброза и мъждене, сърдечна недостатъчност и повишена смъртност след миокарден инфаркт [4]. В кардиомиоцитите инсулинът и хранителната сигнализация действат като основни регулатори на метаболизма, осигурявайки поддържането на подходящ глюкозен отговор, липидемия, оксидативен стрес, възпаление, работа с калций, апоптоза и митохондриална функция [5]. Видна роля на митохондриите в T2DM се подкрепя от констатациите, че смекчаването на инсулиновата резистентност също подобрява здравето на митохондриите [6].
Човешкото сърце се нуждае от значително количество АТФ, за да бие приблизително 100 000 пъти дневно. Около 95% от АТФ, консумиран от сърдечния мускул, идва от процеса на окислително фосфорилиране (OXPHOS), разположен в митохондриите [7]. Електроните пътуват през пътищата за електронен трансфер (ET-пътеки) във вътрешната митохондриална мембрана, докато протоните се изпомпват в междумембранното пространство; това създава протонен градиент, използван от АТФ синтазата за фосфорилиране на АДФ в АТФ. В здравите кардиомиоцити над 60–70% от АТФ се доставя от мастни киселини като донори на електрони; останалите електрони се получават от окисляването на глюкоза, лактат, аминокиселини или кетонни тела [7]. Кислородът действа като краен акцептор на електрони. Електроните, изтичащи от ET-пътищата, могат частично да намалят кислорода, произвеждайки реактивни кислородни форми (ROS). Промените в митохондриалния метаболизъм не само ще повлияят на енергийния статус, но и на производството на ROS; те ще имат едновременно въздействие върху клетъчното стареене.
Сърдечните митохондриални дефекти са описани в T2DM (прегледано от [8]); отчетените промени са в капацитета/активността/съдържанието на различни комплекси на митохондриални ET-пътеки [9–15], активност на пируват дехидрогеназен комплекс (PDC) [16–18], свързване [15, 19], оксидативен стрес [20, 21 ], митохондриално съдържание [9, 17], митохондриално дишане, поддържано от субстрати на мастни киселини [9, 13, 17, 22–24], и фрагментация на митохондриалната мрежа [19]. Резултатите в литературата представляват предимно единична времева точка, след появата на хипергликемия и/или в модели на бърза прогресия на T2DM. При хората диабетът е бавно развиваща се болест, като появата му се увеличава 2,5 пъти след 65-годишна възраст [25]. С напредването на стареенето митохондриалните дисфункции, произтичащи от T2DM, стават объркани от тези, приписвани само на стареенето [26-28], което усложнява нашето разбиране за ролята на митохондриалната дисфункция при T2DM.
Нашето проучване иска да обърне внимание на три пренебрегвани фактора, които пречат на нашето разбиране за ролята на сърдечната митохондриална дисфункция при T2DM. Първият е насочен към ранните стадии на заболяването, преди хипергликемия. Вторият е сложните и непрекъснати процеси на стареене, които протичат едновременно с болестта и влиянието върху митохондриите. Третият е сексуалният диморфизъм, свързан не само с T2DM, но и със стареенето [38, 39] и сърдечно-съдовите заболявания [40]. Подозираме, че разглеждането на тези аспекти заедно може да е ключът към очертаването на ролята на митохондриите в сърдечно-съдовите патологии, свързани с T2DM и стареенето. Чрез включване на жени в нашия експериментален дизайн, ние също така ще проучим ефектите на MCD върху предотвратяването на сърдечни митохондриални увреждания, както в присъствието, така и в отсъствието на хипергликемия.
материали и методи
Животни
Плъховете от Нилска трева (Arvicanthis niloticus) се поддържат в цикъл 14:10 h светло-тъмно, при стайна температура 21 ± 2 ° C и
40% относителна влажност. След отбиването на 21–23 дни мъжете и жените бяха разделени на две диетични групи: 1) MCD група, хранени с Mazuri® Chinchilla (5M01, Purina Mills, LLC, Сейнт Луис, Мисури, САЩ; 4,0% мазнини, 15,3 % фибри, 21,6% протеин); 2) SRCD група, хранена с Prolab® (RMH 2000, 5P06, LabDiet, Nutrition Intl., Richmond, IN, USA; 9,6% мазнини, 3,2% фибри, 19,9% протеин). Животните са получавали храна и вода ad libitum. Метаболитният фенотип и сърдечната митохондриална функция са измерени на 2, 6 и 18 месеца от биологичната възраст. Периодът на гладно от 16-18 часа предшества събирането на кръв и тъкани. Всички експерименти са одобрени от Институционалния комитет по грижа и употреба на животните в Университета на Албърта (протокол 328) и насоките на NIH (САЩ) относно грижите и използването на животните за експериментални процедури.
Метаболитен фенотип
Животните бяха евтаназирани с интраперитонеална инжекция от 480 mg kg -1 евтанил (Bimeda-MTC Animal Health, Inc., Cambridge, ON, Канада). След това животните бяха претеглени, измерени и нивата на плазмения инсулин на гладно и нивата на кръвната захар на гладно (FBG) бяха оценени, както е описано по-горе [41]. Нивата на инсулин на гладно> 2 ng ml -1 показват компенсация, а FBG> 5,0 mmol l -1 отразява хипергликемия [29].
Подготовка на сърдечни проникващи влакна
Цялото сърце се събира веднага след евтаназия и се потапя в ледено студен мускулен релаксиращ разтвор BIOPS [42]. Приблизително 30 mg левокамерна тъкан от върха се прехвърля в свеж ледено студен релаксиращ разтвор. Влакната бяха механично проникнати с форцепс, последвано от леко разбъркване в продължение на 30 минути при 4 ° С в релаксиращ разтвор, допълнен с 50 μg ml -1 сапонин [43]. Фибрите се промиват в продължение на 10 минути чрез разбъркване в ледено студена митохондриална дихателна среда MiR05 [44]. След това влакната се попиват, претеглят и веднага се използват за респирометрични измервания.
Респирометрия с висока разделителна способност
маса 1
| 1 | Пируват + малат (PM) | NADH | Комплекс I |
| Комплекс от пируват дехидрогеназа | |||
| Транспортер на пируват | |||
| 1 | Пируват + малат + сукцинат (ПМС) | NADH & Succinate | Комплекси I и II |
| Комплекс от пируват дехидрогеназа | |||
| Транспортер на пируват | |||
| Сукцинатна дехидрогеназа | |||
| 1 | Сукцинат + ротенон | Сукцинирайте | Комплекси II |
| Сукцинатна дехидрогеназа | |||
| 1 | Аскорбат + TMPD (-азиден фон) | - | Комплекс IV една стъпка |
| 2 | Палмитоилкарнитин + малат | ETF | Дълговерижно окисляване на мастни киселини |
| Карнитин транслоказа | |||
| Карнитин палмитоилтрансфераза-II | |||
| 3 | Октаноилкарнитин + малат | ETF | Средноверижно окисляване на мастни киселини |
| Карнитин транслоказа | |||
| Карнитин палмитоилтрансфераза-II | |||
| 4 | Ацетилкарнитин + малат | ETF | Карнитин ацетилтрансфераза |
| Карнитин транслоказа |
ETF, електронотрансферен флавопротеин; TMPD, N, N, N, N-тетраметил-р-фенилендиамин
Данните за митохондриалната функция са представени или като кислороден поток на маса (за всички протоколи), или като съотношения за контрол на потока (FCR), нормализирани за максимален капацитет на OXPHOS в присъствието на субстрати, захранващи електрони едновременно в NADH и сукцинатни пътища (за протокол 1 ). В края на всеки експериментален цикъл съдържанието на камерата се отстранява и камерата се изплаква два пъти с 500 μL MiR05. Влакната се хомогенизират 2 пъти, 30 s върху лед, със стъклени съдове и веднага се съхраняват при -80 ° C за измерване на цитрат синтаза (CS), както е описано по-рано [41].
Анализ на данни
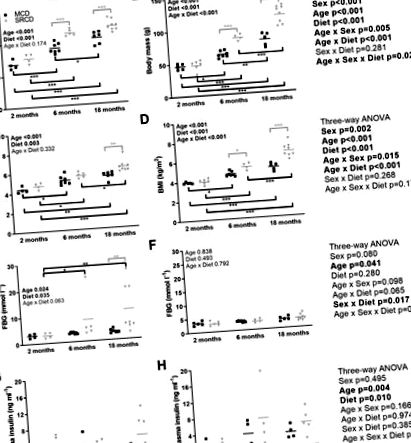
Статистически анализи бяха извършени със SigmaPlot 14 (Systat Sofware Inc., Сан Хосе, Калифорния, САЩ). Графиките са произведени с помощта на GraphPad Prism 7 (GraphPad Software, Inc., La Jolla California). Критериите за нормалност и хомогенност на дисперсията за ANOVA са тествани за всяка променлива, като се използват съответно тестовете на Kolmogorov-Smirnov (корекция на Lilliefor) и Brow-Forsythe. След това данните за митохондриалната функция и метаболитния фенотип бяха анализирани, използвайки трипосочен ANOVA с пол, диета и възраст като трите фактора и бяха последвани от двойни тестове на Tukey. Някои променливи бяха трансформирани, за да отговорят на критериите на ANOVA и специфичната трансформация е посочена на всяка фигура легенда. Данните са представени като медиана (min – max) без трансформация, когато N е броят на животните и n е броят на оксиграфските анализи. Фигура 1), телесното тегло на мъжете, хранени с SRCD, е по-високо в сравнение с това на тези, хранени с MCD; обаче той достигна значение само на 6 и 18 месеца (фиг. 1А). Подобни резултати са получени при жените, но с по-силно разделяне между диетичните групи на възраст от 2 до 18 месеца (Фигура 1В). Индексът на телесна маса (ИТМ) (Фиг. 1C и 1D) представлява по-добър показател за сравнение на затлъстяването между мъжете и жените, тъй като отчита по-малката дължина на жените. ИТМ също е по-висок в групата SRCD. Значимостта между диетичните групи е достигната на 18-месечна възраст при мъжете (фиг. 1С) и на 6 и 18-месечна възраст при жените (фиг. 1D). Не е имало взаимодействие между пола и диетата за ИТМ (p = 0,268), което показва подобен ефект от диетите и при двата пола.
Метаболитен фенотип на мъжките (лявата страна) и женските (дясната страна) плъхове от Нилска трева, хранени с диетата Mazuri Chinchilla (група MCD, черни квадратчета) или със стандартната диета за гризачи на гризачи (SRCD, сиви триъгълници), на три различни възрасти (2 месеца, 6 месеца и 18 месеца). Измерените параметри са телесна маса (A, B), индекс на телесна маса (BMI; B, C), кръвна глюкоза на гладно (FBG; E, F) и плазмен инсулин (G, H). Точковият график показва отделните точки с данни и медианата. Значителни разлики между диетичните (в сиво) или възрастовите (в черно) групи са посочени с *** за p Фиг. 1E и 1F, дясна страна). При мъжете FBG е по-висок в групата SRCD в сравнение с групата MCD на 6 и 18 месеца, докато значимостта е получена едва на 18 месеца поради високата вариабилност в групата SRCD (Фигура 1E). За разлика от тях, женските запазват FBG на нормално ниво през целия възрастов диапазон (Фигура 1F). Плазменият инсулин е бил значително повлиян от възрастта (p = 0,027 между 2 и 6 месеца; p = 0,005 между 2 и 18 месеца; сравнения по двойки Tuckey) и диетата (p = 0,010 между групата MCD и SRCD; сравнение по двойки Tuckey), но не по пол (p = 0,495). Освен това няма значимо взаимодействие на нито един от факторите за плазмените нива на инсулин. Извършихме също регресионен анализ между BM и нивото на инсулина, показвайки слаба, но значима корелация при двата пола (R 2 = 0,216 и 0,317, съответно при мъжете и жените).
Активността на цитрат синтазата се влияе от възрастта и диетата, но само при мъжете
Активност на цитратна синтаза (CS) в сърдечните влакна на мъжки (A) и женски (B) плъхове от Нилска трева, хранени с диета Mazuri Chinchilla (група MCD, черни квадратчета) и стандартна диета за гризачи на гризачи (SRCD, сиви триъгълници), на три различни възрасти (2 месеца, 6 месеца и 18 месеца). Данните са представени като графики на кутия и мустаци със средна активност на CS (IU g -1 сърдечни влакна). Графиката вляво е за данните за мъжете, а отдясно за данните за мъжете. Точковият график показва отделните точки с данни и медианата. N = 4–12 животни на група и n = 7–16 фибри в група. Резултатите от трипосочните ANOVA са вдясно и двупосочните ANOVA на всеки панел. Значителни разлики между диетичните групи (отгоре, сиво) и между възрастовите групи (отдолу, черно) са посочени с *** за p Фиг. 3A и 3B; дясната страна), но възрастовият ефект достигна значение само за женската (p = 0,022), а не и за мъжката (p = 0,525) в двупосочния ANOVA. За разлика от това, сукцинатният път, изразен в поток на маса, не показва значителни промени с възрастта, пола или диетата (Фигура 3C и 3D). Въпреки това, имаше значително взаимодействие на възрастта и диетата, показано чрез увеличаване на капацитета в групата SRCD в сравнение с групата MCD на 6 месеца (p = 0,022, объркани полове). Увеличението на митохондриалното съдържание за 2 месеца при мъжете, хранени с SRCD, в сравнение с мъжете, хранени с MCD (фиг. 2А), не е довело до по-висок капацитет в потока на маса за NADH или сукцинатния път (фиг. 3А и 3С).
Относителният капацитет на комплекс IV варира с възрастта и диетата, но само при мъжете
Комплексната активност IV, измерена с аскорбат и TMPD, захранващи електрони в комплекс IV, не показва значителна промяна с възрастта, пола или диетата, когато се изразява в поток на маса (Фигура 4А и 4В). Howerver, трипосочната ANOVA върху FCR показва значителен ефект от пола (p = 0,005), както и взаимодействията между пола и възрастта (p = 0,008) и между пола и диетата (p = 0,009; Фиг. 4C и 4D) . Промените в комплекс IV са ограничени до мъжете (фиг. 4С). 2-месечните мъже показват по-висок FCR за комплекс IV в SRCD в сравнение с групата MCD (p = 0,004) и е последван от намаляване с възрастта (p = 0,015 между 2 и 18-месечна възраст; Фигура 4C) . В групата с MCD, FCR за комплекс IV започва по-ниско на 2 месеца, увеличава се на 6 месеца (без да достигне значимост) и след това намалява значително от 6 на 18 месеца (p = 0,029) (Фиг. 4C). За разлика от това жените не показват промяна в FCR за комплекс IV с възрастта или диетата (фиг. 4D). Като цяло, FCR за комплекс IV е единствената част от пътя на ЕТ, която е била засегната от диетата и възрастта, и отново само при мъжете.
LEAK дишане в пермеабилизирани сърдечни влакна от леви вентрикули от мъжки (A) и женски (B) плъхове от Нилска трева, хранени с диетата Mazuri Chinchilla (група MCD, черни квадрати) и диетата със стандартна гризача Chow (SRCD група, сиви триъгълници), на три възрасти (2 месеца, 6 месеца и 18 месеца). LEAK се определя в присъствието на субстратни захранващи електрони в NADH пътя (пируват и малат) и при липса на ADP. Скоростта на дишане LEAK се изразява като FCR, над максималния капацитет на OXPHOS със субстрати, захранващи електрони едновременно в NADH и Succinate пътищата. Точковият график показва отделните точки с данни и медианата. Трансформациите на корен на куба бяха приложени, за да отговорят на предположението за трипосочната ANOVA. N = 3–7 животни на група и n = 4–12 фибри за група.
Целостта на външната мембрана на митохондриите
Благодарности
Благодарни сме на Шари Куни за помощта в управлението на колонията NR, анализ на резултатите и редактиране на ръкописа. Благодарим на Roshani Payoe за редакционния преглед.
Отчет за финансиране
Финансиране, предоставено от гранта за откритие на NSERC (RGPIN 402636), гранта на Канадската фондация за иновационно оборудване (12979) и гранта на Факултет Сен Жан за HL, и от канадските здравни институти (CIHR; MOP 125873) към YS. JS получи стипендия за висше образование на Frederick Banting и Charles Best Canada и стипендия за кралица Елизабет II; WHH получи стипендия за Медицински и стоматологичен факултет на Университета в Албърта; YS получава стипендия за фондация за наследство на Алберта за медицински изследвания (200800242).
- Почти анорексична е моята (или любимата ми) връзка с храната проблем от Дженифър Дж
- Причини за рак на гърдата и известни рискови фактори Генетика, хормони, диета и др
- Лесно дишане Редовният прием на ябълки и домати може да помогне на белодробната функция
- Altmetric - ABO генотип, диета „кръвна група“ и кардиометаболитни рискови фактори
- 9 мисли, които могат да ви помогнат да прекратите болезнена връзка