Резюме
Заден план
Доказано е, че пренаталното лечение с дексаметазон повишава чувствителността на потомството към предизвикано от диета следродилно програмирано затлъстяване с високо съдържание на мазнини. Изследвахме метаболитните фенотипове, чувствителния на хранителни вещества сигнал и циркадния часовник в мастната тъкан, програмирани от пренаталната експозиция на дексаметазон и постнаталната СН диета.
Методи
Мъжки потомци на плъхове Sprague-Dawley бяха разделени на четири експериментални групи: нормална диета, пренатална експозиция на дексаметазон, постнатална СН диета и пренатална дексаметазон плюс постнатална СН диета. Постнаталната високочестотна диета се предписва от отбиването до 6-месечна възраст.
Резултати
Пренаталната дексаметазон и постнаталната СН диета упражняват синергични ефекти върху телесното тегло и висцералното затлъстяване, докато пренаталната дексаметазон и постнаталната СН диета променят метаболитния профил и причиняват дисрегулация на лептина. Пренаталната дексаметазон и постнаталната СН диета ясно повлияват чувствителните на хранителни вещества молекули и циркадните гени в мастната тъкан. Експресията на тРНК на mTOR, AMPK-α2, PPAR-α и PPAR-γ беше потисната от пренаталния дексаметазон, но засилена от постнаталната СН диета.
Заключение
Пренаталното лечение с дексаметазон и постнаталното високочестотно лечение причиняват дисрегулация на чувствителни на хранителни вещества молекули и циркадни гени във висцералната мастна тъкан. Характеризирането на променени молекули, чувствителни на хранителни вещества и гени с циркаден часовник, има потенциално терапевтично значение по отношение на патогенезата и лечението на пренатален стрес и метаболитни нарушения, свързани с диета след раждането.
Заден план
Затлъстяването е възникващ здравен проблем в света. Тъй като генетичната променливост на популацията не се променя бързо, промените в начина на живот вероятно са отговорни за това увеличение. Промените в начина на живот включват диета с високо съдържание на мазнини (HF), намалена физическа активност, намален общ дневен период на сън, повишено излагане на ярка светлина през нощта и нощно хранене [1]. Последните проучвания показват връзката между пренаталната обида по време на развитието на плода и увеличения риск от хронични заболявания през целия живот, като затлъстяване и други метаболитни нарушения [2]. Затлъстяването на майката и прекомерното наддаване на тегло при бременност също са идентифицирани като фактори, допринасящи за повишено затлъстяване при потомството [3].
По време на бременност при хора често се предписва лечение с глюкокортикоиди (GC), когато се очаква преждевременно раждане [4]. Въпреки това се наблюдава прекомерно излагане на GC при пренатален стрес, което може да доведе до програмиране на развитието на метаболитен синдром и хипертония в по-късен живот [5,6,7]. Предполага се, че поради прекомерното излагане на плода на GC на майката, потомството на стресирани язовири от плъхове е по-податливо на затлъстяване, предизвикано от HF диета [8]. Нашите предишни проучвания също подкрепиха това наблюдение. Установихме, че пренаталното лечение с дексаметазон повишава чувствителността на потомството към предизвикано от диета следродилно програмирано затлъстяване, нарушена регулация на инсулина и хипертония [6, 9, 10].
Излишъкът от мастна тъкан е характеристика на затлъстяването. Възникващите доказателства показват, че мастната тъкан е активна метаболитна тъкан, която произвежда много адипокини с важни физиологични функции [11]. Установено е, че лептинът играе важна роля в регулирането на метаболизма, като стимулира разхода на енергия, намалява апетита и подобрява хомеостазата на глюкозата. Резистентността към лептин често се развива при затлъстяване, което ограничава биологичния му ефект [12]. За разлика от това, адипонектинът може да подобри инсулиновата чувствителност, да засили окисляването на мастните киселини и енергийните разходи [12], а секрецията му често намалява при затлъстяване.
Способността да усещате и реагирате на колебанията в нивата на хранителните вещества в околната среда е необходимост в живота. Недостигът на хранителни вещества е селективен стрес, който е формирал еволюцията на повечето клетъчни процеси. Чрез чувствителни на хранителни вещества каскади клетките се интегрират и координират вътреклетъчното и извънклетъчното хранене. В състояние, богато на храна, пътят за усещане на хранителни вещества има тенденция да благоприятства анаболизма и съхранението на хранителни вещества [13]. Оскъдното хранително вещество задейства катаболни процеси, като автофагия, за поддържане на хомеостазата. Пътищата за зачитане на хранителни вещества често са неправилно регулирани при хора с метаболитни заболявания [13].
Молекулярната връзка между циркадните ритми и метаболизма е разкрита наскоро [14,15,16]. Един от най-атрактивните аспекти е взаимодействието между хранителните пътища и циркадния часовник. Циркадната система се адаптира към промените в околната среда, за да оптимизира физиологичната реакция. В допълнение към централния часовник, овладян от супрахиазматични ядра на предния хипоталамус и синхронизиран с 24-часовия цикъл светлина/тъмнина, има периферни часовници в телесните тъкани [15]. За разлика от централния часовник, циклите на хранене/гладно са основните цели на часовниците на периферните тъкани. Периферните тъканни часовници са чувствителни към състава и времето на консумираната храна. Дисрегулацията на циркадния ритъм и неподходящото хранене са тясно свързани и се смята, че допринасят за развитието на някои хронични заболявания [15].
В момента мастната тъкан също се предлага да бъде важна цел на програмирането на развитието [17]. Дисфункцията на мастната тъкан е тясно свързана със затлъстяването и свързаните с него нарушения. Следователно разбирането на патологията на мастната тъкан е от голямо значение при идентифицирането на потенциални терапевтични цели за предотвратяване и лечение на нарушения, свързани със затлъстяването. Настоящото проучване има за цел да изследва метаболитните фенотипове, чувствителния на хранителни вещества сигнал и циркадните часовници в мастната тъкан, които са програмирани от пренатална експозиция на дексаметазон и постнатална СН диета.
Материали и методи
Животни
Измерване на телесно тегло и кръвно налягане
Телесното тегло (BW) на потомството се измерва всеки месец, докато те достигнат 6-месечна възраст. Кръвното налягане се измерва при съзнателни 6-месечни плъхове, използвайки метода на косвения маншет (BP-2000; Visitech Systems, Inc., Apex, NC) [6, 18].
Тест за интраперитонеален глюкозен толеранс
За интраперитонеален тест за толерантност към глюкоза, кръвни проби се събират в пет точки от времето след 8 часа гладуване: преди и 15, 30, 60 и 120 минути след интраперитонеално инжектиране на глюкоза (2 g/kg). Плазмените нива на глюкоза се определят с помощта на ензимния (хексокиназен) метод [19].
Експериментални процедури и събиране на проби
Потомците на плъхове са жертвани на 6-месечна възраст, като се използват ксилазин и кетамин [6]. По време на евтаназия бяха събрани хепаринизирани кръвни проби. Ретроперитонеалната мазнина беше събрана и използвана за по-нататъшни проучвания [6].
Определяне на плазмените метаболитни параметри
Плазмени метаболитни параметри, включително нивата на триглицериди, холестерол, аспартат трансаминаза (AST), аланин трансаминаза (ALT), алкална фосфатаза (ALKP), съдов ендотелен растежен фактор (VEGF), фактор на туморна некроза-α (TNF-α) (R&D) Systems, Minneapolis, MN) и лептин (Biovendor RD291001200R, Бърно, Чехия) бяха определени чрез ензимно-свързани имуносорбентни анализи в съответствие с инструкциите на производителя.
Уестърн блотинг
Проба от ретроперитонеална мастна тъкан (50 mg) се хомогенизира с 500 μl PRO-PREP протеинов разтвор за екстракция (# 17081, iNtRon биотехнология, Корея). Клетките се лизират чрез инкубация върху лед за 30 минути и след това се центрофугират при 14 000 хж за 20 минути при 4 ° С. Концентрациите на протеини се определят с помощта на комплект за анализ на протеин Bio-Rad (Bio-Rad, Hercules, CA). Протеиновите проби (100 μg) се варят с буфер за зареждане с гел в продължение на 5 минути, подлагат се на 10% SDS-PAGE и след това се прехвърлят в мембрана от поливинилиден флуорид (Roche Applied Sciences, Базел, Швейцария). Мембраната се блокира с PBS-Tween, съдържащ 5% обезмаслено мляко, и след това се инкубира в продължение на 2 часа с анти-плъховото антитяло SIRT-1 (# ab110304, Abcam, Cambridge, MA) или GAPDH (Santa Cruz), разредено 1: 200 в TBS, съдържащ 1% обезмаслено мляко. След това мембраните се измиват пет пъти с 0,1% T-TBS, инкубират се в продължение на 1 час с белязано с пероксидаза вторично антитяло, разредено 1: 1000 в T-TBS, изплакват се с T-TBS и след това се разработват с помощта на Chemi Doc (Bio- rad Image Lab 5.0).
Количествена верижна реакция с обратна транскрипция-полимераза (qRT-PCR)
статистически анализи
Ефектите на пренаталния дексаметазон и постнаталната СН диета при 6-месечно потомство на плъхове бяха оценени чрез двупосочна ANOVA, с Tukey’s след хок тест дали взаимодействието е било значително в първите четири групи. Във всички тестове, P
Резултати
Пренаталният дексаметазон и постнаталната СН диета водят до различни метаболитни прояви
Както е показано в таблица 1, BW е значително по-висока в групата на DHF, отколкото в групите VEH, DEX и VHF. Използвайки двупосочна ANOVA, ние показахме, че пренаталното лечение с дексаметазон (Hit 1) и постнаталната HF диета (Hit 2) значително повишават BW. Освен това и двете лечения показаха значителен интерактивен ефект върху BW (P = 0,048). Теглото на ретроперитонеалната мазнина също е значително по-тежко в групата на DHF, отколкото в групите VEH, DEX и VHF (стр Таблица 1 Телесно тегло/тегло на мастната тъкан, биохимия и други биомаркери
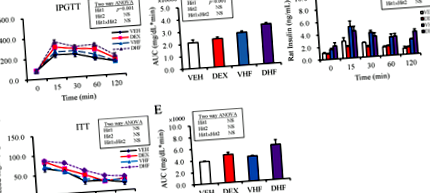
Резултатите от интраперитонеалния тест за толерантност към глюкоза показват, че пренаталното лечение с дексаметазон показва значителен ефект, докато постнаталната HF диета не показва ефект върху AUC на глюкозата; не е имало взаимодействие между леченията (Фиг. 1а, б). Използвайки двупосочна ANOVA, ние показахме, че постнаталната високочестотна диета има значителен ефект (Hit 2, стр Фиг. 1
Пренаталната дексаметазон и постнаталната СН диета предизвикват хронично възпаление и дисрегулация на лептина
Животните от групата на DHF са имали по-високи нива на AST и ALT от тези в останалите три групи, но разликата не е статистически значима (Таблица 1). Използвайки двупосочна ANOVA, ние показахме, че пренаталното лечение с дексаметазон (Hit 1) не показва ефект, докато постнаталната HF диета има положителен ефект върху нивата на AST и ALT (Hit 2, стр Фиг. 2
Пренаталната дексаметазон и постнаталната СН диета показват различно влияние върху чувствителния на хранителни вещества път в ретроперитонеалната мастна тъкан
Наблюдавани са сигнали за чувствителност на хранителни вещества в ретроперитонеалната мастна тъкан, за да се изследват програмните ефекти от лечението с пренатален дексаметазон и постнаталната СН диета.
Сиртуин 1 (SIRT1) е важен регулатор на енергийната хомеостаза в отговор на наличието на хранителни вещества. Той регулира липидната хомеостаза и инсулиновата резистентност чрез регулиране на активирания от пероксизом пролифератори рецептор α (PPARα)/PGC1-α и GLUT4, съответно [20, 21]. Резултатите от анализа на вестерн-блотинг разкриват, че изобилието на протеин SIRT1 е намалено от постнаталната експозиция на HF диета (Фиг. 3). За бърза динамична промяна на сигнала, чувствителен към хранителни вещества, беше изследвана експресията на иРНК на други молекули, чувствителни към хранителни вещества. Както е показано на фиг. 4, чрез двупосочна ANOVA, разкрихме, че експресията на mRNA на PGC1-α в ретроперитонеалната мастна тъкан е намалена чрез постнатална HF диета (Hit 2, стр Фиг. 3
Резултати от Western blot анализ на SIRT1 в четирите експериментални групи. Изобилието на SIRT1 е показано след нормализиране с изобилие на ponceau S. Изобилието на SIRT1 протеин е намалено чрез постнатална диета с високо съдържание на мазнини (HF). VEH, нормална диета; DEX, пренатална експозиция на дексаметазон; VHF, постнатална СН диета; DHF, пренатална дексаметазон плюс постнатална СН диета
Пренаталната дексаметазон и постнаталната високочестотна диета предизвикват десинхронизация на експресията на циркадните гени на часовника
Последните проучвания разкриха връзката между десинхронизацията на тактовите гени в мастната тъкан и развитието на затлъстяване [22, 23]. По този начин, ефектите на пренаталния дексаметазон и постнаталната СН диета върху експресията на иРНК на гени, свързани с циркаден ритъм, бяха допълнително тествани. Експресията на mRNA на Bmal-1 е повлияна от пренаталното лечение с DEX, но не и от постнаталната HF диета (фиг. 5а). Както Hit 1, така и Hit 2 не повлияват значително експресията на иРНК на Per1 и Per2 в ретроперитонеалната мастна тъкан (Фиг. 5b и c). Пренаталното лечение с дексаметазон намалява mRNA експресията на Cry1 и Cry2, докато постнаталната HF диета увеличава mRNA експресията на Cry1 и Cry2 в ретроперитонеална мастна тъкан без взаимодействие между двете лечения (Фиг. 5г и д). По подобен начин, експресията на иРНК на CLOCK и CKle е намалена чрез пренатално лечение с дексаметазон, но е увеличена чрез постнатална HF диета без значително взаимодействие между Hit 1 и Hit 2 (Фиг. 5f и g). Експресията на mRNA на Rev-erbα в ретроперитонеална мастна тъкан се засилва чрез постнатална HF диета (Hit 2, стр = 0,002), но не чрез пренатално лечение с DEX и без значително взаимодействие между Hit 1 и Hit 2 (Фиг. 5h).
Дискусия
В настоящото проучване използвахме животински модел, за да изследваме ефектите на пренаталния дексаметазон (хит 1) и постнаталната HF диета (хит 2) върху метаболитните прояви. Пренаталното лечение с дексаметазон е използвано като модел за пренатален стрес, тъй като плодът е често изложен на глюкокортикоиди по време на пренатален стрес [24, 25]. Доказано е, че лечението с пренатален дексаметазон повишава чувствителността на потомството към програмирано затлъстяване, предизвикано от диетата с HF, инсулинова дисрегулация и хипертония [6, 9, 10]. Тук разгледахме по-нататък дисрегулацията на хранително-чувствителните молекули и циркадните часовници в ретроперитонеалната мастна тъкан, индуцирана от пренатално лечение с дексаметазон и постнатално HF лечение. Нашето проучване показа, че пренаталният дексаметазон плюс постнаталната СН диета показват синергични ефекти върху телесното и висцералното затлъстяване. Нещо повече, пренаталното лечение с дексаметазон и постнаталната СН диета показват отчетливи влияния върху чувствителните на хранителни вещества молекули в ретроперитонеалната мастна тъкан. Пренаталното лечение с дексаметазон и постнаталната СН диета също променят експресията на циркадни гени в ретроперитонеалната мастна тъкан.
Смята се, че хроничното възпаление и дисрегулацията на адипокин са характеристики на затлъстяването. Съобщава се, че концентрацията на TNFα в мастната тъкан е свързана със затлъстяването и инсулиновата резистентност при пациенти със и без диабет тип 2 [26, 27]. TNFα може да повиши системната инсулинова резистентност, като насърчава освобождаването на мастни киселини от мастната тъкан в кръвта, за да действа върху тъкани, като мускулни и чернодробни тъкани. По този начин TNFα може да действа локално в мастната тъкан, което в крайна сметка насърчава инсулиновата резистентност в периферните тъкани [28]. В нашето проучване установихме, че нивото на TNFα в плазмата се повишава от постнаталната експозиция на СН, но не и от пренаталното лечение с дексаметазон. Въпреки че лечението с пренатален дексаметазон изглежда не повишава нивото на TNFα в плазмата, то намалява експресията на mRNA на TNF-R1 и TNF-R2 в ретроперитонеалната мастна тъкан. Този резултат предполага, че пренаталното лечение с дексаметазон може да доведе до TNFα резистентност чрез инхибиране на TNF-Rs в местната мастна тъкан.
Бозайниците имат циркадни ритми, включващи набор от гени с циркаден часовник, за да се адаптират към колебанията в околната среда. В допълнение към циркадните ритми, тези циркадни часовници също играят важна роля в енергийната хомеостаза и метаболизма [32]. Turek et al. илюстрира това хомозиготно Часовник мутантните мишки могат да развият метаболитен синдром, показващ хипергликемия, хипоинсулинемия и чернодробна стеатоза [23]. Циркадният часовник се регулира от вериги с отрицателна обратна връзка, медиирани от хетеродимерните транскрипционни фактори CLOCK-BMAL1 и техните транскрипционни цели, включително PER и CRY протеини, които директно потискат CLOCK-BMAL1 активността, както и REV-ERB и ROR ядрени рецептори, които контролират Експресия на BMAL1 [35]. В нашето проучване анализирахме експресията на иРНК на гени, свързани с циркаден часовник, и показахме, че експресията на иРНК на Bmal-1, cry1, cry2, Clock и CKle е повлияна от пренаталното лечение с дексаметазон. Експресията на mRNA на cry1, cry2, Clock, CKle1 и Rev-erbα са повлияни от постнаталната HF диета. По този начин, пренаталното лечение с дексаметазон и СН след раждането показват различни влияния върху експресията на гени с циркаден часовник.
Взаимната връзка между чувствителността на хранителните вещества и циркадния часовник беше адресирана [14,15,16]. Например AMPK може да задейства фосфорилирането и разграждането на PER/CRY на циркаден часовник [36]. Циркадният часовник може да регулира чувствителността на хранителни вещества PPARαβγ и индуцираното от диетата затлъстяване се появява при доминиращи отрицателни мутантни мишки в CLOCK [14]. NAD +/SIRT-1 се предлагат като интегратори на циркадни ритми и път на чувствителност на хранителни вещества [14]. Проучванията показват, че SIRT1 взаимодейства с CLOCK-BMAL1, за да регулира директно експресията на контролирани от циркадния часовник гени чрез деацетилиране на PER2 и/или BMAL1 [37, 38]. За разлика от това, спасяването на NAD + също може да се регулира от CLOCK-BMAL1 [39]. Тези открития подчертават взаимозависимостта на чувствителността на хранителните вещества и циркадния часовник.
Заключение
В обобщение, нашето проучване показа, че затлъстяването, програмирано от пренатален дексаметазон и постнатална СН диета, води до различни промени в хранителните сензорни сигнали и циркадни часовници в ретроперитонеалната мастна тъкан. Следователно, представянето на нулиращите молекули, чувствителни на хранителни вещества и гените с циркаден часовник, има потенциална терапевтична връзка по отношение на патогенезата и лечението на пренатален стрес и метаболитни нарушения, свързани с диета след раждането.
- Лекарство за рак на панкреаса, диета с високо съдържание на мазнини, свързана с риска от чернодробни заболявания
- Смес от излагане на EDC и диета с високо съдържание на мазнини влияе върху социалното поведение, открития от проучвания върху животни -
- Месец на затлъстяването на домашни любимци - Ползи от балансираната диета - Whiskas
- Конференции за затлъстяване Конференции за управление на теглото Конференции за управление на диетата Конференция за затлъстяване
- Затлъстяването е като удавяне - диетичен лекар