Тацухико Ураками
1 Катедра по педиатрия, Медицинско училище в Университет Нихон, Токио, Япония
Резюме
Зрелостният диабет на младите (MODY) се характеризира с автозомно доминантно наследяване, начало преди 25-годишна възраст, отсъствие на β-клетъчен автоимунитет и поддържана функция на β-клетките на панкреаса. Към днешна дата са идентифицирани мутации в поне 14 различни гена, включително шест гена, кодиращи протеини, които съответно съответстват на MODY подтипове 1-6: хепатоцитен ядрен фактор (HNF) 4α (HNF4α), глюкокиназа (GCK), HNF1α (HNF1α ), панкреатичен и дуоденален хомеобокс 1 (PDX1), HNF1β (HNF1β) и неврогенна диференциация 1 (NEUROD1). Диагностичните инструменти, базирани на наличните в момента генетични тестове, могат да улеснят правилната диагноза и подходящо лечение на пациенти с MODY. Кандидатите за генетично изследване включват неносещи пациенти с хипергликемия, липса на доказателства за автоимунитет на β-клетки, устойчива функция на β-клетки и силна фамилна анамнеза за подобен тип диабет сред роднини от първа степен. Освен това, идентифицирането на подтипа MODY е важно, като се имат предвид свързаните с подтипа разлики във възрастта на началото, клиничното протичане и прогресията, вида на хипергликемията и отговора на лечението. Този преглед обсъжда настоящите перспективи за диагностиката и лечението на MODY, особено по отношение на шестте основни подтипа (MODY 1-6).
Въведение
Зрелостният диабет на младите (MODY) е докладван за първи път през 1974 г. като лек семеен диабет с доминиращо наследство.1 Класически MODY се характеризира с автозомно доминиращо наследяване, начало преди 45-годишна възраст, липса на β-клетъчен автоимунитет, 2 липса на инсулинова резистентност, 3 и поддържана функция на β-клетките. Новите диагностични критерии, изложени в Практическите насоки за MODY през 2008 г.4, включват поява преди 25-годишна възраст при един член на семейството, наличие на диабет в две последователни поколения, липса на β-клетъчни автоантитела и устойчива ендогенна секреция на инсулин. Запазената функция на β-клетките се показва от липсата на необходимост от лечение с инсулин или ниво на серумен С-пептид> 200 pmol/L дори след 3 години лечение с инсулин.
Молекулярните методи за диагностика на MODY са въведени за първи път след 90-те години. Към днешна дата са съобщени мутации, свързани с MODY, в най-малко 14 различни гена, 5–14, включително следните шест гена, кодиращи основни фактори: хепатоцитен ядрен фактор (HNF) 4α (HNF4α), глюкокиназа (GCK), HNF1α (HNF1α), панкреас и дуоденален хомеобокс 1 (PDX1), HNF1β (HNF1β) и неврогенна диференциация 1 (NEUROD1), които съответстват на MODY подтипове 1–6, съответно. Следните осем гена са идентифицирани като евентуално причинители в MODY подтипове 7–14, съответно: Kruppel-подобен фактор 11 (KLF11); липаза на карбоксилов естер; ген, съдържащ сдвоени кутии (PAX4); инсулин (INS); В-лимфоцитна киназа; аденозин трифосфат (ATP) -свързваща касета, член от подфамилия C (CFTR/MRP) (ABCC8); калиев канал, коригиращо вътрешно подсемейство J, член 11 (KCNJ11); и адаптер протеин, взаимодействие на фосфотирозин, PH домейн и левцинов цип, съдържащ 1 (APPL1) .11,12 Причиняващите гени за MODY и техните медицински състояния са показани в таблица 1 .
маса 1
Причинителните гени за зрелия диабет на младите (MODY) и медицински състояния, свързани с всеки подтип MODY
За да се подобри прогнозата на MODY, е важно да се идентифицират засегнатите субекти възможно най-рано. За тази цел са налични специфични молекулярни анализи, за да се предскаже клиничното протичане на заболяването и да се предложи най-подходящото лечение.14 Въпреки това, приблизително 80% от пациентите с MODY могат да бъдат неправилно диагностицирани със захарен диабет тип 1 или тип 2 при диагностициране, 17 и текущи изчисления показват забавяне от приблизително 15 години от диагнозата диабет до генетичната диагноза MODY.17
Този преглед обсъжда настоящите перспективи за диагностиката и лечението на MODY, по-специално шестте основни подтипа (MODY 1–6).
Диагностика на MODY
В момента се провеждат генетични тестове в световен мащаб, за да се улеснят прогнозите за клиничния ход и прогнозата на MODY. Известни свързани с MODY гени могат да бъдат идентифицирани чрез директно секвениране със степен на чувствителност до 100%, 14 и методите за секвениране от следващо поколение (например генно насочено и цялостно екзомно секвениране) са успешно използвани за идентифициране на мутации в MODY гени. 16 Генетичните тестове обаче остават скъпи и задължително се ограничават до случаи на силно подозиран MODY. На тези пациенти трябва да се предложи най-подходящото лечение измежду различни фармакологични терапии, включително перорални антидиабетни лекарства (OAD) и инсулин.
Диагностика на подвидовете на MODY
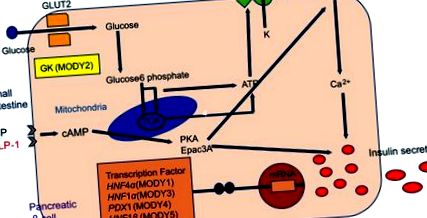
sA, както е показано в таблица 1, са докладвани най-малко 14 MODY подтипа, от които 1–6 са основните подтипове. Както беше отбелязано по-горе, бяха идентифицирани осем други подтипа, включително MODY 14, който наскоро беше свързан с причинителния ген APPL1 в големи семейства.20 Повечето MODY-причинители, с изключение на GCK, кодират транскрипционни фактори, изразени в β-клетки на панкреаса (Фигура 1 ). Определянето на подтипа MODY е важно, тъй като подтиповете се различават по отношение на възрастта на началото, клиничното протичане и прогресията, вида на хипергликемията и отговора на лечението.14 Повечето пациенти с MODY проявяват клиничните характеристики на изолиран диабет или лека хипергликемия на гладно. Някои подтипове на MODY обаче са свързани с допълнителни прояви, като бъбречни аномалии (MODY5) или екзокринна дисфункция на панкреаса (MODY8). Този преглед описва основно клиничните характеристики на шестте основни подтипа на MODY.
Изразяване на зрелостния диабет на младите (MODY) -причиняващи гени в β-клетките на панкреаса и механизъм на секреция на инсулин.
Съкращения: АТФ, аденозин трифосфат; сАМР, цикличен аденозин 3', 5'-монофосфат; PKA, протеин киназа А; Epac, обмен на протеин, директно активиран от cAMP; KATP канал, ATP чувствителен калиев канал; VDCC, зависим от напрежението калциев канал; GCK, глюкокиназа; HNF4α, хепатоцитен ядрен фактор 4α; HNF1α, хепатоцитен ядрен фактор 1α; PDX1, панкреатичен и дуоденален хомеобокс 1; HNF1β, хепатоцитен ядрен фактор 1β; NEUROD1, неврогенна диференциация 1.
MODY2 (GCK-MODY)
GCK, глюкозен сензор, експресиран в β-клетки на панкреаса, е ключов ензим в метаболизма на глюкозата, който катализира превръщането на глюкозата в глюкозо-6-фосфат и по този начин контролира глюкозо-медиираната секреция на инсулин. Повече от 600 мутации в GCK са идентифицирани в> 1000 семейства и тези промени водят както до хипергликемия, така и до хипогликемия.21 Хетерозиготните неактивни мутации са свързани с лека и често субклинична хипергликемия от раждането и това състояние постепенно се влошава с възрастта11 По същество тези мутации повишават прага на глюкозата за секреция на инсулин, което води до повишено ниво на глюкоза на гладно (5,5–8 mmol/L). Такива пациенти показват леко повишаване на 2-часовото ниво на плазмена глюкоза по време на перорално тестване на глюкозен толеранс (OGTT; увеличение на 4,5 mmol/L = 90-ти персентил). 4,22 Тези пациенти обикновено имат ниво на HbA1c от 400 различни мутации на HNF1a, 30 от които мутация (P291fsinsC) в екзон 4 е най-често.31 Хетерозиготните мутации на HNF1a причиняват прогресиращ дефицит на инсулин, който се проявява като лека хипергликемия в детска възраст и като диабет по време на ранна възраст.15,32 MODY3 рядко се открива при деца под 8 години годишна възраст.15
Хипергликемията, свързана с MODY3, може да бъде прогресивна и да се влошава. При тези пациенти рисковете от микроваскуларни и макроваскуларни усложнения са подобни на тези, наблюдавани при пациенти с диабет тип 1 и тип.33 Интересното е, че носителите на мутация на HNF1a развиват постпрандиална гликозурия преди началото на диабета поради бъбречна тубулна дисфункция и следователно ниска бъбречна функция праг за абсорбция на глюкоза.34 При плода мутационната хетерозиготност на HNF1a не влияе върху теглото при раждане, тъй като секрецията на инсулин в утробата остава нормална.35
MODY1 (HNF4α-MODY)
Транскрипционният фактор HNF4α се експресира предимно в черния дроб, но също така и в панкреаса и бъбреците36, където регулира експресията на гени, необходими за транспорта и метаболизма на глюкозата. Мутациите в HNF4α са сравнително необичайни, като представляват приблизително 5% от всички MODY случаи. Фенотипично MODY1 поради хетерозиготна мутация на HNF4α се проявява като прогресивен дефицит на инсулин, подобен на този, наблюдаван в MODY3. Феталната HNF4α хетерозиготност води до макрозомия поради хиперинсулинемия в утробата и последваща преходна или персистираща хипогликемия на новороденото, която реагира на диазоксид.37 Гликозурия не се наблюдава в MODY1, за разлика от MODY3. Хиперинсулинизмът, свързан с MODY1, обикновено отстъпва по време на ранна детска възраст, последван от постепенно намаляване на ендогенното производство на инсулин и появата на диабет в юношеска възраст.14 Освен това, HNF4α е свързан с метаболизма на триглицеридите и носителите на мутации могат да показват намалени нива на аполипопротеини (apoAII, apoCIII и апоВ) .38
MODY5 (HNF1β-MODY)
MODY4 (PDX1-MODY)
PDX1 е транскрипционен фактор, съдържащ хомеодомен, който действа както в екзокринната, така и в ендокринната програма за развитие на панкреаса и влияе върху развитието на панкреаса и експресията на INS.45 Хомозиготните мутации в PDX1 причиняват агенезия на панкреаса и хипоплазия и постоянен неонатален диабет, 46 докато хетерозиготни мутации водят до β- клетъчно увреждане и хипергликемия, включително постоянен неонатален диабет. MODY4 е много рядък подтип.
MODY6 (NEUROD1-MODY)
NEUROD1 е транскрипционен фактор с основна верижна спирала, участващ в развитието на панкреаса и невроните. Той играе важна роля за узряването и поддържането на β-клетките на панкреаса. Островчетата, в които липсва NEUROD1, реагират слабо на глюкозата и показват глюкозен метаболитен профил, подобен на незрелите β-клетки. Хетерозиготните мутации в NEUROD1 индуцират диабет в детска или възрастна възраст, докато хомозиготните мутации могат да причинят неонатален диабет, неврологични аномалии и обучителни затруднения.47–49
Възрастите на началото, степента на хипергликемия, засягането на специални тъкани и клиничните характеристики на други подтипове на MODY са показани в Таблица 1 .
Как може да се диагностицира правилно MODY?
Случаите на MODY често са погрешно диагностицирани като диабет тип 1 или тип 2 при представяне.13,14,19 Съответно, подобрението на диагностичната значимост ще изисква целенасочен подбор на субекти за генетично тестване, особено в сценарии с ограничени ресурси. Предложени са различни алгоритми за избор на кандидати за генетично изследване. 13,50 Според скорошни диагностични критерии 4 MODY се характеризира с поява преди 25-годишна възраст, наличие на диабет в две последователни семейни поколения, липса на β-клетъчни автоантитела, и запазена ендогенна инсулинова секреция със серумно ниво на С-пептид> 200 pmol/L. Тези диагностични критерии са добре приети за разграничаване на MODY от диабет тип 1 и тип 2. Shields et al.50 освен това предлагат модел, при който възраст под 30 години при поставяне на диагнозата е най-полезният дискриминатор между MODY и диабет тип 2. В този модел семейният произход на диабета увеличава вероятността за диагностициране на MODY с 23 пъти сред пациентите, които за първи път са диагностицирани с диабет тип 1.
Диагностичен алгоритъм за зрял диабет на младите (MODY).
Лечение на MODY
Правилното определяне на подвида MODY е важно, тъй като това информира за решения относно подходящо лечение и прогноза. Деца и юноши, диагностицирани с диабет, могат първоначално да бъдат лекувани с инсулин и този режим често продължава дори след стабилизиране на гликемията. Въпреки това, при някои пациенти с MODY хипергликемията може да се контролира чрез предписване на OAD (напр. Сулфонилурейни производни, без да се използва инсулин. Освен това изборът на подходящо лечение за тези пациенти е важен за подобряване на качеството на живот.
MODY2 (GCK-MODY)
MODY3 (HNF1α-MODY) и MODY1 (HNF4α-MODY)
Друга терапевтична възможност, включваща глюкагон-подобен пептиден (GLP-1) агонист с подобен ефект на понижаване на глюкозата като сулфонилурейните продукти и ниска честота на хипогликемия, е предложена за пациенти с MODY3,69,70 Двойно сляпо, рандомизирано кръстосано проучване, което сравнява GLP-1 агонист (лираглутид) със сулфонилурея (глимепирид) не открива разлика между двете лекарства по отношение на контрола на плазмената глюкоза на гладно и чувствителната плазмена глюкоза след хранене спрямо изходното ниво. Обаче глимепиридът беше ясно свързан с по-висока честота на хипогликемия.70 Изпитвахме подобно добри редуциращи глюкозата ефекти и липса на хипогликемия при деца с MODY3, лекувани с лираглутид.71 Освен това, по-рано съобщавахме, че преминаването от глимепирид към дипептидил-пептидаза-4 (DPP-4) инхибитор, алоглиптин, дава подобен гликемичен контрол без хипогликемия при момиче с MODY1.72
MODY5 (HNF1β-MODY)
За разлика от пациентите с MODY3 и MODY1, тези с MODY5 не реагират адекватно на лечение със сулфонилурейни продукти, вероятно поради коморбидна панкреатична хипоплазия и известна степен на чернодробна инсулинова резистентност.76 Тези пациенти може да се нуждаят от интензивно инсулиново лечение за контрол на хипергликемията. Освен това при тези субекти са описани микросъдови усложнения 6 и е необходимо лечение на бъбречно заболяване, чернодробна дисфункция и дислипидемия. Управлението на бъбреците е особено важен аспект на лечението при пациенти с мутации на HNF1β, тъй като тези индивиди ще развият бъбречна дисфункция до 45-годишна възраст, а половината ще прогресират до краен стадий на бъбречно заболяване.
Настоящите лечения на други подвидове MODY според молекулярните причини и клиничните характеристики са изброени в Таблица 1. Въпреки това, не са установени стандартни лечения за повечето подтипове поради малък брой случаи и липса на данни, потвърждаващи ефикасността на лечението. Освен това само метформин и инсулин са одобрени за употреба при младежи в повечето страни. Сулфонилурейните продукти са одобрени за употреба при юноши в някои страни. Други OAD не са одобрени за използване в тези Tattersall RB. Лек фамилен диабет с доминиращо наследство. Q J Med. 1974; 43: 339–357. [PubMed] [Google Scholar]
- Зрелостният диабет на младите (MODY) Причини, симптоми и лечения
- Зрелостният диабет на младите (MODY) Diabetes UK
- Симплекс на херпес симплекс (HSV-1 и HSV-2) Симптоми на вируса, диагностика, лечение
- Херпес симплекс Диагностика и лечение
- Хиатална херния Симптоми, причини, диагностика и лечение