Дженифър Бешел
1 Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 11724, САЩ
Джош Дубнау
1 Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 11724, САЩ
Yi Zhong
1 Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 11724, САЩ
Свързани данни
Обобщение
Лептинът, типично произведен от мастна тъкан „хормон на ситостта“, има добре установена роля в регулирането на теглото. Тук ние описваме функционално запазен модел на генетично индуцирано затлъстяване при дрозофила, чрез манипулиране на аналога на лептината на мухата Unpaired 1 (upd1). Неочаквано нокдаунът, специфичен за клетъчния тип, разкрива upd1 в мозъка, а не в мастната тъкан, медиира черти, свързани със затлъстяването. Нарушаването на извлечения от мозъка upd1 при мухите води до всички отличителни белези на затлъстяването при бозайниците: повишено привличане към хранителните сигнали, увеличен прием на храна и повишено тегло. Тези ефекти се медиират от безкуполни рецептори върху неврони, експресиращи Drosophila Neuropeptide F, орексигенния хомолог Neuropeptide Y на бозайници. In vivo 2-фотонното изображение разкрива upd1 и без купол инхибира този хедоничен сигнал при хранени животни. Манипулациите по тази централна верига също създават свръхчувствителност към обезогенни условия, подчертавайки критичното взаимодействие между биологичното предразположение и околната среда при преобладаване на наднорменото тегло и затлъстяването. Ние предлагаме подобряване на адипоз и мозък/Лептинът може да контролира различни характеристики на регулиране на теглото чрез различни невронни вериги.
Графичен резюме
Въведение
Затлъстяването е разстройство със сложна етиология, най-вероятно резултат от взаимодействието между генетични и екологични фактори, които влияят на невронни и метаболитни събития. Докато нервните вериги, допринасящи за това сложно поведение при бозайниците, продължават да бъдат обект на интензивни изследвания (Sohn et al., 2013), през последните години дрозофилата се очертава като целесъобразен модел за изследване на контрола на централната нервна система върху приема на храна и телесното тегло ( Al-Anzi et al., 2010; Albin et al., 2015; Dus et al., 2015; Mann et al., 2013; Min et al., 2016; Miyamoto et al., 2012; Schoofs et al., 2014 ). Ролята на Drosophila Neuropeptide F (npf), регулираща оценката на миризмата на храна (Beshel и Zhong, 2013) и насърчавайки приема на храна (Hergarden et al., 2012; Wu et al., 2003), е особено интригуваща, като се има предвид нейната хомология с невропептид Y на бозайниците (NPY) (Brown et al., 1999), виден регулатор на свързаното с храните апетитно поведение (Day et al., 2005; Flood and Morley, 1991).
При бозайниците, невроните, експресиращи NPY в хипоталамуса, директно се инхибират от Leptin (Pinto et al., 2004; Stephens et al., 1995), получен от мазнини анорексигенен хормон и основен детерминант на енергийната хомеостаза (Halaas et al., 1995; Lee et al., 1996; Tartaglia et al., 1995; Friedman, 2014). Бозайници с дефицит на лептин, като затлъстели индивиди (Pool, 2001), демонстрират повишено „харесване“ към храни (Domingos et al., 2014), по-голяма чувствителност към хранителни сигнали (Thanos et al., 2013), хиперфагия (Halaas et al., 1995) и значително увеличена телесна маса поради увеличените запаси от мазнини (Halaas et al., 1995). Неотдавнашна работа показва, че рецепторите без купол в дрозофила могат да се активират от човешки лептин, като свързващият афинитет към лептин към купето се доближава до този на човешкия лептинов рецептор съответно при 2,37 пМ и 1 пМ (Rajan и Perrimon, 2012; Tartaglia et al., 1995). Интригуващо е, че нокдаунът на ендогенен куполен лиганд Unpaired 2 (upd2) в мастното тяло (FB) на мухите води до по-малък размер на тялото и няма ефект върху храненето (Rajan and Perrimon, 2012). Това е противоположният признак на въздействие, наблюдаван при бозайници с дефицит на лептин (Halaas et al., 1995).
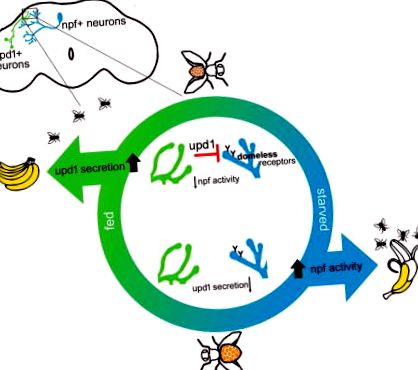
Тук демонстрираме, че мухите с прекъсвания към друг ендогенен лиганд за рецептора без купол, Unpaired 1 (upd1) (Wright et al., 2011), споделят характеристики, които съответстват на затлъстяването при бозайници. Ние показваме, че upd1 действа от източник в мозъка, а не от FB, за да контролира влечението към хранителните сигнали, приема на храна и наддаването на тегло. Ние също така показваме, че базиран на мозъка upd1 действа чрез рецептори без купол, за които разкриваме, че са разположени върху npf-положителни неврони. Този upd1: сигнален път без купол потиска активността на npf и по този начин регулира подходящото изразяване на поведението, свързано с храната. Генетичната и невронна верига, управляваща поведението, свързано със затлъстяването, което описваме в движение, е функционално запазена с веригата Leptin: Leptin Receptor: NPY при бозайници. В движение upd1 в мозъка действа като аналог на лептин, за да повлияе на остро поведение, което в крайна сметка води до наддаване на тегло.
Резултати
Подобен на лептин upd1, получен от мозъка, а не от мазнините, медиира поведението, свързано със затлъстяването при дрозофила
Както беше демонстрирано по-рано (Rajan и Perrimon, 2012), ние също така наблюдаваме, че специфичното за FB нокдаун на upd2 води до намалено тегло и няма ефект върху поведението при хранене. В допълнение, не открихме промени в привличането към сигналите за миризма на храна (фигури S1A – S1C). Това предполага възможността друг ендогенен лиганд за бездомни да допринесе за поведение, поддържащо затлъстяването или фенотипите с наднормено тегло в мухата. Оцветяването на мухите от FB на мухи показва, че Unpaired 1 (upd1) присъства и в мастната тъкан (Фигура S1D), но РНК интерференцията (RNAi), медиирана от нокдаун на upd1, насочена специално към FB, няма ефект нито върху привличането на храна, нито върху теглото ( Фигури S1E и S1F).
Въпреки това, оцветяването на upd1 в невронната тъкан разкри клъстер от двустранни upd1-положителни клетки в мозъка на мухата (Фигура 1А). Количественото определяне на upd1 имунооцветяването показва значително по-ниско ниво на натрупване на upd1 на нивото на клетъчното тяло в захранено състояние (Фигури 1B и 1C). Такава намалена флуоресценция е в съответствие с повишено ниво на освобождаване от тези клетки, когато се хранят мухи (Geminard et al., 2009; Rajan and Perrimon, 2012). За да потвърдим, че намалената флуоресценция при хранени мухи не се дължи на намалени нива на експресия на upd1, измерихме експресията на upd1 ген в цялата тъкан на главата на хранени и гладуващи мухи чрез qRT-PCR. Всъщност хранените мухи показват значително увеличен израз на upd1 спрямо гладувалите мухи (промяна в гънките: 1.83 ± 0.2; ΔCt хранени спрямо изгладени t = 3.54, p = 0.02).
Макар значително да се различава от родителския контрол, наблюдаваното наддаване на тегло беше умерено (Фигура 1G), така че след това се опитахме да определим дали промените в условията на околната среда могат да повлияят по различен начин на тези мухи. Доказано е, че въвеждането на диета с високо съдържание на мазнини насърчава наддаването на тегло при дрозофила (Birse et al., 2010) и установихме, че манипулираните с upd1 мухи имат повишена чувствителност към тази обезогенна среда. Тези мухи бяха видимо по-големи (Фигура 1I) с увеличено съхранение на мазнини (Фигура S2D). Докато наддаването на тегло при този режим с високо съдържание на мазнини не беше ограничено до мухи с нокдаун upd1 (Фигура 1J, вижте UAS-upd1 RNAi_a), ефектът беше три пъти по-висок при мухи без липса на upd1 в нервната тъкан (Фигура 1K). Излагането на диета с високо съдържание на захар доведе до подобен профил на наддаване на тегло (Фигура S2E и S2F).
Експресията на признаци, свързани със затлъстяването, които наблюдавахме при мухи, които нямат upd1 пан-невронално, беше спасена до нормални нива чрез повторно въвеждане на upd1 (чрез UAS-upd1 cDNA) или експресия на човешки лептин (UAS-човешки лептин cDNA) и дори upd2 ( UAS-upd2 cDNA) в мозъчната тъкан (фигури 1L – 1M). Взети заедно, тези резултати показват, че базираната на мозъка експресия сама по себе си определя въздействието на чертите, свързани със затлъстяването. Освен това, тези открития показват, че и трите тези аналога на лептин са способни да действат в мозъка, вероятно като лиганди за безкуполния рецептор (Rajan and Perrimon, 2012; Wright et al., 2011).
Фенотипите на затлъстяването в резултат на нокдаун upd1 могат да бъдат предизвикани или спасени остро
- Аюрведичен подход към храните и хранителните добавки за мозъка и неврологичното здраве -
- 3 Упражнение за отслабване на крака, за да опитате точно сега - Roxstar Fitness
- 7 принципа за овладяване на ума, за да се използва силата на подсъзнателния ум - щастливо консултиране на мозъка
- 10 неща, които се случват в мозъка и тялото в Adderall The Science Explorer
- Amen Solution Brain Based Diet