От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
От Националния сърдечно-съдов център (N.I., T.M., K.K., J.O., S.B.) и Катедрата по гериатрична медицина, Медицински факултет на Университета в Осака (T.K., J.H., T.O.), Суита, Осака, Япония.
Резюме
Заден план- Генът SA (SAH) е изолиран чрез диференциален скрининг от генетично хипертоничен щам на плъх като кандидат-ген, който може да допринесе за хипертония. Наскоро бе съобщено, че SA протеинът е силно хомоложен на говежди ксенобиотик, метаболизиращ средноверижна мастна киселина: CoA лигаза.
Методи и резултати- За изясняване на патофизиологичното значение на SAH, търсихме полиморфизми на човека SAH и извърши проучвания за асоциации, използвайки голяма кохорта (4000 субекта), представляващи общото население в Япония. Открихме 2 полиморфизма в промоторната област и еднонуклеотидни полиморфизми в интрони 5, 7 и 12 и екзон 8. Един от вариантите, A/G полиморфизъм в интрон 12, само на 7 bp нагоре от екзон 13, силно засегната плазма триглицериди, плазмен холестерол, индекс на телесна маса (ИТМ), съотношение между талията и ханша (Ш/В) и състояние на кръвното налягане. Ефектът на този генотип върху кръвното налягане изглежда се предава чрез въздействието му върху ИТМ и W/H. Преходната експресия на SA протеина в клетките на бозайници потвърди, че той се експресира в митохондрии и има средноверижна активност на мастна киселина: CoA лигаза. Установено е, че A/G полиморфизмът е свързан с нивото на експресия на SA mRNA в периферни мононуклеарни клетки in vivo.
Заключения- Алелът G на SAH е установено, че е свързано с множество рискови фактори, включително хипертриглицеридемия, хиперхолестеролемия, затлъстяване и хипертония. Това наблюдение трябва да отвори нова област за бъдещи изследвания на синдромите с множество рискови фактори.
Смята се, че взаимодействията между генетични и екологични фактори играят важна роля в патогенезата на често срещаните заболявания. Използването на проучвания за асоцииране в големи епидемиологични кохорти с голям брой еднонуклеотидни полиморфизми в един ген или в целия геном е нова стратегия за идентифициране на гени, които допринасят за често срещани заболявания. 1–3 В настоящото проучване ние приложихме тази стратегия към гена SA (SAH), за да се изследва дали влияе върху кръвното налягане.
SAH е изолиран чрез диференциален скрининг от генетично хипертоничен щам плъх, спонтанно хипертоничен плъх. 4 Изразът на SAH в бъбреците на спонтанно хипертоничния плъх е значително по-висок от този в бъбреците на нормотензивен контролен щам, плъх Wistar-Kyoto. SAH се изразява главно в проксимални тубули и хепатоцити. 5 Наскоро се съобщава, че SA протеинът е значително хомоложен на говежди ксенобиотик, метаболизиращ средноверижна мастна киселина (MCFA): CoA лигаза. 6 Анализите на няколко кохорти F2 плъхове 7,8 и установяването на няколко вродени щамове плъхове 9,10 потвърдиха, че локусът на SA гена допринася за регулирането на кръвното налягане при плъховете. По този начин, SAH е кандидат ген за есенциална хипертония при човека.
Няколко малки проучвания за асоциации обаче дадоха противоречиви резултати по отношение на това дали SAH допринася за хипертония при хората. 11,12 За да изясним този въпрос, ние старателно издирихме полиморфизмите на човека SAH и извърши проучвания за асоциации, използвайки голяма кохорта (4000 субекта), представляващи общото население в Япония.
Методи
Субекти
Критериите за подбор и дизайнът на проучването Suita са описани по-рано. 13 Генотипът на SAH е определен при 4039 субекта (получено е писмено информирано съгласие).
Характеристиките на субектите, анализирани в настоящото проучване, са обобщени в таблица 1 според A/G генотипа в интрон 12. Хипертонията се определя като систолично кръвно налягане ≥140 mm Hg, диастолично кръвно налягане ≥90 mm Hg или настоящата употреба на антихипертензивни лекарства. Общите нива на холестерол и триглицериди се определят чрез ензимни методи, като се използват комплекти (L-TC Wako, Wako Pure Chemical и Clinimate TG-2, Daiichi Chemicals).
Таблица 1101780. Характеристики на изследваната популация (общо)
ДНК изследвания
Геномната ДНК от 32 субекта беше използвана като шаблон за анализ на последователността. Регионът на промотора (до -2.1 kb), екзони 1 до 14 и техните флангови области бяха секвенирани. Последователностите на грунда ще бъдат предоставени при поискване. Полиморфизмите са определени чрез използване на системата TaqMan (PE Applied Biosystems) (Таблица 2).
Таблица 2101780. Грундове и сонди, използвани за генотипиране
Оценка на нивото на изразяване на SAH иРНК
Нивото на изразяване на SAH mRNA беше оценена чрез метод на конкурентна обратна транскрипция – полимеразна верижна реакция (RT-PCR). 14 синтезирана е сРНК, в която липсва регионът между нуклеотид 1064 и 1074 (присъединяване на GenBank D16350). РНК се екстрахира, както е описано по-рано 14 от периферни мононуклеарни клетки, пречистени чрез градиент на плътност на Ficoll. Периферните мононуклеарни клетки са получени от здрави лекари, които са разбрали значението на това проучване (получено е писмено информирано съгласие). Общата РНК (1 μg), комбинирана с делеционно-мутиралата cRNA, се транскрибира обратно и получената смес от cDNA се усилва от праймери, покриващи областта между нуклеотидите 968 и 1111. Дължината на PCR продукта от естествената иРНК е 144 bp и че от делеционно-мутиралата cRNA е 133 bp. Нивото на експресия на иРНК е дадено като съотношение на 144-bp PCR фрагмента към 133-bp фрагмента.
Експресионно проучване
Конструктът на израза за човека SAH е закупен от Invitrogen (готови за експресия човешки клонинги GeneStorm). SA cDNA се експресира под контрола на промотор на цитомегаловирус (CMV). COS1 клетките бяха временно трансфектирани от този експресионен вектор от LipofectAmine Plus Reagent (Gibco-BRL). Трансфектираните клетки се суспендират в буфер А (50 mmol/L Tris-HCl [pH 8.0], 1 mmol/L EDTA, 1 mmol/L дитиотреитол и 10% глицерол), съдържащ протеазен инхибиторен коктейл (Sigma) и се разрушават чрез ултразвук . Получената супернатанта се използва за ензимен анализ за ацил-КоА синтетаза. Активността на ацил-КоА синтетазата за октанова киселина и палмитоева киселина беше изследвана съгласно метода на Vessey и Hu. 15
За да се определи клетъчната локализация на SA протеина, сДНК, кодираща човек SAH с С-терминален Myc таг се субклонира в pCI експресионен вектор на бозайници (Promega) и се експресира в HeLa клетки. За да се открият SA протеинът и митохондриите едновременно, клетките се инкубират с анти-Myc-tag заешко поликлонално антитяло (MBL) и анти-човешки митохондрийни миши моноклонални антитела (Chemicon). След това клетките бяха двукратно оцветени с маркиран с Alexa Fluor 488 анти-заешки IgG и маркиран с Alexa Fluor 568 анти-миши IgG (молекулярни сонди).
За да изследваме значението на A/G полиморфизма в интрон 12, конструирахме миниген, който включваше региона между екзони 11 и 14 (3'-нетранслиран регион) под контрола на CMV промотора (pcDNA 3.1 като вектор). Правилно сплайсираният зрял транскрипт (М транскрипт) се открива като PCR продукт от 204 bp чрез използване на екзон 12 и 14 праймери. Неслоеният транскрипт беше открит като PCR продукт от 229 bp с праймери intron 12 и exon 13/14. Съотношението на М транскрипт към непилираната РНК се изразява като съотношение 209-bp към 229-bp PCR продукт. За оценка на нивата на експресия на М транскрипт на алелите A и G, pRL-CMV вектор (Promega), в който Ренила луциферазата е под CMV промотор, беше включена в трансфекционната смес като вътрешен стандарт. Нивото на експресия на М транскрипт се оценява чрез съотношението на PCR продукта от М транскрипт (204 bp) към това от луцифераза (283 bp).
За да изследваме регулаторните ефекти на инсерционния/делеционния полиморфизъм в промоторната област, ние конструирахме SAH гени за сливане на промотор/луцифераза. Полиморфизмите са инсерция/делеция (алели I и D) при -1037 и G (119952) Полиморфизъм при -407. Мястото за започване на транскрипцията беше определено от 5′-RACE и основното място беше номерирано +1. Определените хаплотипове са D/G, D/A, I/A и I/G. Промоторната област между -2052 и +253 беше субклонирана в pGL2-Basic (Promega), който не съдържа никаква промоторна последователност. Трансфекцията се извършва в MDCK клетки с PRL-CMV вектор (Promega) като вътрешен стандарт. Фотин и Ренила луциферазната активност се измерва с комплект (PG-DUAL-SP, Toyo Ink, Co).
По-подробно описание на материалите и методите, включително последователността на грундовете, ще бъде предоставено при поискване.
Статистически анализи
Стойностите се изразяват като средна стойност ± SEM или средна стойност ± SD. Всички статистически анализи бяха извършени със статистическите пакети JMP и StatView (SAS Institute Inc). Бяха извършени множество линейни регресии и множество логистични анализи с други ковариати (пол и възраст). Остатъците от стойностите на кръвното налягане, съотношението между талията и ханша (Ш/В), триглицеридите и холестерола са изчислени чрез корекция за пол и възраст. Различията в числените данни между групите бяха анализирани чрез еднопосочен/двупосочен ANOVA и несдвоени т тест. Разликите в честотите и степента на неравновесие на връзката бяха тествани чрез анализ на таблицата за извънредни ситуации.
Резултати
SAH полиморфизми
Полиморфизми, открити в SAH са обобщени в Таблица 3. Генотиповете в интрони 5 и 7 са в пълно неравновесие на връзката с полиморфизма на екзон 8 при 96 анализирани субекта. Следователно тези 2 полиморфизми не са тествани. Двойното неравновесие на връзката на I/D с полиморфизма на интрон 12 е показано в таблица 4.
Таблица 3101780. Полиморфизмите на SA Ген
Таблица 4101780. Неравновесие на връзката между I/D и Intron 12 полиморфизми
Проучване на асоциацията
Определихме генотиповете на промотор I/D, промотор G/A, екзон 8 G/C и интрон 12 A/G полиморфизми в цялата популация на изследването. Таблица 1 показва характеристиките на изследваната популация според полиморфизма на интрон 12. Тъй като имаше само 4 GG генотипа, GG и AG генотипите бяха обединени в една група.
Полиморфизмът на интрон 12 значително повлиява индекса на телесна маса (ИТМ), W/H, процент на антихипертензивно лечение, систолно и диастолично кръвно налягане, сърдечна честота, кръвна глюкоза на гладно и триглицериди (Таблица 1). След корекция на възрастта и пола, полиморфизмът на интрон 12 значително повлиява ИТМ, W/H, триглицериди и систолното и диастоличното кръвно налягане (Таблица 1). Алелът D в промотора има тенденция да влияе върху нивото на триглицеридите. Многократният регресионен анализ показва, че нивото на триглицеридите се определя от възрастта (P
Функция на SA протеина
Съобщава се, че SA протеинът е силно хомоложен на говежди ксенобиотик, метаболизиращ MCFA: CoA лигаза. 6 COS1 клетки, трансфектирани от pcDNA3.1/GS-човек SA има значително по-висока активност на ацил-КоА синтетаза за октанова киселина от тези, трансфектирани с pcDNA3.1/GS, което потвърждава, че човешкият SA протеин има активност MCFA: CoA лигаза (Фигура 1). 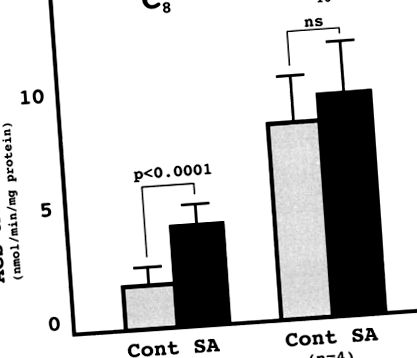
Фигура 1. Активност на ацил-КоА синтетаза (ACS) на трансфектирани Cos клетки. COS1 клетките бяха трансфектирани с pcDNA/GS-SA (SA) или pcDNA/GS (продължение). Оценена е активността на ACS за октанова киселина (С8) и палмитоева киселина (С16). Всяка стойност представлява средната стойност на 4 независими експеримента за трансфекция (средна стойност ± SD).
Анти-митохондрийните антитела показват подобен на спагети модел на оцветяване в HeLa клетки. Anti-Myc-tag антитялото показва подобен модел в трансфектираните клетки. Заключихме, че човешкият SA протеин е свързан с митохондрии (данните не са показани).
Функционално значение на полиморфизмите Intron 12 A/G и I/D на промотора
Оценихме нивата на експресия на SA mRNA според генотипа на интрон 12 A/G и промоторните I/D полиморфизми (Фигура 2). Нивото на експресия на SA mRNA в мононуклеарни клетки при субекти с AG генотип (всички DD генотип в промотора) (n = 4) е ≈4 пъти по-високо от това при субекти с AA генотип (1 II, 4 ID и 3 DD генотипове в промотора) (n = 8) (P= 0,0002). Изглежда, че I/D полиморфизмът няма значителни ефекти върху нивото на SA mRNA (данните не са показани).
Фигура 2. Ниво на експресия на SA mRNA според A/G полиморфизма. Нивото на експресия се измерва чрез конкурентна RT-PCR в периферни мононуклеарни клетки. Вмъкване, представителна конкурентна RT-PCR с ленти за SA mRNA (144 bp) и мутация на делеция cRNA (133 bp). Експресионните нива се оценяват с 3 нива на делеция-мутирала cRNA (1.0 × 105, 4.0 × 105 и 1.6 × 106 молекули/μg обща РНК; отляво надясно). Средно ± SD данни, получени от 8 субекта с AA генотип и 4 субекта с AG генотип.
Горното наблюдение предполага, че полиморфизмът на интрон 12 A/G може да повлияе на нивото на експресия на SA mRNA. Тъй като A/G полиморфизмът е в полипиримидиновия тракт на интрона и се предполага, че този тракт влияе върху сплайсинга, 16 изследвахме ефектите от този полиморфизъм върху ефективността на сплайсинг, което след това може да повлияе на нивото на експресия на иРНК.
Конструиран е миниген, който съдържа екзони 11 до 14 под контрола на CMV промотора. Нивото на експресия на правилно сплайсирания М транскрипт в сравнение с контролното ниво на РНК (Ренила луциферазна РНК) е значително по-висока при алела G, отколкото при алела A (фигура 3). Съотношението на М транскрипт към непилирания транскрипт е по-високо в алела G, отколкото в алела A (Фигура 3А). Този експеримент показва, че тази единична нуклеотидна промяна значително е повлияла на нивото на експресия чрез въздействие върху сплайсинга на този интрон при тези експериментални условия. Наскоро беше съобщено, че вариация на интронна последователност влияе върху нивото на експресия на иРНК в WNK1, което причинява псевдохипоалдостеронизъм тип II. 17
Функционалното значение на I/D полиморфизма на SAH се оценява чрез преходен трансфекционен анализ с MDCK клетки. Двупосочният ANOVA показва, че I/D полиморфизмът, но не и G (119952) A полиморфизмът, значително повлиява промоторната активност. Промоторната активност на D алела е около два пъти тази на I алела в MDCK клетки. Въпреки че този I/D полиморфизъм не повлиява нивото на иРНК в периферните мононуклеарни клетки (вж. По-горе), този полиморфизъм може да има функционално значение в други съответни тъкани, като бъбреци, черен дроб и мастна тъкан.
Дискусия
MCFAs са богати на мляко, кокосово масло и различни полусинтетични масла. 20,21 Активирането на MCFA се осъществява най-вече в митохондриалната матрица чрез ацил-CoA синтетази за MCFA и по-голямата част от MCFA, включена в хепатоцитите, е обект на β-окисление. 20,21 Някои от ацетил-КоА, получени по време на окислението на MCFA, са насочени към производството на кетон в тялото, а останалата част е насочена към ново синтезиране на дълговерижни мастни киселини (LCFA), които след това се включват в триглицериди или други сложни липиди. 20,21
В генетичното семейство на SA има ≥5 гена. 22 две (KS1 и KS2) са силно хомологични на целия SA протеин (Фигура 4). KS1 е локализиран ≈210 kb нагоре по веригата SAH. Тези ацил-КоА синтетази могат да бъдат функционално свързани със специфични метаболитни пътища, както се наблюдава в ацил-КоА синтетазите за LCFA в черния дроб. 23 По-високата експресия на SA протеина може да доведе до по-висок de novo синтез на LCFA от MCFA, тъй като G алелът е свързан с по-високо ниво на триглицериди в плазмата. Преференциалното отлагане на MCFA към триглицериди може да доведе до по-голямо натрупване на периферен триглицерид (висцерално затлъстяване) в дългосрочен план. Асоциацията на A/G полиморфизма с плазмения триглицерид е по-очевидна при субектите
Фигура 4. Хомология на аминокиселинната последователност сред предполагаемото семейство SA гени. Последователностите бяха получени от GenBank. SAH и KS1 са получени от NT010441. KS2 е получено от AK00588. Освен това са докладвани 2 други протеина, силно хомоложни на втората половина на SA протеина (AC003034). Мотив 1 показва предполагаем AMP-свързващ домен, характерен за ацил-КоА синтетази; мотив 2 показва предполагаем домен, характерен за ацил-КоА синтетазите за средноверижни мастни киселини.
- Коремното затлъстяване и връзката му със свързаното със здравето качество на живот при възрастни a
- Полиморфизмът в гена, кодиращ CART, не е свързан със затлъстяването при индианците Пима
- Асоциация между характеристиките при раждане, кърмене и затлъстяване в 22 страни СЗО
- Асоциация между раждането с цезарово сечение и затлъстяването в детска възраст, надлъжно кохортно проучване
- Асоциация между приема на алкохолни калории и наднорменото тегло и затлъстяването при възрастни с английски език
