Автоимунният тиреоидит след имунизация с тиреоглобулин от същия вид също се предотвратява чрез неонатална тимектомия при пилето (26) и плъховете (11).
Свързани термини:
- Болест на Грейвс
- Автоимунитет
- Т клетки
- Тиреоидит
- Йод
- Моноспецифично антитяло
- Автоимунно заболяване
- Системен лупус еритематозус
- Алел
Изтеглете като PDF
За тази страница
Физиология и дисфункция на имунната система
Резюме
Том II
Генетични фактори
Ролята на наследствеността при автоимунно заболяване на щитовидната жлеза е илюстрирана от многобройни проучвания, показващи по-висока честота на автоимунно заболяване на щитовидната жлеза или антитела на щитовидната жлеза при членове на семейството на пациенти с автоимунен хипотиреоидизъм и болест на Грейвс. 30 Това, че и двата вида заболявания на щитовидната жлеза заедно в семейства, осигурява допълнителна подкрепа за схващането, че тези състояния споделят причинни и патогенни характеристики. Предложени са редица модели на наследяване и кандидат-гени, но констатационните артефакти и недостатъците на изследванията на генетичните асоциации са довели до много несъответствия в резултатите. Изтънчените проучвания на близнаци са показали степен на съвпадение от само 22% за болестта на Грейвс - много по-ниска, отколкото се смяташе досега. 65
Най-важният фактор на податливост, който досега е признат, е асоциацията с конкретни HLA-DR алели; ролята, която тези MHC клас II гени играят в имунния отговор, ги прави отлични кандидати. 66 HLA-DR3 е свързан с болестта на Грейвс и тиреоидита на Хашимото при белите и дава относителен риск между 2 и 6, докато HLA-DR4 и HLA-DR5 са свързани с козметичен, но не атрофичен тиреоидит при някои бели популации. 67 Следродилният тиреоидит има само слаба връзка с HLA-DR5. Трябва да се отбележи, че небелите популации имат много различни HLA асоциации. 68
Инфекция и автоимунни заболявания на щитовидната жлеза
Сара Салехи Хамърстад,. Yaron Tomer, в Infection and Autoimmunity (Второ издание), 2015
1. Въведение
Автоимунните заболявания на щитовидната жлеза (AITD) включват редица състояния, които имат общи клетъчни и хуморални имунни реакции, насочени към щитовидната жлеза. AITDs включват основно болестта на Грейвс (GD) и тиреоидита на Хашимото (HT), като и двете включват инфилтрация на щитовидната жлеза от Т и В клетки, които реагират с щитовидни антигени, произвеждащи автоантитела на щитовидната жлеза, с произтичащите клинични прояви на хипертиреоидизъм при GD и хипотиреоидизъм в HT (прегледано в референции 1, 2). Докато етиологията на имунния отговор към щитовидната жлеза остава неизвестна, настоящата парадигма е, че AITD са сложни заболявания, при които гените за податливост и задействащите фактори от околната среда действат съвместно, за да инициират автоимунния отговор на щитовидната жлеза. В този преглед ние се фокусираме върху приноса на един фактор на околната среда - инфекцията - към патогенезата на AITD. Ние изследваме съответните данни, свързани с ролята на инфекциозните организми в развитието на AITD, с акцент върху механизмите, чрез които инфекцията може да предизвика AITD.
NOD.H-2h4 Мишки
Хелън Брейли-Мюлен, Шигуанг Ю, в Напредък в имунологията, 2015
2.3 Т клетки като ефекторни клетки в SAT
Нарушения на щитовидната жлеза
Генетична основа на автоимунната болест на щитовидната жлеза
Идентифицирани са гени за чувствителност към автоимунно заболяване на щитовидната жлеза (AITD). Те могат да бъдат разделени на имуномодулиращи гени и специфични за щитовидната жлеза гени.
Автоимунните полигландуларни синдроми (APS) са група заболявания, характеризиращи се с наличието на комбинация от множество автоимунни заболявания. AITD се среща често при тези пациенти. APS-1 наричан още автоимунна полиендокринопатия кандидоза ектодермална дистрофия е рядко моногенно заболяване, причинено от мутации в гена на автоимунния регулатор. APS-2 е най-често срещаният APS, комбинация от болестта на Адисън или с AITD (тиреоидит на Хашимото или болест на Грейв), или със захарен диабет тип 1 и наследството му е сложно с множество локуси (Michels & Gottlieb, 2010).
Инфекция и автоимунни заболявания на щитовидната жлеза
Ярон Томер, Роналд Вилануева, в Инфекция и автоимунитет, 2004
1. ВЪВЕДЕНИЕ
Автоимунните заболявания на щитовидната жлеза (AITD) включват редица състояния, които имат общи клетъчни и хуморални имунни реакции, насочени към щитовидната жлеза. AITD включват болестта на Грейвс (GD) и тиреоидита на Хашимото (HT), които включват инфилтрация на щитовидната жлеза от Т и В клетки, реактивни с щитовидни антигени, производство на автоантитела на щитовидната жлеза, с произтичащите клинични прояви (хипертиреоидизъм при GD и хипотиреоидизъм в HT) (прегледано в [1, 2]). Докато етиологията на имунния отговор към щитовидната жлеза остава неизвестна, настоящата парадигма е, че AITD са сложни заболявания, при които гените за податливост и задействащите фактори от околната среда действат съвместно, за да инициират автоимунния отговор на щитовидната жлеза. В този преглед ние се фокусираме върху приноса на един фактор на околната среда, а именно инфекцията, към патогенезата на AITD. Ще разгледаме уместните данни, свързани с ролята на инфекциозните организми в развитието на автоимунни заболявания на щитовидната жлеза (AITD), с акцент върху механизмите, чрез които инфекцията може да предизвика AITD.
Пролактин и мозайката на автоимунитета
Ваня Виейра Борба,. Йехуда Шоенфелд, в „Мозайка на автоимунитета“, 2019
Пролактин и автоимунно заболяване на щитовидната жлеза
Автоимунните заболявания на щитовидната жлеза включват основно две заболявания: болест на Грейв и тиреоидит на Хашимото. Етиологията е многофакторна, включваща генетични и екологични фактори, с голямо предимство при жените [129]. Високи нива на пролактин са открити при 20% от пациентите с автоимунно заболяване на щитовидната жлеза и имат двойно по-голяма честота сред автоимунния хипотиреоидизъм. Около 90% от пациентите с тиреоидит на Хашимото са показали значително по-високи нива на пролактин във връзка с намалени титри на кортизола [130]. Тепърва ще се определя ролята на допаминовите агонисти при лечението на автоимунни заболявания.
Щамът на затлъстелите пилета със спонтанен автоимунен тиреоидит като модел за болест на Хашимото
VI Имуногенетика
SAT е мултигенно заболяване. Както беше обсъдено по-горе, най-малко четири групи функционални аномалии участват в неговото развитие (Kroemer et al., 1989): (1) чувствителност на прицелен орган към автоагресивни ефекторни клетки, кодирани от единичен, автозомален, рецесивен ген; (2) обща хиперреактивност на Т клетки (повишена пролиферация, секреция на IL-2 и експресия на IL-2R при стимулация с Con A), регулирана от доминиращ, автозомен ген; (3) намален глюкокортикоиден тонус поради повишена плазмена концентрация на CBG, наследен като автозомно-рецесивен признак; (4) автозомно доминираща черта, ev22, която косегрегира с дефицит на повишаване на плазмения кортикостерон в отговор на антиген или инжектиране на GIF, например IL-1.
Първоначално хаплотипът на В-локус беше обсъден като възможен съществен фактор, управляващ резултата от SAT (Bacon et al., 1974, 1977, 1981). По-късно обаче стана ясно, че типът MHC играе само модулираща роля (Bacon and Rose, 1979), тъй като например високо реагиращ (високи титри на TgAAb и тежък SAT) и нисък отговор (липсващ TgAAb и ниска степен на SAT) могат да се развият подлинии, както хомозиготни за B15 (Hála, 1988).
Таблица II. Фактори, за които се смята, че влияят върху развитието на SAT в операционната система
| "Каменната ера" | 1956–1970 | 7–12 седмици | Секс | Възраст |
| "Средна възраст" | 1971–1983 | 5–10 седмици | MHC | Не-MHC гени за имунен отговор |
| „Съвременна епоха“ | 1984– | 2–4 седмици | Т-клетъчна хиперреактивност, чувствителност на целеви органи (диетичен йод), влияние върху околната среда (вирус, бактерии) | Глюкокортикоиди, тонус, хиперпродукция на IL-2, въздействие върху околната среда (вирус, бактерии), MHC |
Щитовидна жлеза
Лимфоцитен (след раждане, безболезнен, безшумен) тиреоидит
Епидемиология
Лимфоцитният тиреоидит се среща най-често при жени след раждането, като засяга до 6% от жените 2 до 12 месеца след раждането или прекратяването. Рядко това състояние се среща при жени след раждането или при мъже. Предразполагащите фактори включват анамнеза за предишни епизоди на следродилен тиреоидит, захарен диабет тип 1 и циркулиращи антитиреоидни автоантитела.
Патобиология
Това безболезнено възпаление на щитовидната жлеза може да причини преходна тиреотоксикоза, последвана от преходен или постоянен хипотиреоидизъм. Всяка от тези фази на дисфункция на щитовидната жлеза обикновено продължава 2 до 8 седмици. Смята се, че това състояние отразява преходния автоимунитет.
Диагноза
Диагнозата лимфоцитен тиреоидит често се пренебрегва, когато неспецифичните симптоми на тиреотоксикоза (напр. Загуба на тегло, безсъние, тревожност) или хипотиреоидизъм (напр. Умора, депресия) се тълкуват погрешно като често срещани оплаквания след раждането. Щитовидната жлеза е нежна и с нормални размери или умерено увеличена. След като се обмисли, диагнозата лимфоцитен тиреоидит може лесно да бъде потвърдена или изключена чрез лабораторно изследване, което разкрива потиснато ниво на TSH по време на фазите на тиреотоксикоза и повишено ниво на TSH по време на фази на хипотиреоидизъм. Това състояние трябва да се разграничава от болестта на Грейвс, която може да се прояви в същия период от време след раждането. Относителните градуси на надморска височина T4 и T3 понякога могат да дадат представа за това кое състояние е налице; лимфоцитният тиреоидит обикновено се характеризира с преобладаващо повишаване на нивата на Т4. Фракционното усвояване на радиойод или отсъства, или е много ниско в условията на лимфоцитен тиреоидит, но се увеличава при активна болест на Грейвс, като по този начин осигурява полезен диагностичен тест (вж. Таблица 233-6).
Лечение
Лимфоцитният тиреоидит често може да се управлява само с успокоение и наблюдение. Симптоматичната тиреотоксикоза може да бъде лекувана с ограничен курс на терапия с β-блокери. Откритият хипотиреоидизъм може да изисква преходно заместване на тироксин.
Прогноза
Докато най-засегнатите пациенти в крайна сметка се връщат в еутиреоидно състояние, 25% развиват персистиращ хипотиреоидизъм поради класически автоимунен тиреоидит .
Предсказване на автоимунно заболяване
Джордж С. Айзенбарт,. Роберто Джанани, в Автоимунните болести (Пето издание), 2014
Щитовидна жлеза
Автоимунното заболяване на щитовидната жлеза (AIT), проявяващо се като хипотиреоидизъм или хипертиреоидизъм, е много често сред общата популация. Приблизително 5% от населението е хипотиреоидно и 1,3% хипертиреоидно (Hollowell et al., 2002). AIT се наблюдава с повишена честота при лица с T1D (28% (Umpierrez et al., 2003)), болест на Адисън (AD) (14–21% (Betterle et al., 2002; Kasperlik-Zaluska et al., 1998; Zelissen et al 1995; Lendrum et al., 1975)), целиакия (CD) (до 12% (Ansaldi et al., 2003)) и други автоимунни заболявания. Следователно първата стъпка в прогнозирането изисква познаване на медицинската история на индивида. Обикновено се препоръчва рутинен скрининг за заболяване на щитовидната жлеза при тези индивиди, тъй като има голяма вероятност за предтестово заболяване и проучванията са относително неинвазивни.
Рискът за AIT е слабо свързан с HLA генотиповете, които варират в зависимост от популацията. Сантамария и др. (1994) съобщават, че DRB1 * 0201 увеличава риска от AIT при T1D. Kim et al. (2003) съобщават, че DQB1 * 0401 увеличава риска в корейската диабетна популация. DQB1 * 0302 е свързан с AIT в чешката диабетна популация (Sumnik et al., 2003). DR3 и DR5 са свързани с автоимунитет на щитовидната жлеза при немски кръводарители (Boehm et al., 1993).
AIT се придружава от автоантитела към антигени на щитовидната жлеза, антитиреоидна пероксидаза (TPO) и анти-тиреоглобулин (TG) (Vakeva et al., 1992). Тези автоантитела са положителни при приблизително 10% от общата популация (Hollowell et al., 2002) и при около 90% от хипотиреоидната популация (Vakeva et al., 1992). Проспективно проследяване от Vanderpump et al. (1995) в проучването на Whickham показва, че жените с положителни TPO автоантитела и нормален TSH имат 2,1% годишно риск от развитие на хипотиреоидизъм с общ риск от 27% от хипотиреоидизъм на 20 години.
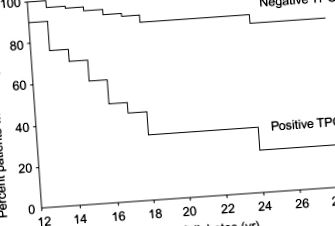
Във високорискови популации като T1D прогресията към AIT е свързана с наличието на TPO и TG антитела, като приблизително 80% от T1D положителни за TPO антитела прогресират до AIT в сравнение с 15% от тези TPO отрицателни (Umpierrez et al., 2003) (Фигура 78.6). Трябва да се отбележи, че хората с отрицателни TPO автоантитела все още са прогресирали до AIT, но с много по-ниска скорост.
Фигура 78.6. Развитието на хипотиреоидизъм в диабетната популация зависи от производството на автоантитела на щитовидната жлеза. Лицата, които изразяват TPO, са изложени на много по-висок риск от хипотиреоидизъм в сравнение с тези, които не го правят (Umpierrez et al., 2003).
Подобно на T1D, при който аномалии на метаболизма на глюкозата идентифицират лица с по-голям риск от клиничен диабет, хората, които имат аномалии на метаболизма на щитовидната жлеза, са изложени на повишен риск от развитие на явен хипотиреоидизъм. От тези с повишен TSH и нормален хормон на щитовидната жлеза, 55% са били хипотиреоиди на 20 години, с 4,3% годишна честота.
Скринингът за автоимунитет на щитовидната жлеза при високорискови популации като T1D с TPO и/или TG автоантитела може да идентифицира лица с повишен риск от автоимунно заболяване на щитовидната жлеза за по-внимателно наблюдение. Ефикасността на този скрининг не е напълно оценена.
- Атерогенна диета - общ преглед на ScienceDirect теми
- Остър ларингит - общ преглед на ScienceDirect теми
- Подкисляване - общ преглед на ScienceDirect теми
- Атрофичен гастрит - общ преглед на ScienceDirect теми
- Индекс на телесна маса - общ преглед на ScienceDirect теми