Резюме
Диагнозата на автоимунната хемолитична анемия (AIHA) може да бъде поставена с поетапен подход, който има за цел да идентифицира лабораторни и клинични доказателства за хемолиза и след това да определи имунната природа на хемолизата с директния антиглобулинов тест. След като бъдат изключени алтернативни причини за тези находки, се установява AIHA и клиницистът трябва да търси вторични причини, както и да идентифицира вида на AIHA. Понастоящем ритуксимаб е предпочитаното лечение от втора линия за първично топло AIHA и лечение от първа линия за първично студено заболяване на аглутинина (CAD), или като монотерапия, или в комбинация с бендамустин. Инхибиторите на комплемента показват полезност при стабилизиране на пациенти с AIHA с остра тежка хемолиза. Обсъждат се бъдещите перспективи и включват C1s инхибитор BIVV009 (сутимлимаб), който сега навлиза във фаза 3 на проучвания за CAD.
Цели на обучението
Разберете как AIHA и нейните подвидове могат да бъдат диагностицирани чрез комбинация от клинична оценка и лабораторни тестове
Опишете последните постижения в лечението на първична топла AIHA и студена болест на аглутинина
Подход към диагностиката на автоимунна хемолитична анемия
Автоимунната хемолитична анемия (AIHA) е декомпенсирана придобита хемолиза, причинена от имунната система на гостоприемника, действаща срещу собствените антигени на червените клетки. Последващото активиране на комплемента може да повлияе на клиничната картина и е нова цел за терапевтични подходи.
маса 1.
Изследвания при пациенти, представящи AIHA
| Първична оценка | |
| Хемолитичен екран | |
| FBC, кръвна цитонамазка, LDH, хаптоглобин, билирубин, DAT, брой ретикулоцити със или без урина за хемосидерин или пръчка за урина за микроскопия | |
| Откриване на основните заболявания (разследване на AIHA) | |
| Серумни Igs и електрофореза с имунофиксация * | |
| ХИВ, HBV, HCV | |
| Анти-dsDNA, ANA | |
| CT гръден кош, корем и таз | |
| Допълнително изследване при избрани пациенти с AIHA | |
| Изследване на костен мозък | CAD, възраст ≥ 60 години, анамнеза, анализи, FBC или цитонамазка, предполагащи възможна инфилтрация на костен мозък |
| U&E, LFT, съсирване, BP, пръчка за урина | Ако е бременна или тромбоцитопенична, за да се изключи DIC или свързана с бременността ТМА |
| Проверка на инфекцията | Зависи от симптомите, историята на пътуването и възрастта |
| Подгрупи на периферни Т-клетки, креатинин, LFT, съсирване | Всички деца и при съмнение за синдром на Evans |
| Първовирус, хематиника | Ако ретикулоцитопения |
| Допълнително серологично изследване при избрани пациенти с AIHA | |
| DAggT | Ако DAT е положителен за C3d ± IgG |
| Титър на студените антитела | Ако DAggT е положителен |
| Моноспецифичен DAT за IgM, G, A, C3d | При съмнение за DAT-отрицателна AIHA |
| Червените клетки се елуират | Ако се подозира (моноспецифична) DAT-отрицателна AIHA |
| Донат Ландщайнер | Ако DAT е положителен за C3d ± IgG и |
| i) DAggT-отрицателни или незначителни CA и | |
| ii) Възраст * Ако има съмнение за студено автоантитело, пазете пробата при 37 ° C, докато серумът се отдели. |
Променено от Hill et al, с разрешение. 12
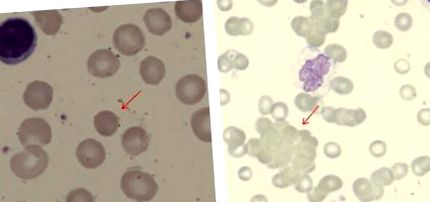
Появи на кръвни филми при пациенти с AIHA (и двете използват петно May Grunwald Giemsa). (А) Сфероцит при пациент с топъл AIHA (първоначално увеличение, × 100). (Б) Аглутинация на червените клетки при пациент със студена болест на аглутинина (× 40).
Таблица 2.
Причини за вътресъдова хемолиза
| Фиксиране на комплемента (напр.) |
| Пароксизмална нощна хемоглобинурия |
| Пароксизмална студена хемоглобинурия |
| Остри хемолитични трансфузионни реакции поради несъответстваща кръв |
| Някои автоимунни хемолитични анемии, ако фиксирането на комплемента позволява терминално активиране на комплемента (образуване на комплекс от мембранни атаки) на повърхността на червените кръвни клетки, причинявайки лизис |
| Механична травма (напр.) |
| Сърдечни клапи |
| Микротромби в циркулация - DIC, MAHA (TTP, HUS, aHUS) |
| Март хемоглобинурия |
| Токсични или екзогенни фактори (напр.) |
| Инфекции: Babesia, Clostridium, Leptospira, Falciparum malaria |
| Ухапвания от паяк |
| Змийски отрови |
| Токсичност за мед или цинк |
| Хипотонични разтвори |
aHUS, атипичен хемолитично-уремичен синдром; DIC, дисеминирана вътресъдова коагулация; HUS, хемолитично-уремичен синдром; MAHA, микроангиопатична хемолитична анемия; TTP, тромботична тромбоцитопенична пурпура.
След идентифициране на хемолитична анемия с положителен DAT, надяваме се очевидни причини, като забавена реакция на трансфузия от скорошно преливане, алоимунна хемолиза след трансплантация на твърди органи или алогенни стволови клетки, индуцирана от лекарства имунна хемолиза или хемолитична болест на новороденото. бързо се идентифицират чрез клинична оценка. Когато се обмислят алтернативи, трябва да се помни, че положителен DAT може да възникне в резултат на други процеси, като пасивно отлагане на антитела или имунни комплекси при чернодробни заболявания, хронична инфекция, злокачествено заболяване, системен лупус еритематозус (SLE), бъбречни нарушения и след лекарствени терапии, като IV Ig или анти-тимоцитен глобулин. Ако не се установи алтернативна причина, може да се постави диагноза AIHA. AIHA може да се появи рядко с отрицателен DAT чрез стандартни техники (например, поради ниско афинитетно антитяло или само IgA антитяло). Диагноза на DAT-отрицателна AIHA може да бъде поставена след внимателно изключване на алтернативни причини за хемолиза и потвърждение чрез чувствителна техника, когато е налице, и се подкрепя от отговор на стероидна терапия.
Следващата стъпка е да се изследва основното свързано състояние, което се открива при ~ 50% от пациентите, заедно с по-нататъшни серологични тестове за определяне на вида AIHA, тъй като подходът към лечението се различава (Таблица 1). Предложен диагностичен път за AIHA е показан на Фигура 2, въпреки че е признато, че има изключения (например, нискотитърно студено антитяло понякога може да бъде клинично значимо). Следователно, окончателната диагноза може да изисква синтез на клиничната картина и съвет от специализирана референтна лаборатория.
Диагностичен път за AIHA. DAggT, тест за директна аглутинация; DIIHA, индуцирана от лекарства имунна хемолитична анемия; HA, хемолитична анемия; HDN, хемолитична болест на новороденото; HTR, хемолитична трансфузионна реакция; PLS, синдром на пътнически лимфоцити; RT, стайна температура. * Окончателната диагноза CHAD или смесена AIHA се основава на цялостната клинична картина, включително подкрепящи серологични находки. † Например термичната амплитуда. ** Физиологично суспендирани червени клетки и серум на пациента при стайна температура за 30 до 60 минути. Адаптиран от Hill et al с разрешение. 12
Приблизително 65% от пациентите имат топъл AIHA; това може да се диагностицира при пациенти с постоянна клинична картина и DAT положителен само за IgG или когато DAT е положителен за C3d ± IgG, когато е изключено клинично значимо студено антитяло.
Студеният аглутининов синдром (CAS) може да бъде диагностициран при пациенти с лабораторни критерии, съответстващи на клинично значимо студено антитяло, което се проявява във връзка с вторични заболявания, като инфекция, SLE или агресивен лимфом.
Смесената AIHA се причинява от комбинация от топло IgG антитяло и студено IgM антитяло. DAT обикновено е положителен за IgG и C3d. Симптомите, свързани със студа, се появяват рядко, а студеното антитяло може да има нисък титър на антителата (напр. 4 При възрастни най-честите асоциации са хематологично злокачествено заболяване, инфекция и автоимунни нарушения. практика. Успешното лечение може също да подобри AIHA, но това не винаги е така, тъй като силата на асоциацията варира. Ако свързаното състояние не изисква лечение, AIHA обикновено може да се подходи по подобен начин на първичната AIHA, въпреки че решенията за лечение например, когато AIHA е свързана с някои разстройства, като SLE, тежестите и ползите от спленектомията са по-неблагоприятни в сравнение с първичната топла AIHA. Синдромът на Evan, при който AIHA е свързан с имунна тромбоцитопения (ITP), има важни разлики от първичната AIHA, по отношение на изключването на алтернативни причини за билитонна цитопения, идентифициране на вторични причини като aut оимунен лимфопролиферативен синдром и управление на неговия често рецидивиращ/ремитиращ клиничен курс.
В-клетъчните злокачествени заболявания са често срещана асоциация (напр. AIHA се среща при ~ 5-10% от пациентите с хронична лимфоцитна левкемия [CLL]). При пациенти с активна ХЛЛ, която също изисква лечение, комбинации, като ритуксимаб, циклофосфамид и дексаметазон (RCD); ритуксимаб, циклофосфамид, винкристин и преднизолон (R-CVP); и бендамустин и ритуксимаб (BR), изглеждат ефективни. Новите целеви терапии, като обинутузумаб, ибрутиниб, иделализиб и венетоклакс, биха могли да бъдат полезни за пациенти с AIHA; въпреки това е необходима бдителност поради потенциал за развитие на индуцирани от лекарството имунни цитопении, както се наблюдаваше по-рано при флударабин с един агент. 5 Този проблем е повдигнат и с ибрутиниб, но възникващата AIHA по време на терапията с ибрутиниб изглежда е израз на CLL активност, а не на лекарствено индуцирана хемолиза и лечението може да се прилага при пациенти с анамнеза за AIHA. 5,6
Общи стратегии за първична AIHA
Всички пациенти
Лекувайте всяка идентифицирана основна причина, като инфекция.
Еритропоезата се увеличава в отговор на хемолизата, което води до по-голямо търсене на фолат. Фолиевата киселина е добре поносима добавка за предотвратяване на дефицит, който може да изостри анемията.
Тестовете за съвместимост при пациенти, които се нуждаят от трансфузия, се фокусират върху идентифицирането на ABO CcDEe и K статуса на пациента, както и наличието на алоантитела. Това може да бъде постигнато чрез специални техники, като авто- или аллодсорбция (топли автоантитела) или скрининг на клетки за предварително затопляне и плазма на пациента отделно до 37 ° C преди използване в индиректния антиглобулинов тест (студени автоантитела). 7 Генотипирането може да бъде полезно, особено за сложни случаи, в които е желателно да се постигне удължен фенотип. Клиницистите трябва да са наясно, че пълното тестване за съвместимост може да отнеме от 4 до 6 часа и че предоставените единици няма да бъдат етикетирани като „съвместими“, тъй като автоантителата от немодифицирана плазма на пациента вероятно ще свържат донорните червени клетки в индиректен кръстосан тест с антиглобулинов тест. съвпада. Без анамнеза за кръвопреливане или бременност, малко вероятно е пациентът да има алоантитела. Ако анемията е животозастрашаваща, трансфузията на ABO Rh и K съвпадащи червени клетки може да е за предпочитане пред изчакването на пълното тестване за съвместимост.
Профилактика на венозна тромбоемболия: рискът от тромбоза при хемолиза все още е подценен, но остава важна причина за заболеваемост и смъртност при AIHA. В някои серии венозни тромбоемболии се наблюдават при до 20% до 25% от пациентите, обикновено когато хемолизата е активна. По-големи проучвания показват по-високи нива на венозна и артериална тромбоза при пациенти с AIHA 8,9 и по-наскоро при тези с CAD. Може би не е изненадващо, че рискът се увеличава с по-високи нива на LDH (ролята на интраваскуларната хемолиза и риска от тромбоза е обсъждана по-рано 11), както и при пациенти с предишна спленектомия. Тромбопрофилактиката с хепарин с ниско молекулно тегло се препоръчва при пациенти с остро обостряне на хемолизата и трябва да се има предвид при амбулаторни пациенти по време на тежки обостряния (хемоглобин 12
Пациенти с ИБС
При пациенти с ИБС интраваскуларната хемолиза може да бъде предизвикана от бактериални или други фебрилни заболявания и трябва да се лекува незабавно.
Пациентите с ИБС трябва да избягват излагане на студено време, когато е възможно, и да се обличат, за да предпазят дисталните крайници.
Докато е в болница, пациентът трябва да бъде на топло, особено в периоперативния период. Сърдечно-белодробният байпас представлява особено предизвикателство, свързано с обичайната практика на системно охлаждане и студена кардиоплегия. Системната нормотермия и топлата кардиоплегия обаче са признат метод и допълнителният екулизумаб успешно се използва за покриване на байпас хирургия. 13
Пациентите не трябва да получават студени течности IV и се препоръчва използването на вграден кръвен нагревател.
Пациенти, получаващи стероиди
Поради повишен риск от усложнения в горната част на стомашно-чревния тракт, антиацидната терапия, като инхибитор на протонната помпа, се препоръчва при пациенти, приемащи стероиди, ако има допълнителен рисков фактор, като предишна пептична язва, възраст ≥ 60 години, съпътстващи нестероидни анти -възпалително лекарство/антикоагулант/аспирин или съпътстваща тромбоцитопения.
Рискът от фрактури е повишен при пациенти, получаващи глюкокортикоиди за ≥3 месеца (преднизолон ≥ 7,5 mg/ден). Препоръчва се тези пациенти да бъдат посъветвани за промяна на начина на живот (спиране на тютюнопушенето, ограничаване на приема на алкохол до ≤2 U/d и редовно упражняване на тегло) и поддържане на адекватни дневни витамин D (600-800 IU) и калций (1000 -1200 mg) прием чрез диета, ако е възможно, или добавки, ако е необходимо. 14 Освен това за възрастни ≥40 години първоначалният абсолютен риск от фрактури трябва да бъде оценен с помощта на онлайн инструмента FRAX (https://www.shef.ac.uk/FRAX/tool.jsp), както и костния минерал тестване на плътност, ако е налично, за да се определи дали трябва да се предписва и перорален бисфосфонат. 14 Въпреки това, някои насоки също препоръчват мъжете на възраст над 50 години и жените в постменопауза да са изложени на достатъчен риск лечението да може да се обмисли без допълнителна оценка. 15
Първична топла AIHA
При пациенти, получаващи стероиди от първа линия, дългогодишното избрано лечение от втора линия е спленектомия. 21 Въпреки това, последните насоки на Обединеното кралство 12 и френските 22 вместо това предпочитат ритуксимаб. Това отразява относително големия брой публикувани серии от случаи, които са увеличили сигурността в неговата ефективност и поносимост. При мета-анализ на 154 пациенти, общата степен на отговор на топлата AIHA към ритуксимаб е била 79%, въпреки че не всички случаи са били първични, а някои са получавали едновременно стероиди. 23 Нежелани събития са настъпили при 38 от 364 (14%) пациенти с AIHA, получаващи ритуксимаб, включително 18 тежки инфекции. Приблизително 25% до 50% от отговорилите пациенти ще рецидивират в рамките на 2 до 3, докато процентът на дългосрочен отговор е неизвестен. 12
Приблизително 70% от пациентите с първична топла AIHA реагират на спленектомия, 12 и това продължава да бъде полезна опция от втора линия, когато икономическите ограничения ограничават достъпа до ритуксимаб. 24 Инфекциозните и тромботичните усложнения след спленектомия са добре разпознати. Малките серии предполагат ∼30% рецидив в краткосрочен план, 17,25, но за разлика от спленектомията за ИТП, дългосрочната трайност на ремисията е неизвестна. Алтернативни, относително нетоксични имуносупресивни терапии, като микофенолат мофетил, азатиоприн и циклоспорин, също могат да се използват като лечение от трета линия. Степента на отговор е трудна за изчисляване, тъй като доказателствата за ефикасност са ограничени до малки серии, които често нямат подробности, но те вероятно ще бъдат по-ниски, отколкото при ритуксимаб или спленектомия.
Пациенти, които са чувствителни към стероиди, но са рефрактерни или рецидивират след терапия от трети ред, могат да понасят по-продължително лечение с ниски дози преднизо (lo) ne (≤10 mg), което може да се използва заедно със стероид съхраняващ агент. 26 Алтернативи с по-голям потенциал за токсичност включват циклофосфамид, 27,28 алемтузумаб, 29 и трансплантация на хематопоетични стволови клетки. 30
Спасителни терапии
Пациентите могат да отнемат време, за да отговорят на имуносупресивна терапия (напр. Медиана от 3-6 седмици за ритуксимаб за топла AIHA). Следователно, тези с тежка трансфузионно зависима хемолиза може да се нуждаят от спасителна терапия. Това може да е със стероиди, ако се знае, че пациентът е чувствителен. Алтернативно, приблизително една трета от пациентите ще реагират на IV Ig, като по-добри отговори се наблюдават в най-тежките случаи (хемоглобин ≤ 70 g/L). Клиничната тежест на AIHA се влияе от компенсаторния отговор на костния мозък и се наблюдава ретикулоцитопения, особено при деца и тежки случаи, вероятно в резултат на автоантитела, действащи срещу еритроидни предшественици. 31 Това наблюдение дава обосновка за емпиричното използване на рекомбинантен еритропоетин, когато хемолизата е тежка с лош ретикулоцитен отговор; обаче, парвовирус, хематинов дефицит и инфилтрация в костния мозък също трябва да се имат предвид. Спешна спленектомия или частична емболизация на далака при негодни пациенти се използва остро за лечение на тежка хемолиза.
Автореактивните IgG и IgM могат да бъдат произведени в топъл AIHA; когато са свързани с еритроцитите, и двете са в състояние да свържат C1q и да активират класическия път на комплемента. Инхибиторът на С1 естеразата (C1-INH) е търговски наличен инхибитор на класическия път, лицензиран за наследствен ангиоедем с благоприятен профил на безопасност. C1-INH се използва за подобряване на отговора на трансфузия при пациент с тежък IgM топъл AIHA. 32 Освен това, 4 пациенти с CAD или смесен AIHA и C3d-положителен DAT всички са отговорили на C1-INH BERINERT (20 μg/kg дневно в продължение на 6-20 дни, прилагани с преднизолон, със или без ритуксимаб). 33 Въпреки че данните са оскъдни, C1-INH може да има роля за стабилизиране на тежка хемолиза, ако DAT е положителен за C3d.
Бъдещи перспективи
Бъдещите перспективи за първичен топъл AIHA включват инхибиране на следното:
В клетки с алтернативни анти-CD20 моноклонални антитела (mAbs) (напр. Обинутузумаб)
Цел на рапамицин при бозайници (напр. Сиролимус)
- Автоимунна хемолитична анемия Какво трябва да знаете
- Автоимунна хемолитична анемия при кучета VCA Animal Hospital
- Анемията е прекъсвач на сделката за управление на автоимунни заболявания - Холистичен уелнес център на Каролина
- Анемия - Офис инструкции - ДОКТОР ДНЕС TLC, LLC
- Анемия китайска медицина и липсата на; Кръв