Николас Дурис
1 Катедра по медицина, Медицински център Бет Израел за дяконеса, Медицинско училище в Харвард, Бостън, Масачузетс 02215, САЩ
Бхавна Н. Десай
1 Катедра по медицина, Медицински център за диаконеса на Бет Израел, Харвардско медицинско училище, Бостън, Масачузетс 02215, САЩ
ffolliott M. Fisher
1 Катедра по медицина, Медицински център Бет Израел за дяконеса, Медицинско училище в Харвард, Бостън, Масачузетс 02215, САЩ
Теодор Цису
1 Катедра по медицина, Медицински център Бет Израел за дяконеса, Медицинско училище в Харвард, Бостън, Масачузетс 02215, САЩ
Алън Дж. Фаулър
1 Катедра по медицина, Медицински център за диаконеса на Бет Израел, Медицинско училище в Харвард, Бостън, Масачузетс 02215, САЩ
Елин Заребидаки
2 Катедра по биология и Център за затлъстяване, Държавен университет в Джорджия, Атланта, GA 30302-4010, САЩ
Ngoc Ly T. Nguyen
2 Катедра по биология и Център за затлъстяване, Държавен университет в Джорджия, Атланта, GA 30302-4010, САЩ
Доналд А. Морган
3 Катедра по фармакология, Университет на Айова, Медицински колеж Carver, Iowa City, IA 52242, САЩ
Тимъти Дж. Бартънс
2 Катедра по биология и Център за затлъстяване, Държавен университет в Джорджия, Атланта, GA 30302-4010, САЩ
Камал Рахмуни
3 Катедра по фармакология, Университет на Айова, Медицински колеж Carver, Iowa City, IA 52242, САЩ
Джефри С. Флиър
1 Катедра по медицина, Медицински център Бет Израел за дяконеса, Медицинско училище в Харвард, Бостън, Масачузетс 02215, САЩ
Eleftheria Maratos-Flier
1 Катедра по медицина, Медицински център Бет Израел за дяконеса, Медицинско училище в Харвард, Бостън, Масачузетс 02215, САЩ
Свързани данни
Резюме
Обективен
По-рано показахме, че консумацията на нисковъглехидратна кетогенна диета (KD) от мишки води до ясно изразено физиологично състояние, свързано със загуба на тегло, повишена скорост на метаболизма и подобрена инсулинова чувствителност [1]. Освен това идентифицирахме фибробластен растежен фактор 21 (FGF21) като необходим медиатор на промените, тъй като мишките, които нямат FGF21, хранени с KD, наддават, отколкото отслабват [2]. FGF21 активира симпатиковата нервна система (SNS) [3], която е ключов регулатор на скоростта на метаболизма. По този начин сметнахме, че SNS може да играе роля в медиирането на метаболитната адаптация към кетоза.
Методи
За да проверим тази хипотеза, ние измерихме отговора на мишки, на които липсват и трите β-адренергични рецептора (β-без мишки) на KD хранене.
Резултати
За разлика от контролите от див тип (WT), мишките с бета-бета наддават на тегло, увеличават масата на депата на мастната тъкан и не увеличават енергийните разходи при консумация на KD. Забележително е, че въпреки наддаването на тегло, бета-мишките са били чувствителни към инсулин. KD-индуцираните промени в чернодробната генна експресия на β-по-малко мишки са подобни на тези, наблюдавани в WT контролите, които ядат KD. Експресията на FGF21 mRNA нараства над 60 пъти както при WT, така и при бета-без мишки, хранени с KD, и съответните нива на циркулиращ FGF21 са 12,5 ng/ml при контролирани от KD диви контроли и 35,5 ng/ml при бета-мишки, хранени с KD.
Заключения
Отговорът на β-по-малко мишки отличава поне две отделни категории физиологични ефекти при мишки, консумиращи KD. В черния дроб KD регулира зависимите от пероксизома пролифератор рецептор алфа (PPARα) -зависими пътища чрез действие на FGF21 независимо от SNS и бета-адренергичните рецептори. В остър контраст, индуцирането на интерскапуларна кафява мастна тъкан (BAT) и увеличените енергийни разходи абсолютно изискват SNS сигнали, включващи действие върху един или повече β-адренергични рецептори. По този начин ключовите метаболитни действия на FGF21 в отговор на KD имат различни ефекторни механизми.
1. Въведение
При хората консумацията на KD с високо съдържание на мазнини и ниско съдържание на въглехидрати води до загуба на тегло и подобрява толерантността към глюкозата, без неблагоприятни ефекти върху липидния профил [4]. Преди това при мишки показахме, че храненето с KD води до различно метаболитно състояние, характеризиращо се със загуба на тегло, увеличен разход на енергия, активиране на НДНТ, повишена системна чувствителност към инсулин и отчетлив модел на експресия на чернодробни гени [1]. Впоследствие оценихме дългосрочните ефекти на KD храненето и установихме дългосрочна устойчивост на наддаване на тегло върху тази диета от WT мишки без неблагоприятни ефекти върху заболеваемостта и смъртността [5].
За разлика от хората, чернодробната експресия на FGF21 се увеличава при мишки, консумиращи KD, и е необходим медиатор на физиологичните адаптации към диетата. FGF21 нокаутиращите (KO) мишки печелят, вместо да отслабват по време на диетата [6]. FGF21 също активира НДНТ отчасти, като увеличава SNS устройството [3], [7]. В допълнение, ob/ob мишката, модел с намалено изтичане на SNS [8], също е частично устойчива на пълните ефекти на KD; глюкозният толеранс се подобрява, но не се наблюдава загуба на тегло [6]. Тъй като е известно, че скоростта на метаболизма и термогенната програма за НДНТ се регулират от SNS [9], ние предположихме, че SNS може да играе роля в адаптацията към кетогенните диети.
За да тестваме тази хипотеза, използвахме модел на мишка, в който липсват всички β-адренергични рецептори (бета-мишки) [10] и измерихме отговора на KD. За разлика от загубата на тегло, наблюдавана при нормални WT мишки, β-по-малко мишки, консумиращи KD, имат значително по-различен фенотип, който печелят, вместо да губят тегло. Това покачване на тегло се наблюдава, въпреки че демонстрира типичен модел на кетотична генна експресия в черния дроб. Интересното е, че за разлика от черния дроб, мастната тъкан на β-по-малко мишки не успя да покаже очакваната адаптация към KD. Докато при WT BAT се наблюдава повишено отделяне на протеин 1 (UCP1) протеин, това увеличение не се наблюдава при бета-мишки. Освен това, ние демонстрираме, че повишената експресия на UCP1, наблюдавана при WT мишки, консумиращи KD, е била медиирана чрез повишено SNS задвижване до НДНТ 24 часа след преминаване към KD диета. Този профил на изтичане на SNS отсъства при бета-мишките. Нашите открития потвърждават, че активността на SNS, медиирана чрез β-адренергични рецептори, е необходима за физиологичния отговор и адаптирането към кетогенната диета, което в крайна сметка води до загуба на тегло.
2. Материали и методи
2.1. Поддръжка на мишки и диети
Всички експерименти бяха проведени върху 8- до 16-седмичен мъжки WT (FVB/C57BL6/DBA/2/129SvJ) и бета-мишки (мишки, хомозиготни за разрушаване на β1, β2 и β3 адренорецептори). Тези мишки са били използвани в проучванията за генетична симпатектомия [10] и са били поддържани като отделни колонии: WT колония и β-по-малко колония в Beth Israel Deaconess Medical Center в лабораторията Bradford Lowell от 2002 г. Родителски щамове на β-less мишките имат следните генотипове - β1,2 рецепторен двоен нокаут (Ardb1,2 tm1Bkk FVB/C57BL6/DBA/2/129SvJ) и β3 рецепторен нокаут (Ardb3 tm1Lowl FVB), отглеждани за генериране на тройния рецепторен нокаут.
На мишките беше осигурен свободен достъп до вода и една от двете диети; чау диета и KD. Контролната чау диета имаше състав от 6,5% мазнини, 23,5% протеини и 56% въглехидрати (2,5% захароза), (LabDiet 5008 - Pharmaserv, Framingham, MA). KD имаше състав от 78,9% мазнини, 9,5% протеини и 0,76% въглехидрати (0% захароза) (Bio-Serv F3666, Frenchtown, NJ). Доказано е, че тази формулировка предизвиква кетоза при гризачи [11] и преди това беше използвана от нас за KD изследвания [1].
Мишките бяха държани под 12 h светлина: 12 h тъмен цикъл и околна температура 22 ± 2 ° C. Всички процедури бяха в съответствие с Националните здравни насоки за грижи и употреба на животни и одобрени от Институционалния комитет по грижа и употреба на животните към Медицинския център на Бет Израел за дяконеса (Бостън, Масачузетс) и Университета на Айова (Айова Сити, Айдахо).
2.2. Динамични физиологични тестове
Тест за толерантност към глюкоза: Мишките са гладували в продължение на 16 часа преди интраперитонеално (IP) инжектиране d -глюкоза (2 g/kg телесно тегло; Sigma, Сейнт Луис, МО) е приложено 4 часа след началото на светлинния цикъл и глюкозата е измерено на 0, 10, 20, 30, 60, 90 и 120 минути след инжектирането.
Тест за толерантност към инсулин: На мишки с Ad libitum се инжектира IP с инсулин (0.75 U/kg; Lilly, Indianapolis, IN) 8 часа след началото на светлинния цикъл и глюкозата се измерва при 0, 20, 40, 60, 80, 100, 120 и 140 минути след инжектирането.
Нивата на глюкоза и за двата теста бяха измерени с помощта на OneTouch Ultra глюкометър (Lifescan, Milpitas, CA).
2.3. Непряка калориметрия
Разходът на енергия при мишки се измерва чрез индиректна калориметрия, използвайки цялостната лабораторна система за наблюдение на животните (CLAMS; Columbus Instruments, Columbus, OH). Мишките са били настанявани индивидуално с свободен достъп до храна и вода. Анализът беше извършен при 24 ° C при 12: 12-часов цикъл светлина-тъмнина (светлинен период 0600–1800). Мишките се аклиматизират в метаболитните камери за 48 часа преди събиране на измервания, използвани за анализ на данните.
2.4. Анализ на серума
2.5. Екстракция на РНК и количествена PCR в реално време
РНК се изолира от тъканно замразено в течен азот, използвайки комплект Direct-zol RNA MiniPrep (Zymo Research, Irvine, Калифорния). cDNA е направена от изолирана РНК, като се използват олиго (dt) и произволни хексамерни праймери и обратна транскриптаза (QuantiTech RT Kit; Qiagen, Germantown, MD). Количествената PCR беше извършена, използвайки 7800HT (Applied Biosystems, Foster City, CA) термичен циклер и SYBR Green master mix (Applied Biosystems, Foster City, CA). Относителното изобилие на иРНК беше изчислено и нормализирано до нивата на домакинския ген 36B4. Грундовете са включени в допълнителната таблица 1.
2.6. Записване на активността на симпатиковия нерв (SNA)
SNA към BAT се измерва чрез запис на много влакна. Използвайки дисекционен микроскоп, нервът, подхранващ НДНТ, беше идентифициран и внимателно разчленен безплатно и поставен върху биполярен платинено-иридиев електрод с 36 габарита (A-M Systems, Carlsborg WA). Когато се получи оптимален запис на SNA, електродът се покрива със силиконов гел (Kwik-Sil; World Precision Instruments Inc, Sarasota FL).
Нервните електроди бяха прикрепени към сонда с висок импеданс (HIP-511, Grass Instruments Co., Quincy, MA). Нервният сигнал се усилва 10 5 пъти с предварително усилвател AC Grass P5, филтриран при ниско и високочестотно прекъсване съответно от 100 Hz и 1000 Hz. Усиленият, филтриран нервен сигнал беше насочен към акустична система и към осцилоскоп (модел 54501A, Hewlett-Packard Co., Пало Алто, Калифорния) за слухов и визуален мониторинг на нервната активност и накрая към интегратор на нулиращо напрежение (модел B600C, University of Iowa Bioingineering), който сумира общото изходно напрежение в единици от 1 s преди нулиране. Интеграторът за нулиране на напрежението и усилените, филтрирани неврограми бяха непрекъснато насочени към аналогово-цифров преобразувател на MacLab (модел 8S, AD Instruments Castle Hill, Нов Южен Уелс, Австралия) за постоянен запис и анализ на данните. За да се гарантира, че фоновият електрически шум е изключен при оценката на симпатиковия отток в интегрираното напрежение, SNA е коригирана за фоновата активност след смъртта.
2.7. Анализ на данни
Данните са показани като средно ± стандартна грешка на средното (SEM). Експериментите с времеви ход бяха анализирани за значителни разлики, като се използва двупосочен ANOVA с повтарящи се мерки, последвани от post-hoc теста на Bonferonni за индивидуални сравнения. Едноточковите мерки за четирипосочни проучвания бяха анализирани с помощта на еднопосочен ANOVA, последван от пост-хок тест на Bonferonni за индивидуални сравнения. Едноточковите мерки за двупосочни изследвания бяха анализирани с помощта на двустранен несдвоен T-тест.
3. Резултати
3.1. Дългосрочната консумация на кетогенна диета причинява загуба на тегло при мишки от див тип, но не и при мишки без бета
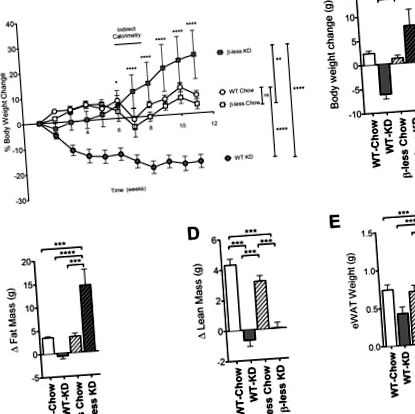
По-рано показахме, че консумацията на KD от WT C57BL/6 мишки води до загуба на тегло [1]. За да се изследва дали непокътнатите β-адренергични рецептори са необходими за индуцирана от KD загуба на тегло, ние хронично хранехме KD с мишки, на които липсват и трите β-адренергични рецептори (β-без мишки). В съответствие с предварително публикуваните ни проучвания, WT мишките, консумиращи KD в продължение на 11 седмици, са загубили 19% от първоначалното си телесно тегло (6 g). За разлика от това установихме, че β-по-малко мишки, консумиращи KD в продължение на 11 седмици, значително наддават на тегло, вместо да губят тегло по време на диетата. До 11 седмици се наблюдава 23% наддаване на тегло от 7 g (Фигура 1 A, B). WT и β-по-малко мишки на контролна чау диета спечелиха скромни 1,4 g през този интервал.
бета-мишки не са в състояние да отслабнат при консумацията на кетогенна диета. бета-без мишки, хранени с кетогенна диета, наддават на тегло в сравнение с контроли, хранени с чау (P Фигура 1 С). Чистата маса беше увеличена в кохортите, хранени с чау, но не и в кохортите, хранени с KD (Фигура 1 D). Увеличението на затлъстяването отчасти се дължи на увеличаване на теглото на депидните мазнини в бялата мастна тъкан (Фигура 1 Д).
3.2. Бета-без мишки не са в състояние да увеличат енергийните разходи, когато консумират кетогенна диета
При WT мишки консумацията на KD води до увеличени енергийни разходи, както се оценява от увеличената консумация на VO2. За разлика от това, β-по-малко мишки не показват увеличение на консумацията на VO2 (Фигура 2 A, B). Както WT, така и бета-мишки, консумиращи KD, са имали постоянно ниско съотношение на дихателния обмен (RER) между 0,70 и 0,75, демонстрирайки загуба в дневната си ритмичност, предполагаща използването на мазнини като гориво както за хранене, така и за гладно C, D). Тези промени не зависят от приема на калории (Фигура 2 Д).
Загубата на тегло, предизвикана от кетогенна диета, се дължи на увеличаване на енергийните разходи. Мишки от див тип, хранени с KD за 11 седмици, имат по-висока скорост на метаболизъм на VO2 (A) в сравнение с аналози, хранени с чау (P Фигура 3 A), въпреки че ефектът е по-забележим при WT мишки. KD също подобрява инсулиновата чувствителност при групи с WT и β-по-малко, както се оценява чрез тест за толерантност към инсулин. Въпреки липсата на загуба на тегло по време на консумация на KD, бета-без мишки, хранени с KD, са чувствителни към инсулин с 20% намаляване на нивата на базалната циркулираща глюкоза (Фигура 3 B). Както беше показано по-рано [1], WT мишките, хранени с KD, също са забележително чувствителни към инсулин с намаляване до 22% от базалните нива (Фигура 3 Б). Инсулиновата чувствителност се наблюдава като последица от диетата и не зависи от генотипа.
Кетогенното диетично хранене подобрява инсулиновата чувствителност, независимо от SNS. Мишки от див тип, хранени с KD, имат по-ниска глюкоза на гладно (A) и както WT, така и β-по-малко мишки, консумиращи KD, остават чувствителни към инсулин (P Фигура 4 A, B). Средноверижните дълговерижни и много дълговерижни ацил-коензим А дехидрогеназа (MCAD, LCAD, VLCAD) и 3-хидроксиацил-коензим А дехидрогеназа (Hadh) бяха повишени 2-3 пъти при хранене на WT или β-без мишки (Фигура 4 C – E).
Формиране на кетонно тяло: Гените, участващи в формирането на кетонното тяло, бяха увеличени при хранене с KD и отново, това се наблюдава като функция от диетата, а не от генотипа. Генът, кодиращ митохондриалния ензим, който катализира първата реакция на кетогенезата, 3-хидрокси-3-метилглутарил-коА синтаза 2 (Hmgcs2) също се увеличава както при KD, захранван с WT, така и при KD, който не се храни с β-по-малко, както е 3-хидроксибутират дехидрогеназата (Bdh1 ), който кодира протеин, който катализира взаимопревръщането на ацетоацетат и β-хидроксибутират (Фигура 4 H – J).
PPARα целеви гени: PPARα целевите гени UCP2 и CD36 също са регулирани нагоре чрез KD хранене (UCP2; 2-3 пъти, CD36; 7-8 пъти), докато няма допълнителен ефект от генотипа (Фигура 4 K, L).
3.5. Мишки от див тип на кетогенна диета увеличават енергийните разходи, независимо от потъмняване в подкожната ингвинална бяла мастна тъкан
По-рано е установено, че изложени на студено изложени β-3-адренорецепторни мишки имат бели адипоцити, които не експресират UCP1 и имат намалени термогенни маркери като PGC-1a, CIDEA и C/EBPβ [12]. За разлика от това наблюдаваме покафеняване на ингвинална бяла мастна тъкан (IWAT) при β-без мишки, хранени с KD, което предполага, че ефектът на KD върху този процес е независим от β-адренергичните рецептори. И WT мишки, и β-без мишки на KD показват увеличение на някои термогенни маркери като UCP1, Cox 7a1, C/EBPβ и CPT1b (Фигура 5 A, B, E, F) в ингвиналната бяла мастна тъкан (IWAT ). Въпреки това, β-по-малко мишки имат притъпени нива на Cox8b и CIDEA (Фигура 5 С, D) в сравнение с WT мишки и KD не индуцира експресията на тези гени.
- Бета-адренергичните рецептори са критични за загуба на тегло, но не и за други метаболитни адаптации към
- Най-добрите хапчета за отслабване Критичен преглед
- Авокадо и други висококалорични храни, които могат да помогнат при отслабване - Insider
- 10 метаболитни хода до презареждане на загуба на тегло
- 5 предимства на липосукцията, различни от отслабването Premier Liposuction