От Катедрата по физиология и фармакология, Медицински колеж на Университета в Толедо, Охайо (T.D.H.)
Кореспонденция на Дейвид Е. Стек, Катедра по физиология и биофизика, Медицински център на Университета в Мисисипи, ул. „2500 N State“, Джаксън, MS 39216. Имейл
Катедра по физиология и биофизика, Център за изследване на затлъстяването в Мисисипи, Медицински център на Университета в Мисисипи, Джаксън (D.E.S.).
Високите нива на неконюгиран билирубин в кръвта (UCB) са най-широко известни като причинител на жълтеница, пожълтяване на кожата и очите. Неонаталната жълтеница е описана в медицинската литература от края на 18-ти век и представлява състояние, отразяващо много високи нива на UCB в серума на новородени бебета. Тежките случаи на неонатална жълтеница доведоха до индуцирано от билирубин неврологично състояние при новородени, известно като kernicterus, което може да причини мозъчно увреждане. Въпреки ролята си при жълтеница, UCB има няколко благоприятни ефекти върху тялото. 5 Резултатите от многобройни широкомащабни популационни и епидемиологични проучвания корелират защитния ефект на серумните нива на билирубин срещу сърдечно-съдови и метаболитни заболявания. Въпреки това, молекулярният механизъм, чрез който това се случва, не е напълно изяснен. Целта на този преглед е да подчертае и обсъди уникалните сигнални действия на BVR генерирането на билирубин и как те сигнализират за защита срещу сърдечно-съдови и метаболитни заболявания, което може да доведе до нови терапевтични средства.
Билирубин като сигнална молекула
Една от първите съответни биологични функции, приписвани преди това на билирубина, е способността му да действа като антиоксидант. 6,7 Билирубин може директно да изчиства реактивните кислородни видове (ROS), както и да инхибира производството на ROS от NADP (H) оксидази. 8-11 Билирубинът взаимодейства и с други антиоксиданти като витамин Е, за да предпази допълнително от засилено производство на ROS. 12,13 Въпреки че има малко съмнение, че билирубинът е мощен ендогенен антиоксидант, остават въпроси дали антиоксидантните ефекти на билирубина могат адекватно да обяснят всички полезни сърдечно-съдови и метаболитни действия. 14–16
Изследването на структурата на UCB разкри, че той има прилики с други известни активатори на PPARα (активиран от пероксизома-пролифератор рецептор α) като WY 14,643 и фенофибрат. 17 Изследвания на COS-7 клетки без рецептор, които са били временно трансфектирани с PPARα или празен вектор, показват, че дозозависимото увеличение на биливердин или билирубин специфично активира PPARa-зависим репортерен ген. 17 Въпреки това биливердинът бързо се произвежда в билирубин от BVRA (биливердин редуктаза А), 18 което показва, че BVRA генерирането на билирубин медиира транскрипционната активност на PPARα. В подобен анализ, сравняващ същото ниво на WY 14,643, фенофибрат и биливердин, Stec et al 17 установява, че биливердинът увеличава PPARα-зависимия репортерен ген в същата степен като известния активатор, фенофибрат. Обаче 14 643 WY при този репортер са имали значително по-висока активност. Фенофибрат и билирубин имат сърдечно-съдови защитни свойства.
Важно е да се очертае конюгираният билирубин в серума от UCB, тъй като конюгираният билирубин не е профилактика на сърдечно-съдови или метаболитни заболявания и само повишените нива на UCB са свързани със сърдечно-съдовата и метаболитната защита. 19 Освен това е показано, че само UCB активира PPARα. 17 UCB е демонстриран за активен PPARα в диапазона 50 μmol/L, който е във физиологичния диапазон на UCB, докладван при пациенти със синдром на Gilbert. 19,20 UCB може да сигнализира подобно на фенофибрат и други производни на фибриновата киселина. Също така билирубинът има антидиабетни ефекти, които обикновено не се наблюдават при фибратен клас лекарства. Въпреки това е извършено само 1 проучване, показващо това сравнение, и тепърва ще бъде тествано щателно.
Билирубин като селективен PPAR модулатор
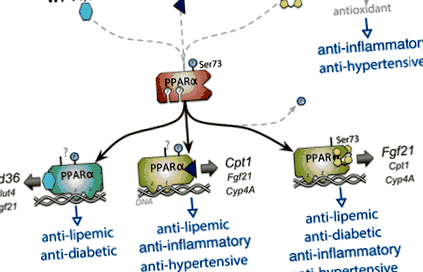
Фигура 1. Билирубин като селективен модулатор на PPARα (активиран от пероксизома пролифератор α) модулатор (SPPARM). Билирубинът се свързва с лиганд-свързващия джоб на PPARα, подобно на други известни активатори WY-14,643 и фенофибрат. Също така билирубинът също е мощен антиоксидант. Доказано е, че билирубин намалява фосфорилирането на серин 73 (Ser73), за да увеличи транскрипционната активност на PPARα. 34,36 Домените за свързване на ДНК на цинковия пръст (Z) на PPARα се свързват с промотори на целеви гени. Билирубин стимулира промотора на няколко целеви гена PPARα, включително фибробластен растежен фактор 21 (Fgf21), карнитин палмитоилтрансфераза I (Cpt1) и цитохром P450 4A (Cyp4A). WY 14,643 е по-силен при индуциране на клъстера на диференциация 36 (Cd36) и в по-ниска степен глюкозен транспортер 4 (Glut4) и Fgf21 промоутъри. Основната цел на фенофибрата е Cpt1. Тези гени играят специфична роля в антидиабетното, антилипемичното, противовъзпалителното и антихипертензивното действие на всяко съединение.
Сигнализиране за билирубин при метаболитни и сърдечно-съдови заболявания
Билирубинът има голямо разнообразие от сърдечно-съдови действия в много различни органи в тялото (Фигура 2). В сърцето билирубинът увеличава бионаличността на азотен оксид (NO) чрез неговите ефекти, за да намали производството на ROS. 35,37 В съдовата стена билирубинът отслабва образуването на атеросклеротична плака чрез въздействието си върху адхезионните молекули, както и метаболизма на холестерола. 38–42 В бъбреците билирубинът запазва скоростта на гломерулна филтрация и бъбречния кръвоток чрез увеличаване на бионаличността на NO. 43,44 В черния дроб и адипоза билирубинът действа чрез PPARα, за да увеличи изгарянето на мазнините. 17,36 Тези изследвания представят билирубина като влиятелен медиатор при метаболитни и сърдечно-съдови заболявания.
Фигура 2. Сърдечно-съдови и метаболитни действия на билирубина (BR). В сърцето билирубинът понижава реактивните кислородни видове (ROS) и повишава нивата на азотен оксид (NO), за да подобри коронарния кръвен поток (BF). Билирубинът може също да действа чрез PPARα (активиран от пероксизом пролифератор рецептор α), за да подобри метаболизма на мастните киселини (FA) и да осигури кардиопротекция. В кръвоносните съдове билирубинът отслабва отлагането на холестерола и инфилтрацията на имунните клетки, за да намали образуването на плака. В черния дроб билирубинът и BVRA (биливердин редуктаза А) фосфорилират AKT, който инхибира GSK3β (гликоген синтаза киназа 3β), запазвайки функцията PPARα за увеличаване на растежния фактор на фибробластите 21 (Fgf21) и карнитин палмитоилтрансфераза I (Cpt1) за изгаряне на мазнини и защита срещу чернодробна стеатоза. В адипоцитите производството на BVRA на билирубин активира PPARα, за да намали размера на липидите. В бъбреците билирубинът подобрява скоростта на гломерулна филтрация (GFR), бъбречната BF (RBF) и нивата на азотен оксид синтаза (NOS), като същевременно инхибира нивата на ROS.
Няколко широкомащабни популационни проучвания показват, че степента на наднормено тегло и затлъстяване са в отрицателна корелация със серумните нива на UCB както при мъжете, така и при жените. 45–48 Известно е също, че нивата на серумен билирубин намаляват със стареенето, което съответства на увеличаване на телесното тегло и риска от сърдечно-съдови заболявания, особено при жените. 49,50 Интересното е, че по-високите серумни нива на UCB също са свързани с по-младежки вид при жените, но не и при мъжете. Съобщава се също така, че краткосрочната загуба на тегло по време на приложение на сибутрамин в комбинация с диета и упражнения повишава нивата на билирубина пропорционално на промяната на теглото, като ефектът е по-голям при мъжете, отколкото при жените. 52 В допълнение, умерената хипербилирубинемия, свързана с полиморфизма на Гилбърт, е свързана с по-нисък индекс на телесна маса, обиколка на тазобедрената става, мастна маса и липиден профил в сравнение със здрави контроли и пациенти с диабет тип II. 53 Тези данни предполагат, че плазмените нива на UCB могат да окажат влияние върху телесното тегло и че самата загуба на тегло може да увеличи серумните нива на билирубин.
Проучванията на Националното изследване на здравето и храненето са установили, че по-високите нива на серумен билирубин предпазват от развитието на инсулт и захарен диабет. 54,55 Подобни резултати са получени и при проучвания с по-малка популация. 56,57 Полиморфизмът на Гилбърт (UGT1A1 * 28) съобщава за защита срещу коронарна артериална болест в проучването на Framingham Heart. 58 Един от механизмите за кардиопротекция, предоставен на индивидите на Гилбърт, е, че високите нива на билирубин намаляват производството на ROS. 19,59 Последни проучвания също показват, че индивидите на Gilbert имат промени в метаболитните пътища като AMPK (AMPK-активирана протеин киназа), подобни на тези, наблюдавани при хуманизирани мишки UGT1A1 * 28. 20,36
Има няколко проучвания, които изследват ролята на билирубина в хипертонията. Проучвания върху хипербилирубинемичен плъх Gunn демонстрират защитна роля в дезоксикортикостерон ацетат (DOCA) -сол и ангиотензин-II-зависима хипертония. 60,61 Въпреки това, серумните нива на билирубин при плъховете на Gunn са изключително високи (≈30 mg/dL или 500 μmol/L) поради пълна загуба на чернодробна активност на UGT1A1 в този щам. За да определим ролята на по-физиологичното увеличение на серумния билирубин, подобно на това, което се наблюдава в патентите на Gilbert, разработихме миши модел на умерена хипербилирубинемия и демонстрирахме, че тези мишки са защитени от ангиотензин-II-зависима хипертония и намален бъбречен кръвоток и гломеруларен скорост на филтриране. 43,44 Ефектът на умерената хипербилирубинемия за понижаване на кръвното налягане при ангиотензин-II-зависима хипертония не се дължи на неговите антиоксидантни действия, което предполага, че други действия на билирубина, като неговата SPPARM активност, могат да бъдат отговорни за действията за понижаване на кръвното налягане при умерена хипербилирубинемия. 14 Необходими са обаче допълнителни проучвания, изследващи способността на билирубина да понижава кръвното налягане при ангиотензин-II-зависима хипертония при липса на PPARα сигнализация.
Популационни проучвания също демонстрират защитна роля на серумните нива на билирубин срещу развитието на захарен диабет и свързани патологии като диабетна нефропатия и ампутации на крайници. 55,57,62–65 Съобщава се също така, че повишаването на серумните нива на билирубин с протеазни инхибитори като атазанавир подобрява съдовата функция при пациенти с диабет и подобрява бъбречната хемодинамика при хипертонични мишки. 43,44,66 Допълнителни проучвания както при индуцирани от диетата затлъстели мишки, така и при db/db мишки показват, че приложението на билирубин подобрява хипергликемията и затлъстяването. 40,67 Въпреки че специфичният ефект на сигнализирането за билирубин не е оценен в тези проучвания, лечението с UCB е свързано с активиране на инсулиновите сигнални пътища и намалява нивата на възпалителни цитокини, както и маркери на ендоплазмен стрес на ретикулума. 67 Тези проучвания подчертават, че билирубинът може да действа за подобряване на инсулиновата чувствителност чрез няколко различни механизма, включително анти-ендоплазмен стрес ретикулум, противовъзпалително, както и чрез действията си като SPPARM (Фигура 1).
Промените в плазмените липиди и нивата на холестерола могат да насърчат сърдечно-съдовите заболявания. Проучвания при лица с полиморфизъм на Gilbert, както и проучвания върху животни при модели на умерена хипербилирубинемия демонстрират ефектите върху липидния профил и нивата на холестерола, които допринасят за защитните действия на UCB. Съобщава се, че хората на Gilbert имат по-нисък серумен холестерол, LDL (липопротеин с ниска плътност) и oxLDL (окислен LDL). 19,59,68,69 Подобни ефекти върху нивата на серумния холестерол и LDL се наблюдават както при хуманизирани мишки на Gilbert, така и при индуцирани от храната затлъстели мишки, лекувани с UCB. 36,40 Степента, до която сигнализирането на билирубина влияе върху тези ефекти върху серумните липиди, не е известна; въпреки това, за PPARα агонисти като фенофибрат отдавна е известно, че намаляват нивата на серумни мастни киселини, LDL и общ холестерол. 70,71
Хиперлипидемията и повишените нива на серумни мастни киселини и LDL са известни рискови фактори за развитието на сърдечно-съдови заболявания. Няколко проучвания при модели на хипертония на гризачи демонстрират защитна роля на PPARα агониста фенофибрат при понижаване на кръвното налягане и защита срещу увреждане на крайните органи. 72–75 Допълнителни проучвания при нечовешки примати демонстрират способността на PPARα агониста да намалява плазмените липиди и да понижава сърдечно-съдовите заболявания. 76 Доказано е, че лечението с фенофибрат има положителни ефекти върху съдовата функция при пациенти със захарен диабет тип II; обаче, понижаващите липидите ефекти на това лекарство не са се превърнали в значителна защита от сърдечно-съдови заболявания при популациите от хора. 77–79 Лечението с билирубин може да предложи по-добър терапевтичен потенциал, за разлика от лечението с PPARα агонист, тъй като има антиоксидантни, антилипемични и противовъзпалителни свойства, които също допринасят за неговата защита срещу сърдечно-съдови заболявания (Фигура 2).
Действия за сигнализация на BVR
BVR е ензимът, отговорен за редукцията на биливердин до билирубин. BVRA е основната изоформа, присъстваща в тъканите на възрастни, докато B изоформата (BVRB) е изозимът, наличен по време на развитието на плода. 1 Неотдавнашни проучвания при BVRA глобални нокаутиращи мишки разкриват почти липса на плазмен билирубин и зелен жлъчен мехур, показателни за много високи нива на биливердин. 84 Освен това, глобалните мишки с дефицит на BVRA показват по-високи плазмени концентрации на хидропероксиди на холестерилов естер, показателни за по-високи нива на ендогенен оксидативен стрес. 84 Въпреки това, ефектът от глобалната загуба на BVRA върху метаболизма не е проучен.
Специфичната за хепатоцитите загуба на BVRA води до изразена стеатоза, намалена в съхранението на гликоген и промени в чувствителността на черния инсулин. 34 Освен това загубата на хепатоцитен BVRA води до повишена активност на GSK3β чрез намаляване на фосфорилирането на Ser9, което е инхибиторно. 85 BVRA регулира чернодробната активност на GSK3β, въпреки че Akt1-медиираното увеличаване на фосфорилирането на Ser9. 86 Повишаването на активността на GSK3β поради загубата на BVRA-медиирано фосфорилиране на Ser9 доведе до повишен Ser (P) 73 PPARα и намалени целеви гени като Fgf21 и карнитин палмитоилтрансфераза 1А (Cpt1a). 34 По този начин BVRA може да регулира Ser (P) 73 PPARα чрез генерирането на UCB, както и чрез директното си взаимодействие с Akt1, регулиращо фосфорилирането на GSK3β (Фигура 2). Новото регулиране на GSK3β фосфорилиране от BVRA може да бъде важен защитен път при сърдечно увреждане, предизвикано от хипертония, както и при увреждане на бъбречната исхемия и реперфузия, тъй като се съобщава, че активирането на GSK3β играе важна роля при всяка от тези патологии. 1,87–89 Наскоро насочването на CRISPR на BVRA в проксималните тубулни бъбречни клетки показа, че загубата на BVRA причинява значително по-високо липидно натрупване и липотоксичност. 90 Билирубин може да има многобройни ползи за бъбреците и бъбречните увреждания.
Заключения
- Нива на билирубин, синдром на Гилбърт и ефекти от диетата на палео кетото
- Нов митохондриален път за сигнализиране, активиран от видимо „близо до инфрачервено лъчение“ - Karu -
- Тест за билирубин Високо срещу
- Купете Obenyl Tablet онлайн за отслабване; Предотвратява диабет; Хипертония - общо здравеопазване
- 01 13 20 вълшебното хапче за отслабване dr oz Дали хапчето причинява загуба на тегло Студентски блог