Катедра по хирургия, Университет Емори, Атланта, Джорджия
Катедра по хирургия, Университет Емори, Атланта, Джорджия
Катедра по хирургия, Университет Емори, Атланта, Джорджия
Катедра по хирургия, Университет Дюк, Дърам, Северна Каролина
Катедра по хирургия, Университет Емори, Атланта, Джорджия
Катедра по хирургия, Университет Емори, Атланта, Джорджия
Катедра по хирургия, Университет Емори, Атланта, Джорджия
Катедра по хирургия, Университет Дюк, Дърам, Северна Каролина
Резюме
Съкращения
Въведение
Отдавна е известно, че активирането на лимфоцитите изисква антиген-зависими и антиген-независими сигнали на клетъчната повърхност. Основите на това знание произтичат от двата сигнални модела на Bretscher и Cohn, и Lafferty и Cunningham, които дават началото на експерименти през 80-те години, определящи антигенната стимулация като сигнал 1 и независимата от антигена костимулация като сигнал 2. В този контекст CD28 е първо и остава най-задълбочено изследвана костимулираща молекула. CD28 е конститутивно експресиран върху наивни Т клетки. Наблюдавано е също на повърхността на плазмените клетки, неутрофилите и еозинофилите, въпреки че функцията му върху тези клетки остава непълно дефинирана. За Т-клетките CD28 костимулацията значително подобрява отговора към антигена. Той стабилизира имунния синапс, намалява броя на ангажиментите с TCR-антиген, необходими за достигане на прага на активиране на клетката, и в съответствие с основните постулати на двусигналния модел, позволява активирането и оцеляването на Т-клетките. Ангажирането на CD28 върху CD4 Т-клетките повишава чувствителността на Т-клетките към антигенни рецептори, значително увеличава производството на цитокини (най-вече IL-2) и насърчава оцеляването на клетките чрез индуциране на експресия на анти-апоптотични протеини, включително Bcl-XL.
Въпреки важността на CD28 за активирането и оцеляването на лимфоцитите, някои Т-клетки с опит с антиген губят CD28 и впоследствие могат да бъдат реактивирани без ангажиране на CD28. Тези CD28 - Т клетки обикновено се характеризират като антиген специфични и крайно диференцирани и често се описват като Т клетки на паметта (TM). Интересното е, че загубата на CD28 върху лимфоцитите изглежда разумно запазена при висши видове бозайници, особено в контекста на апоптоза 1. С напредване на възрастта и увеличаване на антигенния опит, те натрупват CD28 - Т клетки, най-вече в рамките на CD8 подгрупата. Тези клетки имат намалено антигенно рецепторно разнообразие, компрометирана антиген-индуцирана пролиферация и са ограничени от по-кратка репликативна продължителност на живота, въпреки че проявяват засилени цитотоксични и регулаторни функции. Тези характеристики могат да допринесат за имунната некомпетентност при възрастните хора, което се проявява чрез податливост към латентно вирусно реактивиране и компрометирани реакции към нови патогени, ракови клетки и ваксини 2 .
CD28 - Клетъчна имунология
Загуба на CD28 експресия в Т клетки
Загубата на CD28 в CD4 Т клетки е по-слабо характеризирана в сравнение с тази в CD8 Т клетките. CD4 + CD28 - Т клетките са много по-рядко срещани от CD8 + CD28 - Т клетките. Те експресират по-малко CD154 и по този начин са по-малко способни да осигурят помощ на В-клетките 6. Доказано е, че CD4 + CD28 - Т клетките проявяват автореактивност. Тези клетки притежават значителни интерферон-γ (IFNγ) цитоплазмени запаси и експресират CD161, молекула за тъканна инвазия, което предполага, че те обикновено могат да играят противовъзпалителна роля 2. Интересното е, че въпреки че CD4 TEM са предимно CD28 + при хората, съществува значителна популация CD28 - CD4 TEM в NHP. Тази разлика вероятно е допринесла за провала на клиничното изпитване на TeGenero през 2006 г., когато човешки доброволци са имали огромен CD4 TEM-медииран CD28 суперагонистичен ефект, докато NHPs не .
Точният молекулярен механизъм на понижаване на CD28 тепърва предстои да бъде адекватно описан 8. CD28 се регулира от транскрипционен инициатор (Inr), който при прекъсване може да доведе до понижаване на CD28. По-конкретно, доказано е, че тумор-некротизиращият фактор-α (TNF-α) е Inr инхибитор 6. Освен това е показано, че FasL индуцира понижаване на CD28 в клетките Jurkat чрез транскрипционна блокада, като по този начин свързва понижаването на CD28 с апоптотични пътища. По-нататъшното изясняване на механизмите, медииращи понижаването на CD28, ще бъде от особена стойност при разбирането на стимула на загубата на CD28.
Повърхностен фенотип в CD28 - Т клетки
CD28 - Т клетките показват различни профили на повърхностна експресия. В CD8 Т клетките повърхностната експресия на CD57 (наричана още HNK-1, Leu7 или L-2) се увеличава с намаляването на CD28 експресията 9. Загуба на CD28 и повишена експресия на CD57 също са наблюдавани върху CD4 Т клетки в контекста на хронично имунно активиране. Интересното е, че пациентите с CoBRR може да имат по-голяма вероятност да имат CD28 - CD57 + CD4 повърхностен фенотип 10. В сравнение с наивните Т-клетки, ТМ експресират по-високи нива на CD2, CD11a и CD44. По-конкретно, CD8 + TEM с нисък CD28 изразяват особено високи нива на адхезионната молекула CD2. Показано е, че тази CD8 + CD2 hi CD28 - Т клетъчна популация съдържа тестове за алореактивност, съдържащи голям брой клетки с продуциране на полифункционални цитокини (IFNγ, TNF и IL-2) и цитотоксична ефекторна молекула (CD107a и гранзим В) 11 .
Интересното е, че CD8 + CD28 - Т клетките също експресират редица свързани с естествени убийци (NK) рецептори, които включват рецептори за инхибиране на убийци (KIR) и NKG2D 2. Както KIR, така и NKG2D са свързани с TCR-независима цитотоксичност в CD8 + CD28 - Т клетки, което предполага, че CD8 + CD28 - Т клетъчните подмножества могат да допринесат за вродения имунитет. По този начин повърхностният фенотип на CD28 - Т клетките предполага, че те са цитотоксични, алореактивни и могат да допринесат за вродения имунитет.
Клинична значимост на CD28 - Т клетки
CD28 - Т клетки в човешката физиология
Загубата на CD28 е свързана с много физиологични клинични находки при хората. Нормалното стареене е пряко свързано с олигоклоналното натрупване на CD8 + CD28 - Т клетки 2. Това вероятно се дължи на кумулативната експозиция на персистиращи антигени 6, 12. При раждането на практика всички човешки Т клетки експресират CD28. При млади възрастни до 20–30% от техните CD8 Т лимфоцити губят CD28 експресия. При лица на възраст над 80 години над 50–60% от техните CD8 Т клетки губят CD28 експресия 13. Подобни тенденции се наблюдават и при CD4 Т клетките, въпреки че ефектът е по-малко драстичен. Смята се, че често срещаните хронични вирусни инфекции, включително човешки цитомегаловирус (CMV) и Epstein-Barr вирус допринасят за разширяването на CD8 + CD28 - Т-клетките 2 .
Тъй като CD8 + CD28 - Т клетките са олигоклонални, тяхното натрупване предполага съпътстващо ограничение в обхвата на антигенните специфичности в CD8 Т клетъчното отделение 14. Това води до имунна система, компрометирана от ограниченото антигенно разнообразие. Освен това свързаната с възрастта инволюция на тимуса и свързаната с това намалена продукция в наивни CD28 + Т клетки също могат да допринесат за остарял и отслабен имунен фенотип. Младите възрастни, които са били тимектомизирани през ранното детство за животоспасяваща сърдечна хирургия, показват Т-клетъчен профил, който е силно изкривен към олигоклоналните клетки на паметта 15. Интересното е, че тези пациенти показват високи нива на ТМ с експресия на CD57, фенотип, който е силно свързан с имунното стареене и загубата на CD28. И накрая, разширяването на CD8 + CD28 - Т-клетките в напреднала възраст е свързано с изкривяване към Th1 цитокините, което води до недостатъчен отговор на антитела към ваксинация срещу грип 16. Взети заедно, натрупването на антигенен опит с течение на времето, заедно с инволюцията на тимуса, свързана с възрастта, допринася за натрупването на CD28 - Т клетки, което е свързано с имунокомпрометирания профил на възрастните хора, както се илюстрира от недостатъчния имунен отговор към нови патогени, туморни клетки и ваксини.
CD28 - CD8 Т клетки в човешката патология
Много доказателства сочат, че CD8 + CD28 - Т клетките играят важна роля в човешката патология. Повишените CD8 + CD28 - Т клетки са свързани с хронични вирусни инфекции, включително ХИВ, хепатит С вирус и човешки парвовирус В19 2. Загубата на CD28 може също да служи като прогностичен индикатор за вирусни инфекции. По-високите популации на CD8 + CD28 - Т-клетки в ранен стадий на ХИВ инфекция са свързани с по-бърза прогресия към СПИН. Освен това, по-високите честоти на CD8 + CD28 - Т клетки при заразени с HIV жени са свързани със субклинично заболяване на каротидната артерия 2 .
Подобен хетерогенен CD8 + CD28 - Т-клетъчен фенотип се наблюдава при автоимунни заболявания. Загубата на CD28 е свързана с множествена склероза, диабет тип 1, болест на Грейвс, анкилозиращ спондилит и ревматоиден артрит 2. Има доказателства, че има повишена честота на CD8 + CD28 - Т клетки при пациенти с болест на Грейвс и анкилозиращ спондилит и че тези клетки придават цитотоксичност и допринасят за автоимунния отговор 20, 21. При пациенти с ревматоиден артрит клиничният отговор на абатацепт е свързан със съпътстващо намаляване на CD8 + CD28 - Т клетките, което допълнително внушава тези клетки като участници в автоимунитета. Въпреки това беше установено, че системните пациенти с лупус еритематозус имат намалени CD8 + CD28 - Т клетки, което предполага потенциална имунорегулаторна функция за тези клетки 22. Важно е да се отбележи, че регулаторните CD8 + CD28 - Т клетки са показани с възприети трансферни модели, за да играят незаменима роля за предотвратяване на автоимунен енцефаломиелит при мишки 23. Следователно CD8 + CD28 - Т клетките могат да играят цитотоксична или имунорегулаторна роля при автоимунни заболявания.
CD4 + CD28 - Т клетки в човешката патология
Подобно на CD8 Т клетките, CD4 Т клетките също изглежда се свързват с редица човешки заболявания, особено тези, засягащи съдовата система. Повишените CD4 + CD28 - Т клетки са свързани с нестабилни атеросклеротични, остри коронарни събития и исхемичен инсулт 2. Тези клетки също служат като независим предиктор за смъртността при пациенти с хронична сърдечна недостатъчност 24. CD4 + CD28 - Т клетките произвеждат значителни количества IFNγ и перфорин, за който се смята, че насърчава дестебилизацията на атероматозната плака. Механично, KIRs, експресирани върху CD4 + CD28 - Т клетки, са замесени в допринасянето за този провъзпалителен фенотип 25, 26. Интересното е, че пациентите с краен стадий на бъбречно заболяване страдат от изключително висок риск от остри атеросклеротични съдови събития малко след бъбречна трансплантация 27. Традиционните рискови фактори като тютюнопушене, хипертония и хиперхолестеролемия недостатъчно отчитат големината на този риск 28-30. Тези пациенти имат значително разширена CD4 + CD28 - Т-клетъчна популация, която достига до 50% от общата популация на CD4 Т-клетки 26. Може би някои режими на имуносупресия, комбинирани с натрупването на CD4 + CD28 - Т клетки, са отговорни за неблагоприятните сърдечно-съдови резултати, наблюдавани при пациенти с трансплантация.
Трансплантация и CD28 - Т клетки
Роля на CD8 + CD28 - трансплантация на Т клетки
Алогенните трансплантации на твърди органи са свързани с олигоклонално разширяване на CD8 + CD28 - Т клетки 12, 31-33. Доказано е, че тези клетки играят силна имуносупресивна роля в контекста на отхвърляне на алографт. Може да се генерира различна популация от антиген-специфични CD8 + CD28 - Т клетки инвитро чрез многократно стимулиране на човешки мононуклеарни клетки от периферна кръв с алогенни или ксеногенни APC. Получените Т супресори (Ts) осигуряват имуносупресия чрез индуциране на регулиране надолу на костимулиращи молекули (CD80 и CD86) и повишаване на регулацията на инхибиторните рецептори (ILT3 и ILT4) в APC 34-36. Тези Ts са очевидни и клинично. Повишените нива на Ts при възрастни пациенти с чернодробна трансплантация са свързани с по-добра функция на присадката и намалени нива на отхвърляне 31. В допълнение, при пациенти, които не са отхвърлили трансплантация, се наблюдава Ts, които индуцират експресия на ILT3 и намаляват експресията на CD80/86 на APC, докато пациентите с отхвърлена трансплантация имат по-ниски количества Ts в обращение, което не индуцира този толерогенен APC профил 36-39. Тези открития предполагат, че съществува CD8 + CD28 - Ts подмножество, което осигурява имуносупресия и по този начин насърчава толерантността към алографт.
Уместността на тези CD8 + CD28 - Ts клетки се разпростира и върху ефикасността на алемтузумаб като индукционен агент. CD8 Т клетките се възстановяват значително по-бързо от CD4 Т клетките след индукция на алемтузумаб и първоначално се състоят непропорционално от CD8 + CD28 - клетки 40. Показани са тези CD8 + CD28 - Т клетки инвитро за потискане на пролиферацията на CD4 Т клетки, които са свързани с отхвърляне на алографт 41, 42. В действителност в едно проучване, лекуваните с алемтузумаб пациенти с най-ниски нива на CD8 + CD28 - Т клетки са свързани с отхвърляне на бъбречен алографт 40 .
Пречка за индукционната терапия включва наличието на вирусни антигени. Репопулацията на лимфоцитите в присъствието на персистиращ антиген може да доведе до активиране и изчерпване на ангажираните Т-клетъчни клонове и в крайна сметка до засилен неспецифичен алоимунитет 43. Всъщност CMV допринася за стареенето на Т-клетките при пациенти с бъбречна недостатъчност и е свързано с повишен CD28-TM 44. Въпреки тези бариери, наскоро беше демонстрирано, че комбинираната терапия с алемтузумаб и белатацепт може ефективно да поддържа бъбречни алотрансплантати без стероиди или CNI 45. Може би изчерпването на лимфоцитите води до наивно изкривен Т-клетъчен репертоар, който най-добре реагира на белатацепт. Тези данни заедно показват, че загубата на CD28 може да придаде различна чувствителност към индукционни агенти. Няма доказателства, че тези клетки са абсолютно устойчиви на който и да е агент, но умерената диференциална чувствителност изглежда променя репертоарната популация по клинично значим начин.
Роля на CD4 + CD28 - трансплантация на Т клетки
Въпреки индуциращите толерантност качества на CD8 + CD28 - Т клетките, загубата на CD28 в CD4 Т клетките е замесена в насърчаването на имуносупресивна резистентност и отхвърляне на алографт 41, 42. Появата на базирани на блокада на Т клетъчна блокада имуносупресивни терапии при трансплантация на солидни органи предизвика голям интерес към CD28 експресията върху Т клетките. Belatacept, специфичен за B7 фузионен протеин, блокира костимулацията на CD28 – B7 и предотвратява отхвърлянето на бъбречен алотрансплантат с превъзходен профил на страничните ефекти в сравнение с терапии, базирани на CNI (Benefit trial). Въпреки това, той е неефективен при значително малцинство от пациенти. Смята се, че антигенните TM, които проявяват понижаване на CD28, са основните двигатели на отхвърлянето, устойчиво на белатацепт (BRR). Пациентите с BRR са по-склонни да имат CD4 + CD28 - CD57 + повърхностен фенотип, феномен, който не се наблюдава при пациенти, лекувани с традиционни CNI терапии (Espinosa 2014, непубликуван) 46. Освен това е показано, че пролиферацията на CD4 + CD28 - Т клетки, реактивни с бъбречни тубуларни епителни клетки, е устойчива на такролимус и еверолимус, което предполага потенциален CD28 - Т клетъчно-медииран механизъм за отхвърляне на органи при стандартна имуносупресивна терапия 47 .
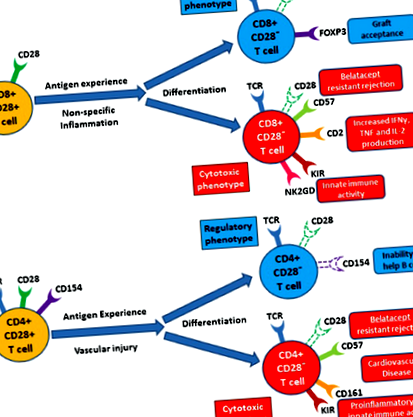
В обобщение, CD8 + CD28 - Т клетките изглежда насърчават имунорегулацията, а CD4 + CD28 - Т клетките придават цитотоксичност в контекста на трансплантацията. Въпреки това, предвид наблюдението на независими имунорегулаторни и имуногенни подгрупи в CD4 и CD8 при злокачествени заболявания и автоимунни състояния, е по-вероятно да съществува подобна парадигма за загуба на CD28 при трансплантация. С други думи, CD4 и CD8 Т клетките се състоят от хетерогенни CD28 - подмножества, които допринасят както за имуносупресията, така и за имунореактивността при трансплантация (Фигура 1). Всъщност беше показано инвитро че специфична CD8 + CD28 - CD2 hi Т клетъчна популация е едновременно силно алореактивна и устойчива на белатацепт 11. Крайният фенотип се определя от това кои подмножества преобладават. Може би след като антиген-специфична клетка се счита за полезна в регулаторен или цитотоксичен контекст, тя може да загуби CD28 и впоследствие да изисква само TCR ангажиране за активиране. Във всеки случай, по-цялостното разбиране на това явление ще бъде от решаващо значение за разработването на по-прецизно настроени имуносупресивни терапии. Съответно, много нови методи за насочване на CD28 в контекста на трансплантацията в момента се изследват 48 .
Заключителни бележки
Въпреки че е изкушаващо да се обобщят функционалните последици от загубата на CD28 в Т клетките, става очевидно, че различните CD28 - Т клетъчни популации проявяват променливи фенотипове в различни човешки условия, включително трансплантация. Хетерогенна смес от имунорегулаторни и цитотоксични CD28 - Т клетки е очертана при пациенти с трансплантация на твърди органи. Двигателите, които в крайна сметка тласкат фенотипа по един или друг начин, остават да бъдат напълно изяснени. Интересното е, че CD28 - Т клетките също показват различна чувствителност към индукционни терапии, което може да промени репертоара на Т клетките по клинично значими начини.
Човек би отказал да предположи, че загубата на CD28 върху Т-клетките не води до активиране на компенсаторни пътища на костимулация. Всъщност множество такива пътища вече са предложени в CD28 - Т клетки 49-51. И накрая, съществува вероятността CD28 - Т клетките да бъдат просто остатъчни клетки от предишни експозиции на антиген, които не предлагат никакви уникални клонотипове и следователно са до голяма степен необходими 14. Във всеки случай постигането на по-висока разделителна способност за разбиране в това взаимодействие на костимулационните и съпътстващите пътища в контекста на загубата на CD28 ще играе огромна роля в терапевтичното развитие на много човешки заболявания.
Разкриване
Авторите на този ръкопис нямат конфликт на интереси за разкриване, както е описано от Американски вестник по трансплантация.
- Клетки Безплатни пълнотекстови механизми на зависима от възрастта загуба на диетични ограничителни защитни ефекти в
- Централно затлъстяване при възрастни хора Какво трябва да бъде приоритетният вестник на American Heart
- Увеличаване на теглото на Charlize Theron’s Monster; Загуби диетичния си план, за да свали 30 килограма
- Предизвикателства при лечението на затлъстяването Въпросът за капацитета за вземане на решения
- Ежедневен хранителен дневник - Хранителен вестник - Проследяване на калории Най-добрият инструмент за отслабване