Анастасия А. Желтова
1 Катедра по фармакология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград, 400131 Русия
2 Катедра по имунология и алергология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград, 400131 Русия
Мария В. Харитонова
1 Катедра по фармакология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград, 400131 Русия
3 Фармацевтичен институт, Катедра по фармакология и токсикология, Университет в Инсбрук, Център по химия и биомедицина, Innrain 80-82/III, A-6020, Инсбрук, Австрия
Игор Н. Йежица
1 Катедра по фармакология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград, 400131 Русия
4 Център за изследване на неврологията (NeuRon), Медицински факултет, Universiti Teknologi MARA (UiTM), кампус Sungai Buloh, болница Jalan, 47000 Sungai Buloh, Selangor Darul Ehsan Малайзия
5 RIG „Молекулярна фармакология и усъвършенствана терапия“, Фармацевтични и науки за живота (PLS) Изследователски общности (CoRe), Universiti Teknologi MARA, 40450 Shah Alam, Selangor Darul Ehsan Малайзия
6 Медицински факултет, кампус Sungai Buloh, болница Jalan, Universiti Teknologi MARA, 47000 Sungai Buloh, Selangor Darul Ehsan Малайзия
Александър А. Спасов
1 Катедра по фармакология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград, 400131 Русия
Резюме
Доказано е, че дефицитът на магнезий (MgD) влияе на множество биологични процеси на клетъчно и молекулярно ниво. В настоящия преглед обсъждаме връзката между MgD и оксидативен стрес (OS). MgD се придружава от повишени нива на OS маркери като липиди, протеини и продукти на ДНК окислително модифициране. Освен това е открита връзка между MgD и отслабена антиоксидантна защита. Различни механизми, свързани с MgD, участват в разработването и поддържането на ОС. Тези механизми включват системни реакции като възпаление и ендотелна дисфункция, както и промени на клетъчно ниво, като митохондриална дисфункция и прекомерно производство на мастни киселини.
1. Въведение
Твърдо е установено, че дефицитите на основни макро- и микроелементи са свързани с развитието на различни заболявания [1-3]. Въпреки това, патологичните последици от недостиг на хранителни вещества често нямат ясна или пряка връзка с функциите на това хранително вещество в тялото. Дефицитът на магнезий (MgD) е отличен пример за този сценарий [4].
MgD може да бъде причинено от многобройни фактори, включително намален прием на Mg с храната, стрес [5], високи нива на консумация на алкохол [6] и наследствени нарушения на бъбречния транспорт на магнезий [7], които са свързани с прекомерна загуба на Mg. В допълнение, ендокринни заболявания (захарен диабет [8], метаболитен синдром [9]) и приложение на някои медицински средства (диуретици, инхибитори на протонната помпа, сърдечни гликозиди, инхибитори на рецептора на епидермалния растежен фактор, инхибитори на калциневрин [10], аминогликозидни антибиотици, амфотерицин В, цисплатин, пентамидин и циклоспорин [11]) също могат да доведат до MgD. Публикувани са няколко рецензионни статии за метаболизма на Mg и свързаните с него нарушения [12, 13].
Предишна литература, особено проучвания, използващи животински модели, предполага корелация между MgD и развитието на оксидативен стрес (OS) [14]. Mg обаче не е признат функционален компонент на антиоксидантната защитна система (AOS).
Следователно, механизмите на ОС, свързани с липсата на Mg, все още са предмет на дебат. Освен това, ролята на Mg в окислителното увреждане на молекули, клетки и тъкани в патогенезата, свързана с MgD, остава неясна. Тук представяме критичен анализ на връзката между OS и MgD и механизъм, обясняващ взаимодействието между тях.
2. Произход и измерване на оксидативния стрес
Sies H. определи OS в организма като „дисбаланс между оксиданти и антиоксиданти в полза на оксидантите, потенциално водещ до увреждане“ [15]. Гореспоменатите оксиданти са „реактивни видове“ (RS) (реактивен кислород (ROS)/азот/хлор) [16]; някои RS са свободни радикали. Много RS играят критична физиологична роля и тяхното производство е от съществено значение за нормалния жизнен цикъл на организма. Свръхпроизводството на RS обаче може да причини окислително увреждане на молекули, клетки и тъкани [17], което допринася за развитието на много заболявания [18-20].
3. Оксидативен стрес и дефицит на магнезий
Ранните клинични проучвания предоставят доказателства за въздействието на ОС, свързана с MgD, върху човешката патология. Златният стандарт за проверка на MgD в клинични проучвания е парентералният тест за толерантност към Mg (тест за натоварване с ниска доза Mg) [26, 27]. За съжаление този тест рядко се използва в публикувани проучвания; по този начин липсват надеждни клинични данни, които да предоставят доказателства за връзката между MgD и OS.
Пациентите с диабет показват само повишена концентрация на окислен LDL във връзка с намалено ниво на серумен Mg. Пациенти с нормални серумни нива на Mg не демонстрират това увеличение на окислените LDL концентрации [28]. Доказано е, че ниският хранителен прием на Mg е придружен от лош капацитет за възстановяване на ДНК [29] и повишена геномна нестабилност [30].
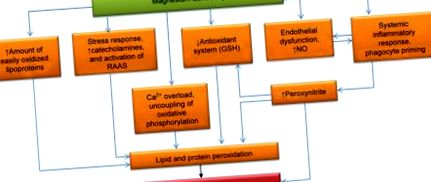
Barbagallo et al. установи силна, пряка корелация между нивата на RBC Mg и концентрацията на GSH/GSSG (циркулиращ редуциран/окислен глутатион) (r = 0,84, P (Фигура 1). 1). Възможно е намаленото съотношение на Mg към Ca да стимулира освобождаването на катехоламин от надбъбречните жлези. Катехоламините обаче увеличават производството на ROS. Това създава порочен цикъл на положителна обратна връзка, където например повишените нива на епинефрин в кръвта водят до допълнително намаляване на концентрацията на Mg [50]. За разлика от това, MgD води до активиране на системата ренин-ангиотензин, която също индуцира ОС [51].
- Патогенна връзка между дефицита на магнезий и оксидативния стрес.
Възпалението е другата важна причина за ОС, която е резултат от MgD [52]. MgD стимулира производството на протеини с остра фаза (например С-реактивен протеин) [53]. Намаляването на извънклетъчните и вътреклетъчните концентрации на Mg сенсибилизира имунокомпетентните клетки до проинфламаторни стимули. Колективно факторите, които обикновено не предизвикват имунен отговор, водят до окислително натоварване във фагоцитите и активиране на неутрофили в Mg-дефицитни организми. Освен това ниската концентрация на Mg в кръвта директно стимулира фагоцитното попълване и води до окислително натоварване [54], вероятно поради повишаване на вътреклетъчните нива на Са [55]. Прекомерните количества RS, създадени от NADPH оксидаза и миелопероксидаза, навлизат в пространството около неутрофилите и макрофагите [55] и увреждат биомолекулите, особено компонентите на липопротеините и околните клетки [56]. За разлика от това, терапията с Mg запълване насърчава противовъзпалителен отговор и намалени нива на възпалителни маркери при първоначално плъхове с дефицит на Mg [57, 58].
Вътреклетъчното производство на RS може да бъде засилено от нарушена митохондриална функция. MgD улеснява разединяването на окислителното фосфорилиране, което води до загуба на електрони в електронно-транспортната верига [71]. Ниските нива на Mg водят до натрупване на калций в цитозола [72, 73], което допринася за разединяването на окислителното фосфорилиране, както и за стимулирането на други пътища за пероксидация [74-76]. Свръхпроизводството на пероксинитрит, което също е резултат от MgD, допълнително изостря митохондриалната дисфункция [77, 78].
Освен засиленото генериране на ROS и свободните радикали, MgD увеличава и количеството субстрати, които са на разположение за радикално окисляване. MgD насърчава хипертриглицеридемия, при която многобройни, лесно окисляващи се липопротеини навлизат в кръвния поток [79] и активността на липопротеиновата липаза е регулирана надолу [80]. Освен това MgD допринася за инсулиновата резистентност и свръхпроизводството на противоинсулинови хормони (епинефрин и кортизол) [81, 82]. Ключовите фактори, свързани с хиперлипидемията, са: активирането на липолизата в мастната тъкан, прекомерното отделяне на свободни мастни киселини, стимулирането на липогенезата в черния дроб, последвано от хиперпродукцията на богати на триглицериди атерогенни липопротеини и инхибиране на синтеза на HDL [34, 83-85]. В клетъчните мембрани повишеното съотношение на Са към Mg стимулира активността на фосфолипаза А2 [86, 87], която е отговорна за мобилизирането на ненаситени мастни киселини (UFA) от фосфолипидите. Свободните UFA, както и тези, свързани с триглицериди и фосфолипиди, могат лесно да бъдат окислени от ROS, за да образуват липидни хидропероксиди. Тези хидропероксиди могат да се разлагат, образувайки нови радикали, като по този начин инициират разклонени верижни реакции, които водят до самоподдържащ се процес на пероксидация [88, 89].
5. Предложения за клинично приложение
Тъй като Mg се предполага, че е важен играч в патогенезата на болестите [2-13, 90-93] и е свързан с нарушена антиоксидантна регулация [28, 31, 32, 37-40, 45, 48-50], оценка и корекция на нарушен магнезиев статус се препоръчва силно при пациенти с MgD.
6. Заключение
За да обобщим, MgD и OS несъмнено са силно свързани помежду си. Освен това бяха описани няколко добре установени, както и няколко нововъзникващи механизма на OS в организми с дефицит на Mg. Въпреки това много аспекти на причинно-следствената връзка между MgD и OS все още остават фрагментирани. Следователно са необходими допълнителни предклинични и клинични проучвания, за да се изяснят механизмите, свързани с връзката между MgD, OS и асоциирани заболявания.
Благодарности
Благодарим за финансовата подкрепа на Министерството на висшето образование (Малайзия) по проект 600-RMI/RAGS 5/3 (46/2014) и Universiti Teknologi MARA (Малайзия) по проект 600-IRMI/MyRA 5/3/LESTARI (0088/2016).
Съкращения:
| Mg | Магнезий |
| MgD | Дефицит на магнезий |
| операционна система | Оксидативен стрес |
| AOS | Антиоксидантна защитна система |
| RS/ROS | Реактивни видове/реактивни кислородни видове |
| ШЕФ | Биомаркери на изследване на оксидативния стрес |
| GSH/GSSG | Намален/оксидиран глутатион |
| RBC | Червена кръвна клетка |
| настолен компютър | Протеинови карбонили |
| DNPH | 2,4-Динитрофенилхидразин |
| HUVEC | Ендотелни клетки от пъпна вена на човека |
| VLDL | Липопротеин с много ниска плътност |
| LDL | Липопротеин с ниска плътност |
| UFA | Ненаситени мастни киселини |
Бележки под линия
катедра по фармакология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград 400131, Русия
b Катедра по имунология и алергология, Волгоградски държавен медицински университет, Пл. Павших Борцов, 1, Волгоград 400131, Русия
c Институт по фармация, Катедра по фармакология и токсикология, Университет в Инсбрук, Център по химия и биомедицина, Innrain 80-82/III, A-6020, Инсбрук, Австрия
d Център за изследване на неврологията (NeuRon), Медицински факултет, Universiti Teknologi MARA (UiTM), кампус Sungai Buloh, болница Jalan, 47000 Sungai Buloh. Selangor Darul Ehsan, Малайзия
e Universiti Teknologi MARA, RIG „Молекулярна фармакология и усъвършенствана терапия“, Фармацевтични и науки за живота (PLS) Изследователски общности (CoRe), 40450 Shah Alam, Selangor Darul Ehsan, Малайзия
* Автора за кореспонденция. Universiti Teknologi MARA, Медицински факултет, кампус Sungai Buloh, болница Jalan, 47000 Sungai Buloh, Selangor Darul Ehsan, Малайзия
Адреси за електронна поща: [email protected]; [email protected] (И. Н. Йежица).
Авторски приноси
Всички автори са допринесли за концепцията, дизайна и изготвянето на статията и одобряват окончателната версия на изпратения ръкопис. Авторите определят съвместно доцент д-р Игор Иежица като автор, отговорен за вземане на решения по отношение на авторството и реда на авторите. Д-р Игор Йежица също е избран от авторите за съответния автор.
Конфликт на интереси
Авторите не посочват конфликт на интереси.
Отворен достъп Тази статия се разпространява при условията на лиценза за признание на Creative Commons, който позволява всяко използване, разпространение и възпроизвеждане на какъвто и да е носител, при условие че оригиналните автори и източник са кредитирани.
- Дефицит на магнезий Симптоми, признаци и лечение
- Дефицитът на магнезий причинява промяна на личността и пациентите с WLS са изложени на риск - хранене
- Магнезиевите добавки Ползи, недостатъчност, дозировка, ефекти и др
- Ползи за магнезия за здравето, дефицит, източници и рискове
- Възпаление и оксидативен стрес в състояние на затлъстяване и защитните ефекти на галната киселина