Мунехиро Китада
1 Катедра по диабетология и ендокринология, Медицински университет Каназава, Учинада, Ишикава 920-0293, Япония; moc.liamg@2911nasuman (YOO); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
2 Отдел за очаквани молекулярни науки и технологии за храните, Институт за медицински изследвания, Медицински университет Каназава, Учинада, Ишикава 920-0293, Япония
Йошио Огура
1 Катедра по диабетология и ендокринология, Медицински университет Каназава, Учинада, Ишикава 920-0293, Япония; moc.liamg@2911nasuman (YOO); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
Итару Монно
1 Катедра по диабетология и ендокринология, Медицински университет Каназава, Учинада, Ишикава 920-0293, Япония; moc.liamg@2911nasuman (YOO); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
Дайсуке Коя
1 Катедра по диабетология и ендокринология, Медицински университет Каназава, Учинада, Ишикава 920-0293, Япония; moc.liamg@2911nasuman (YOO); pj.ca.dem-awazanak@onnomi (I.M.); pj.ca.dem-awazanak@6150ayok (D.K.)
2 Отдел за очаквани молекулярни науки и технологии за храните, Институт за медицински изследвания, Медицински университет Каназава, Учинада, Ишикава 920-0293, Япония
Резюме
1. Въведение
Разпространението на захарен диабет се увеличава в световен мащаб през последните години. Дългосрочният диабет води до съдови промени и дисфункция. Усложненията на диабета са основните причини за заболеваемост и смъртност при пациенти с диабет. Сред диабетните съдови усложнения диабетната бъбречна болест (DKD) е призната както за водеща причина за краен стадий на бъбречно заболяване (ESRD), така и като независим рисков фактор за сърдечно-съдови заболявания (ССЗ) [1,2]. Препоръчва се многофакторно управление, включително диетична терапия, оптимален гликемичен контрол, контрол на кръвното налягане (АН) с помощта на инхибитори на ренин-ангиотензиновата система (RAS) и контрол на липидите, използвайки статин или фибрат, за потискане на прогресията на DKD [3,4,5, 6]. Наскоро нови антидиабетни средства, включително свързани с инкретин лекарства, като инхибитор на дипептидил пептидаза-4 (DPP-4), агонист на глюкагон-подобен пептид-1 (GLP-1) и котранспортер на натриева глюкоза 2 ( SGLT2) инхибитор, показва рено-защитни ефекти срещу DKD [7,8,9,10,11]. Някои пациенти с особено напреднал DKD обаче бързо преминават към ESRD, въпреки че са получили адекватно многофакторно лечение.
Диетичната терапия е от основно значение както за диабета, така и за DKD, за да се поддържа контрола на глюкозата и да се потисне прогресията на бъбречното увреждане [12]. По отношение на диетичната терапия, особено в напреднал бъбречен стадий, се счита, че диетата с ниско съдържание на протеини (LPD) запазва бъбречната функция при хронично бъбречно заболяване (CKD), включително DKD [13,14,15,16]. Ренопротективният ефект на LPD върху DKD обаче е противоречив, тъй като предишните клинични проучвания не са показали убедителни резултати. Това се дължи на трудностите при спазване на дневния LPD и недостатъчността на клиничните данни по отношение на оптималното количество ограничен прием на протеин [17,18,19,20,21]. Няколко предишни клинични доклада показват, че много-LPD (VLPD) може да осигури по-благоприятен ефект за повторна защита от конвенционалния LPD, при пациенти с не-DKD [22,23]. Няма обаче големи клинични проучвания, които да показват, че VLPD има по-благоприятен ефект върху запазването на бъбречната функция при пациенти с DKD, в сравнение с този на конвенционалния LPD. Освен това действителното представяне на LPD, особено на VLPD, в клинична обстановка има няколко хранителни риска, а не ползи за повторна защита, когато не се извършва подходяща диетична терапия, включително достатъчен енергиен прием.
От друга страна, молекулярните механизми, лежащи в основата на ренопротективния ефект на LPD, особено на VLPD, срещу DKD са демонстрирани от многобройни предишни проучвания върху животни, включително нашето. Детайлните му механизми обаче предстои да бъдат напълно изяснени. Изясняването на механизмите ще доведе до разработването на нова терапевтична опция за DKD като заместителна терапия за VLPD.
В този преглед ние обсъждаме (1) молекулярните механизми на LPD, по-специално VLPD, и неговия ефект срещу напреднало бъбречно увреждане, предизвикано от диабет, въз основа на данни, получени от проучвания върху животни; (2) настоящото разбиране за ренопротективния ефект на LPD срещу прогресията на DKD в клинична обстановка; (3) хранителни проблеми при пациенти с ХБН и тяхната връзка с LPD; (4) очаквани бъдещи перспективи за нова терапия като заместител на VLPD.
2. Молекулярни механизми, чрез които LPD упражнява рено-защита срещу DKD
2.1. Поуки от изследвания върху животни
Защитни ефекти за гломерулите
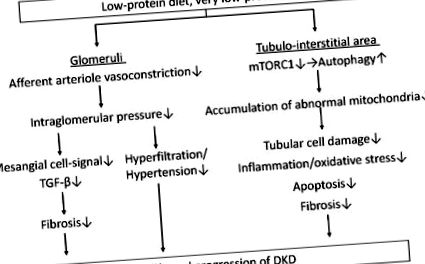
Диетата с ниско съдържание на протеини (LPD) намалява вътрегломерулното налягане чрез намаляване на аферентната вазоконстрикция на артериола, което води до подобряване на гломерулната хиперфилтрация и хипертония и намаляване на фиброзата чрез сигнали за растежен фактор-β (TGF-β) в мезангиалните клетки. В допълнение, LPD, особено много LPD (VLPD), намалява увреждането на тубуларните клетки, възпалението/оксидативния стрес, апоптозата и фиброзата в областта на тубулите-интерстициал чрез намаляване на натрупването на анормални митохондрии, което се предизвиква чрез намаляване на целта на бозайниците на активност на рапамицин комплекс 1 (mTORC1) и възстановяване на автофагията. LPD може да забави прогресирането на диабетно бъбречно заболяване чрез благоприятни ефекти както в гломерулите, така и в тубулната интерстициална област. DKD: диабетно бъбречно заболяване.
3. Защитни ефекти за тубуло-интерстициалната област
Освен това съобщихме, че циклична и периодична VLPD (състояща се от стандартна диета за 3 дни и VLPD за 4 дни в седмицата), а не ежедневна VLPD, може да подобри бъбречните увреждания, причинени от диабет, включително тубулни увреждания, възпаление и тубула -интерстициална фиброза, при мастни плъхове Wistar [40]. Следователно цикличният и периодичен VLPD може да бъде диетичен режим, който е психологически лесен за продължаване и има по-малък риск от недохранване от ежедневния дългосрочен VLPD при пациенти с напреднала диабетна нефропатия. Необходимо е обаче по-нататъшно клинично проучване, за да се изясни ефектът от циклична и интермитентна VLPD като дългосрочно лечение за напреднал DKD.
4. Настоящо разбиране за ефикасността на LPD за рено-защита при пациенти с DKD
В настоящата клинична обстановка ефикасността на LPD за напреднал DKD остава противоречива, тъй като доказателствата от клинични проучвания не могат в достатъчна степен да обяснят рено-защитния ефект на LPD. Клиничните проучвания не показват последователно полезните ефекти на LPD за запазване на бъбречната функция при DKD [17,18,19], докато други проучвания показват, че LPD има благоприятни ефекти при забавяне на прогресивния спад на бъбречната функция [20,21] . В мета-анализ на 13 рандомизирани контролни проучвания (RCT) върху рено-защитния ефект на LPD върху DKD, Nezu et al. показа, че LPD (предписан прием на протеин: 0.6–0.8/kg/ден) подобрява очакваната скорост на гломерулна филтрация (eGFR), в сравнение със стандартната диета (предписан прием на протеин: 1.0–1.6 g/kg/ден), при който пациентите се придържат към диета с ограничен протеин [41]. Следователно трудността с поддържането на придържане към LPD е допринесла за противоречивите резултати от предишни клинични проучвания.
В допълнение към намаляването на натоварването с аминокиселини, намаляването на натоварванията с азот, фосфати и киселини трябва да бъде свързано със забавяне на прогресията на ESRD и започване на диализа чрез намаляване на уремичните симптоми или азотемия [47,48] (Фигура 2). Ето защо, няколко насоки относно диетичната терапия при ХБН, включително DKD, препоръчват ограничен прием на протеини и избягване на излишния прием на протеини (Фигура 2). Сравнение на насоките за диетична терапия за DKD по отношение на приема на диетични протеини е показано в таблица 1. В настоящата клинична обстановка VLPD не се препоръчва като диетична терапия за DKD. Въпреки това, VLPD може допълнително да се разглежда като клинично значимо средство за потискане на спада на бъбречната функция по време на напредналите стадии на DKD, при подходящ енергиен прием или добавка на кетокиселини (KAs) (както е описано по-долу) (Фигура 2).
Ползите от диетата с ниско съдържание на протеини (LPD) при пациенти с хронично бъбречно заболяване (ХБН) включват забавяне на прогресията на спада на бъбречната функция, намаляване на уремичните симптоми и азотемия и намаляване на фосфатните и киселинните натоварвания, което води до удължаване на времето за започване на диализа и евентуално намалена смъртност, особено при сърдечно-съдови заболявания (ССЗ). Рисковете от LPD включват хранителни проблеми, включително загуба на протеин и енергия (PEW), саркопения и нестабилност. Това води до намаляване на качеството на живот (QOL) и повишена смъртност поради увеличеното ССЗ. Следователно, LPD трябва да се предписва на пациенти с ХБН, включително диабетно бъбречно заболяване (DKD), като се има предвид придържането на пациента, възрастта и хранителния статус. Подходящата диетична терапия трябва да се оценява индивидуално (LPD, VLPD с достатъчен енергиен прием и/или допълнена с кетокиселини, или избягване на излишния прием на протеини или ограничено червено месо).
маса 1
Сравнение на насоките за диетична терапия, особено ограничаване на приема на протеини, за диабетно бъбречно заболяване.
| Стандарти за медицинска помощ при диабет – 2018: Обобщение на ревизиите Грижа за диабета. 2018, 41 (Приложение 1) | Микроваскуларни усложнения и грижа за краката | 2018 г. | 0,8 g/kg/ден Избягване: > 20% от калориите,> 1,3 g/kg/ден |
| Насоки за управление на диабета (2016–2017) | Управление при диабетно усложнение | 2016 г. | GFR 2: 0.6–0.8 g/kg/ден (GFR 2: съобразяване с 0,6–0,8 g/kg/ден) Макроалбуминурия: 0,8–1,0 g/kg/ден |
| KDIGO 2012 Насоки за клинична практика за оценка и управление на хронична бъбречна болест | Управление на прогресията и усложненията на ХБН | 2013 | GFR 2: 0,8 g/kg/ден. Риск от прогресия на ХБН: избягване> 1,3 g/kg/ден. |
| Академия по хранене и диететика/Библиотека за анализ на доказателства | Хронично бъбречно заболяване Доказателство за хранене Насоки за практика | 2011 г. | GFR 2: 0,6–0,8 g/kg/ден (ХБН); 0,8–0,9 g/kg/ден (DKD) |
| Грижите за австралийците с насоки за бъбречно увреждане | Диабет тип 2: Бъбречна болест | 2010 г. | Няма препоръка |
| K/DOQI Насоки за клинична практика и препоръки за клинична практика | Диабет и хронична бъбречна болест | 2007 г. | Етап 1–4: 0,8 g/kg/ден |
GFR: скорост на гломерулна филтрация; ХБН: хронично бъбречно заболяване; DKD: диабетно бъбречно заболяване; KDIGO: Бъбречна болест: Подобряване на глобалните резултати; K/DOQI: Инициатива за качество на бъбречните заболявания.
5. Хранителни проблеми при ХБН и връзка с LPD
КА липсват аминогрупата, свързана с а-въглерода на аминокиселина; следователно те могат да се превърнат в съответните им аминокиселини, без да осигуряват допълнителен азот. Предишни доклади показват, че VLPD, осигуряващ 0,3–0,6 g/kg/ден, допълнен с KA аналози на незаменими аминокиселини (EAA), предоставя няколко потенциални предимства за хората с напреднала ХБН [60,61], като същевременно поддържа добро хранене (Фигура 2) . Въпреки това, не е установена подходящата доза на KA/EAA добавка. Освен това клиничните доказателства, базирани на големи RCT, които изследват дали VLDP, допълнен KA/EAA, може да упражнява рено-защитен ефект върху ХБН, включително DKD, са недостатъчни. Необходими са допълнителни големи клинични проучвания за изясняване на тези точки.
6. Важен ли е източникът на протеин, а не количеството протеиново ограничение за защита срещу бъбречно увреждане?
Както е описано по-горе, LPD може да забави прогресията на CKD към ESRD. Въпреки това, ефектите от нивото на прием на протеини в храната и хранителните протеинови източници на храна върху риска от ESRD в общата популация остават неясни. Интересното е, че Lew et al. показа, че сред различните изследвани хранителни източници на протеини приемът на червено месо е силно свързан с повишен риск от ESRD по дозозависим начин [62]. Те проучиха тези източници на храна в Сингапурското китайско здравно проучване, потенциална кохорта, базирана на населението, която набра 63 257 възрастни китайци на възраст 45–74 години. Има 951 случая на ESRD, които са настъпили при средно проследяване от 15,5 години. Не е открита връзка с приема на птици, риба, яйца или млечни продукти, докато соята и бобовите растения изглежда имат леко защитен ефект. Освен това, заместването на една порция червено месо с други източници на протеин значително намалява риска от ESRD. По този начин избягването на приема на червено месо може да покаже повторна защита при пациенти с ХБН (Фигура 2). Необходими са обаче допълнителни проучвания, за да се изследват основните механизми за това как киселинното натоварване или други съединения, включително аминокиселините, присъстващи в червеното месо, могат да влошат прогресията на ХБН.
Триметиламин-N-оксидът (TMAO), чревен микробно-зависим метаболит на диетичния холин, фосфатидилхолин (лецитин) и 1-карнитин, е повишен при ХБН и е свързан с патогенезата на коронарните артерии [63]. Приемът на червено месо може да доведе до повишено производство на уремични токсини от чревната микробиота, като триметиламин n-оксид (TMAO), индоксил сулфат и р-крезил сулфат [64]. Тези уремични токсини са свързани с повишен риск от сърдечно-съдова (CV) смъртност [65].
7. Заключителни бележки и очаквани бъдещи перспективи
Принос на автора
М.К. и Д.К. допринесе за изготвянето на статията. ЙО. и И. М. допринесоха за дискусията. Всички автори са преразгледали ръкописа критично за важно интелектуално съдържание и са одобрили публикуването на окончателната версия. М.К. и Д.К. са отговорни за целостта на произведението като цяло.
Финансиране
Тази работа беше финансово подкрепена от грант за популяризирани изследвания от Медицинския университет в Каназава (S2016-11) за MK, безвъзмездна помощ за предизвикателни изследователски изследвания (16K15472), Фонд за насърчаване на научните изследвания за насърчаване и взаимна корпорация за частни училища в Япония и грант за съвместни изследвания от Медицинския университет в Каназава (C2015-2) за DK.
Конфликт на интереси
Boehringer Ingelheim, Mitsubishi Tanabe Pharma, Kyowa Hakko Kirin, Taisho Toyama Pharmaceutical Co. и Ono Pharmaceutical Co. допринесоха за създаването на отдела за предвиждащи молекулярни научни изследвания и технологии. Мунехиро Китада, Йошио Огура, Итару Монно и Дайсуке Коя заявяват, че няма конфликт на интереси, свързани с този ръкопис.
- Побой на бъбречната болест при растителни диетични вилици над ножовете
- Практически подход към хранителното управление на пациенти с хронични бъбречни заболявания в Кейптаун
- 8 промени в диетата и начина на живот, които могат да помогнат за предотвратяване на бъбречни заболявания - NDTV Храна
- 10 храни, които да добавите към вашата диета за автоимунно заболяване TheThirty
- 4 съвета за контрол на сърдечните заболявания с диета UPMC HealthBeat