От катедрата по устни биологични и медицински науки (A.O.S., S.W., B.N. и D.B.), Факултет по стоматология, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада; и Отделението по ангиология и съдова хирургия (M.L.G.L. и O.E.E.M.), болница „Херманос Амейжейрас“, Ла Хабана, Куба.
От катедрата по устни биологични и медицински науки (A.O.S., S.W., B.N. и D.B.), Стоматологичен факултет, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада; и Отделението по ангиология и съдова хирургия (M.L.G.L. и O.E.E.M.), болница „Херманос Амейжейрас“, Ла Хабана, Куба.
От катедрата по устни биологични и медицински науки (A.O.S., S.W., B.N. и D.B.), Факултет по стоматология, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада; и Отделението по ангиология и съдова хирургия (M.L.G.L. и O.E.E.M.), болница „Херманос Амейжейрас“, Ла Хабана, Куба.
От катедрата по устни биологични и медицински науки (A.O.S., S.W., B.N. и D.B.), Факултет по стоматология, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада; и Отделението по ангиология и съдова хирургия (M.L.G.L. и O.E.E.M.), болница „Херманос Амейжейрас“, Ла Хабана, Куба.
От катедрата по устни биологични и медицински науки (A.O.S., S.W., B.N. и D.B.), Факултет по стоматология, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада; и Отделението по ангиология и съдова хирургия (M.L.G.L. и O.E.E.M.), болница „Херманос Амейжейрас“, Ла Хабана, Куба.
От катедрата по устни биологични и медицински науки (A.O.S., S.W., B.N. и D.B.), Факултет по стоматология, Университет на Британска Колумбия, Ванкувър, Британска Колумбия, Канада; и Отделението по ангиология и съдова хирургия (M.L.G.L. и O.E.E.M.), болница „Херманос Амейжейрас“, Ла Хабана, Куба.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Обективен- Да се определи ролята на многоядрените гигантски клетки (MGC) при сърдечно-съдови заболявания.
Методи и резултати— MGC са отличителен белег на гигантски клетъчен артериит. Те са описани и в атеросклеротични плаки от аортни аневризми и каротидни и коронарни артерии. Тук ние демонстрираме, че съдържащата холат диета на Paigen дава много MGCs в атеросклеротични плаки на аполипопротеинови Е -/- мишки. Тези мишки разкриха 4-кратно увеличение на броя на MGC в сравнение с мишки на диета Western или Paigen без холат. Повечето от MGCs се оцветяват интензивно за катепсин К и са разположени на влакнести капачки и близо до повредени еластични пластини, със свързано медиално изчерпване на гладките мускули. По време на in vitro експерименти MGC демонстрират 6-кратно увеличение на еластолитичната активност в сравнение с макрофагите и улесняват трансмиграцията на гладкомускулните клетки през колаген-еластиновата матрица. Полученият от еластин хексапептид (Val-Gly-Val-Ala-Pro-Gly [VGVAPG]) значително увеличава скоростта на сливане на макрофагите, осигурявайки възможен механизъм за образуване на MGC in vivo. В сравнение с модела на мишка, човешки образци от каротидни артерии и аневризми на аортата съдържат катепсин К-положителни MGC.
Заключение— Аполипопротеиновите E -/- мишки, хранени с диета на Paigen, предоставят модел за анализ на разрушаващата тъканите роля на MGC при съдови заболявания.
Храненето на апоЕ -/- мишки, съдържащи холат HFD, доведе до образуването на катепсин К-експресиращ многоядрени гигантски клетки; тези клетки са локализирани най-вече във влакнести капачки и в близост до повредени еластинови влакна на брахиоцефалните артерии. Този модел може да представлява полезен инструмент за изследване на разрушаващата тъканите роля на гигантските клетки при човешките заболявания.
Наличието на многоядрени гигантски клетки (MGC) в стените на кръвоносните съдове е добре описано при пациенти с гигантски клетъчен артериит (GCA). Името на това заболяване отразява наличието на MGCs, образувани от сливането на макрофаги във възпалителни инфилтрати на артериалната стена. 1,2 При атеросклероза MGCs са описани в плаки от аортни аневризми и каротидни и коронарни артерии. 3 В 1 доклад са наблюдавани 4 CD11c-положителни MGC при напреднали атеросклеротични плаки на аполипопротеин Е (апоЕ) -/- мишки, получаващи „западна“ диета с високо съдържание на мазнини (HFD).
Методи
Подробно описание на методите е дадено в допълнителния материал (достъпен онлайн на http://atvb.ahajournals.org).
Шестседмични апоЕ -/- мишки са преминали от нормална чау диета на 3 вида HFD: (1) западна HFD, която включва 21% мазнини от свинска мас и 0,15% холестерол (n = 12); (2) Paigen HFD, който включва 18% свинска мас, 1% холестерол и 0,5% натриев холат (п = 12); и (3) диета на Paigen без холат (n = 8) (Purina Mills, LLC, St Louis, Mo). След 16 седмици от HFD, мишките бяха евтаназирани след едно нощно гладуване чрез обезкървяване под анестезия (ксилазин-кетамин). Контролните апоЕ -/- мишки (n = 12) на нормална диета бяха евтаназирани на възраст от 22 седмици. За ин витро сливане на макрофаги бяха използвани 3-месечни апоЕ -/- и апоЕ -/- плюс Ctsk -/- мишки. Бяха генерирани апоЕ -/- плюс Ctsk -/- мишки с двоен нокаут, както беше описано по-рано. 5 За изолиране на остеокласти бяха използвани мишки от див тип и Ctsk -/- 2-дневни (n = 6 във всяка група). Всички експерименти са одобрени от регулаторния орган на Университета на Британска Колумбия (Ванкувър).
Извършена е непараметрична ANOVA и данните са представени като средна стойност ± SD. P 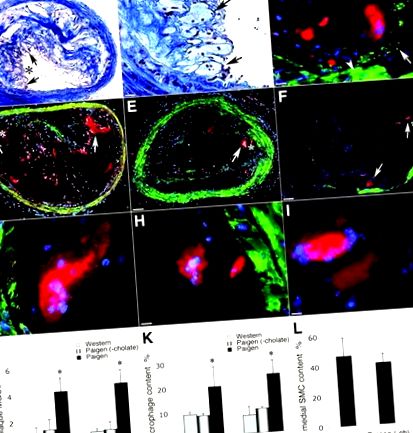
Повечето MGC имат характеристики на MGC на чуждо тяло и не показват оцветяване на Mac-3
Чужди тела MGC (FBMGC) с неравномерно разпределение на ядрата в клетката постоянно присъстват в брахиоцефалната артерия при мишки на диета на Paigen (Фигура 2A-C), докато MGC от тип Langhans, характеризиращи се с подковоподобно периферно разположение на ядрата, са рядко се наблюдава (Фигура 2D-F).
Фигура 2. Наличието на FBMGCs и MGC от тип Langhans в брахиоцефални артериални плаки. A, катепсин К-положителни MGCs не показват оцветяване за макрофаги маркер Mac-3. B – C, увеличени области от A. D, MGC от тип Langhans имат силно имунооцветяване за катепсин K. E, MGC от тип Langhans имат силно имунооцветяване за Mac-3. F, сливане на D и E. В A до F, червеното показва катепсин K; зелено, Mac3; и звездичка, площ, увеличена в B и C. G, MGCs показват силно оцветяване за катепсин K. H, MGCs показват слабо оцветяване за катепсин L. I, MGCs не показват оцветяване за катепсин S. Звездичките в H и I показват MGC. J, Някои MGC образуват клъстери. Звездичката показва увеличената площ от последователни секции в K и L. K и L, Последователни секции, разкриващи присъствието на MGCs в клъстерите (стрелките показват MGCs). В А, скалата показва 130 μm; в B, C, G до I, K и L, 30 μm; в D до F, 20 μm; и в J, 65 μm. * показва увеличена площ в B; * Показва увеличена площ в C.
Двойното имунооцветяване за катепсин К и маркер за макрофаги Mac-3 разкрива, че FBMGCs имат силно оцветяване с катепсин К, но не и оцветяване за Mac-3, докато Mac-3-положителните макрофаги около гигантски клетки имат по-слабо или никакво оцветяване с катепсин К (Фигура 2A-C) . По същия начин MGC от тип Лангханс имат значително по-силно оцветяване за катепсин К в сравнение с околните макрофаги; въпреки това, за разлика от FBMGC, те също имат силно оцветяване за Mac-3, който се колокализира с катепсин К (Фигура 2D-F). За разлика от катепсин К, катепсин S не е открит чрез имунохистохимичен анализ в MGCs; известно присъствие на катепсин L беше разкрито чрез слабо оцветяване (Фигура 2G – I).
При някои напреднали атеросклеротични лезии FBMGCs са наблюдавани в клъстери и са лесно разпознаваеми по големия си размер, неоцветен цитозол и липсата на колагенови влакна между клетките в оцветени с трихром участъци (Фигура 2J). В някои области клетките в такива клъстери изглеждаха като гигантски клетки с едно ядро; анализът на последователните секции обаче разкрива, че те са многоядрени на различни дълбочини на тъканите, предоставяйки доказателства, че такива клъстери наистина са съставени от MGC (Фигура 2К и L).
Серумна концентрация на ендотоксин и IL-4 и плака Toll-like Receptors-4 (TLR4) Имунооцветяващи корелати с наличието на MGCs и еластин прекъсвания
Фигура 3. A, нивата на серумен ендотоксин бяха повишени във всички групи мишки с HFD, като най-високото ниво беше при диета на Paigen. B и C, диетата на Paigen индуцира увеличаването на експресията на плака TLR4 (B) и серумната концентрация на IL-4 (C). D, TLR4-положителни клетки, близки до MGC (червено показва TLR4; звездичка, MGC е показано на E). E, катепсин К-положителен MGC от последователен раздел. F, оцветена от трихром секция с MGC до разкъсвания на влакна от еластин (стрелките показват MGC; и върховете на стрелките, нарушени листове от еластин). G, катепсин К - положителен MGC, прикрепен към нарушен еластинов лист (червеното показва катепсин К; а зелено, Mac3). H, Гигантска клетка до разкъсване на еластин (стрелката показва края на еластиновото влакно; върха на стрелката, SMC мигрира към интимата). I, MGC близо до повредени еластични пластини, с медиална зона без SMC (стрелката показва дезинтегрирано еластиново влакно до гигантска клетка). В E, H и I червеното означава катепсин К; и зелено, SMC а-актин. В D, E и G до I, скалите показват 130 μm; и във F, 30 μm. J, Мишките на диета на Paigen са имали повече еластинови паузи в сравнение с мишки на диета без холат; *P
Полученият от еластин хексапептид (VGVAPG) увеличава сливането на макрофаги, индуцирано от IL-4
Тъй като MGCs често се наблюдават в близост до разрушени листове еластин, ние предполагаме, че продуктите за разграждане на еластин могат да улеснят сливането на макрофагите. За да тестваме тази хипотеза, използвахме наскоро описан метод за генериране на MGC от перитонеални макрофаги, предизвикани от тиогликолат в присъствието на IL-4. Повечето от биологичните дейности на еластин вероятно са свързани с хексапептида VGVAPG, който присъства изобилно в тропоеластин. 20,21 Разнообразните биологични дейности на този пептид се медиират от 67-kDa еластинов рецептор, експресиран от редица клетки, включително макрофаги. 9,20 Използвахме 10 -8 М концентрация на VGVAPG, която по-рано се оказа най-ефективна при индуцирането на миграция и агрегация на макрофаги и сливане на дендритни клетки. 8,9 Добавянето на хексапептид, получен от еластин, предизвиква почти двукратно увеличение на скоростта на сливане на макрофаги (Фигура 4A-C), което води до генерирането на някои гигантски клетки, съдържащи повече от 200 ядра (Фигура 4D).
Фигура 4. A, Макрофаги и гигантски клетки след 1 ден лечение с IL-4. В, макрофаги и гигантски клетки след 1 ден лечение с IL-4 и VGVAPG. C, Количествен анализ на скоростта на синтез (*P
Катепсин К в MGC играе важна роля в разграждането на еластин и улеснява миграцията на SMC чрез слой колаген-еластин
Катепсин К – положителни MGCs в човешки атеросклеротични плаки от аортни аневризми и каротидни артерии
Ние анализирахме тъканни участъци от каротидните артерии на 6 пациенти, 2 (33%) от които съдържаха катепсин К-експресиращи MGCs в техните грануломатозни инфилтрати. Средният брой MGC на секции е (средно ± SD) 2,40 ± 1,14 и 5,00 ± 1,41 (анализирани са 10 секции на проба). Проби от 9 пациенти с аневризми на коремната аорта бяха имунооцветени за катепсин К, разкривайки наличието на MGCs в 1 аорта (11%). Средният брой MGCs в участъци от тази аорта е (средно ± SD) 1,50 ± 0,83. FBMGCs се наблюдават най-вече в интимата (Фигура 5A-C), докато MGC от тип Langhans са за предпочитане разположени във фрагментираните зони между средата и интимата (Фигура 5D-I); тук те обикновено се наблюдават при тези с GCA. 22.
Фигура 5. A, оцветена от трихром секция на каротидна артерия с FBMGCs в интимата. Звездичката показва увеличената площ в B. B, Увеличената зона от A. C, Катепсин К – положителна FBMGC. D, оцветена от трихром секция на каротидна артерия с MGC от тип Langhans в кръстовището между средата и интимата. Звездичката показва увеличената площ в E. E, Увеличената зона от D. F, Катепсин К – позитивен тип Langhans MGC. G, MGC от тип Langhans във фрагментираната зона между медията и интимата. Звездичката показва увеличената област в H. H, Увеличената зона от G. I, Катепсин К – положителна MGC във фрагментираната зона между медията и интимата. Стрелките показват MGC. В A, D и G скалите показват мащаб 260 μm; в В и Н, 65 μm; в Е, 30 μm; в C и F, 20 μm; и в I, 130 μm.
Дискусия
Резултатите от нашите експерименти показват, че диетата на Paigen, съдържаща холева киселина, индуцира значително повече MGCs в атеросклеротични плаки на апоЕ -/- мишки, в сравнение с широко използваната западна или Paigen диета без холат. Присъствието на холат изглежда важно, тъй като премахването му от диетата на Paigen води до 3 пъти по-малък брой MGC. Доказано е, че холатът в атерогенните диети влияе върху експресията на много гени в черния дроб, като 83 гена са индуцирани и 23 гена са потиснати; холестеролът и мазнините повлияват експресията на 38 и 15 гена, съответно. 23 Сред активираните гени цитоскелетните протеини (напр. Виментин и а-актин) и протеази (напр. Катепсини С и В) показват значителна зависимост от наличието на холат в диетата. Повишената експресия на тези протеини може да улесни клетъчното сливане и да увеличи протеолитичната активност.
Многото разкъсвания на еластин при мишки на диета на Paigen отразяват значително разграждане на еластина, което може да генерира допълнителни фактори, стимулиращи образуването на гигантски клетки. Получените от еластин пептиди са свързани с MGC при 2 заболявания: GCA и пръстеновиден еластолитичен гигантски клетъчен гранулом. 9,28 In vitro експерименти показват, че получените от моноцити дендритни клетки, изложени на хексапептид, получен от еластин, VGVAPG, при 10 -8 М образуват гигантски клетки, докато макрофагите при тези условия се агрегират и образуват грануломи. 9 Тези резултати корелират с почти двукратното увеличение на сливането на макрофаги, индуцирано от този хексапептид в нашия експеримент, и предполагат, че разграждането на еластин от MGC може допълнително да подобри тяхното формиране в механизъм за положителна обратна връзка.
В нашето проучване повечето от MGCs са наблюдавани в областта на влакнестата капачка и в кръстовището медия-интима, с тенденция да се натрупват по вътрешните еластични пластини. Наличието на MGCs до еластични счупвания на ламина показва важна роля за тези клетки в разрушаването на стените на кръвоносните съдове. Това се потвърждава от нашата констатация, че нарастването на броя на MGC и еластиновите паузи при мишки на диета на Paigen, в сравнение с мишки на диети без холат, са били добре корелирани (съответно 4.0 и 3.5 пъти).
В заключение показваме, че храненето на апоЕ -/- мишки с съдържаща холат диета на Paigen води до образуване на MGCs в атеросклеротични плаки; това може да бъде полезен модел за човешки патологични състояния, характеризиращи се с наличието на MGCs в кръвоносните съдове. Имунохистохимичните и in vitro експерименти предоставят доказателства, че катепсин К, произведен от такива гигантски клетки, играе значителна роля в разграждането на еластина и миграцията на SMC по време на прогресията на атеросклерозата.
Получава се на: 18 септември 2009 г .; окончателната версия е приета на: 11 февруари 2010 г.
Благодарим на P. Saftig, PhD, Christian-Albrechts-Universität Kiel, Kiel, Германия, за любезното предоставяне на Ctsk -/- мишки.
Източници на финансиране
Това проучване е подкрепено с грант C04-0435 от Канадските институти за здравни изследвания (CIHR) (д-р Brömme); наградата на канадския научен стол; и грант за научни изследвания MOP64447 от Канадските институти за здравни изследвания.
- Диетата с високо съдържание на мазнини, съдържаща холат, предизвиква образуването на многоядрени гигантски клетки в
- Диабетът предизвиква ендотелна дисфункция, но не увеличава образуването на неоинтима при високо съдържание на мазнини
- Ефекти от диета с ниско съдържание на протеини върху клетки, произвеждащи пролактин и растежен хормон в хипофизата на плъхове
- Ефект на упражнения с висока интензивност и диета с високо съдържание на мазнини върху липидния метаболизъм в черния дроб на плъхове
- Dead Cells получава актуализация на Half-Life Alyx; Добавя ново оръжие, кожа и диета TechRaptor
