Резюме
Въведение
Идентифицирането на фактори, които предотвратяват увреждане на лигавицата по време на чревни увреждания, както и фактори, които подобряват възстановяването на червата след увреждане на червата, могат да разкрият нови терапевтични стратегии за поддържане целостта на лигавицата на стомашно-чревния тракт (GI), като по този начин се подобрят резултатите при пациенти с чревно възпаление. Интраколоновото приложение на оцетна киселина (АА) е описано по-рано като модел на експериментален колит [1]. Наскоро разработихме нова система за модели на гризачи, за да изследваме индуцирано от АА увреждане на тънките черва, при което оцетната киселина (0,67 mol/L) се прилага директно в лигирана чревна верига при анестезирани плъхове, което води до хистологично увреждане и промени в чревната пропускливост [2] . Лечението с АА индуцира големи хистопатологични промени в чревната лигавица, включително малки, неправилни и изкривени власинки; увреждане на епитела; оток на ламина проприа; възпалително натрупване на клетки; и кръвоизлив. Този нов модел е използван за изследване на ролята на глутамин (GLN) при индуцирано от АА нараняване на тънките черва, което става все по-актуална тема, тъй като тази форма на увреждане на стомашно-чревния тракт е доста разпространена сред пациентите с болестта на Crohn.
GLN е несъществена аминокиселина, произвеждана главно от мускулите и играе важна роля в много физиологични и биологични процеси. Последните данни сочат, че GLN е важно хранително вещество за бързо делящи се клетки като тези, които се намират в имунната система и червата [3]. Обширни проучвания, включващи различни експериментални модели, установиха, че GLN е основен дихателен субстрат за клетките в лигавицата на тънките черва, като представлява над една трета от общия CO2, произведен в тънките черва [4]. В допълнение, GLN оказва положителен ефект върху свързаната с червата лимфоидна тъкан и засилва чревната бариерна функция.
Предвид трофичните чревни ефекти на GLN, ние предположихме в настоящото проучване, че тази аминокиселина може да предотврати увреждане на чревната лигавица и/или да подобри възстановяването на червата след индуцирано от АА чревно увреждане. GLN може да стимулира обмена на ентероцити чрез директно стимулиране на пролиферацията или клетъчната миграция или чрез инхибиране на апоптозата на ентероцитите. Предишни изследвания показват, че увреждането на червата води до появата на апоптотични и некротични клетки в чревния епител. Освен това, стимулирането на апоптозата е по-силно изразено в епителните клетки в горните части на вилите, в сравнение с недиференцираните пролифериращи клетки в криптите на Либеркюн [5].
Целта на настоящото проучване е да се оцени ефектът от добавките с диетичен GLN върху структурни промени на лигавицата след индуцирано от АА чревно увреждане при модел на плъх и да се оценят механизмите, чрез които глутаминът влияе върху възстановяването на червата, включително неговия ефект върху пролиферацията на ентероцитите и смъртта чрез апоптоза.
Материали и методи
Животни
С мъжки плъхове Sprague – Dawley с тегло 250-350 g се работи в съответствие с насоките на Институционалния комитет за грижи и употреба на животните (Медицински факултет на Rappaport, Technion, Хайфа, Израел). Плъховете бяха настанени индивидуално в клетки от неръждаема стомана и бяха аклиматизирани към стандартните условия на стайна температура (25 ° C) с редуващи се 12-часови цикли светлина-тъмнина и хранени със стандартна чау-чау и вода ad libitum по време на минимален период на стабилизиране от пет дни.
Експериментален дизайн
Плъховете бяха разпределени на случаен принцип в една от четирите експериментални групи: Контролни (CONTR) плъхове бяха подложени на лапаротомия, изолиране на йеюнална верига и интралуминално инжектиране на нормален физиологичен разтвор. Плъховете с контролен глутамин (CONTR-GLN) са третирани с ентерален GLN, даден в питейна вода (2%) 48 часа преди и 5 дни след лапаротомия. Плъховете с контролно-оцетна киселина (C-AA) са подложени на лапаротомия, изолиране на йеюнална верига и интралуминално инжектиране на 2 ml (0,67 mol/L) AA, както е описано по-рано [2]. И накрая, плъховете с оцетна киселина-глутамин (AA-GLN) претърпяха увреждане, причинено от АА (подобно на плъховете C-AA) и бяха третирани с ентерален глутамин 48 часа преди и 5 дни след операцията (подобно на плъхове C-GLN).
Хирургична процедура
Плъховете бяха гладувани преди операцията в продължение на 12 часа. Оперативните процедури бяха извършени със стандартна стерилна техника под обща анестезия с кетамин (интраперитонеално, 90 mg/kg) и ксилазин (интраперитонеално, 10 mg/kg). До корема се стигаше през разрез по средната линия. С плъховете са подложени на лапаротомия, изолиране на йеюнална верига и интралуминално инжектиране на нормален физиологичен разтвор. При АА плъхове, след лапаротомия и изолиране на йеюнална верига, бяха използвани атравматични съдови скоби за запушване на изолираната чревна верига и 2 ml AA (0.67 mol/L) бяха инжектирани в лумена за 10 минути. По време на периода на нараняване разрезът на коремната стена се задържа приблизително, за да се предотврати загубата на течности и топлина. След 10-минутен период на увреждане АА беше евакуирана и чревните запушвания бяха освободени. Червата бяха внимателно подменени в корема и разрезът беше покрит с влажна марля. Плъховете бяха поставени върху нагряващо одеяло по време на процедурата. Впоследствие те бяха реанимирани с 3 ml интраперитонеална инжекция с топъл 0,9% физиологичен разтвор и разрезът беше затворен с полигликолова киселина Dexon S 3–0 (TYCO Healthcare, Mansfield, MA). След това плъховете бяха оставени да се будят със свободен достъп до вода и храна.
В пилотното проучване промените в деня първи, три и пет са изследвани след инжектиране на АА. Тъй като хистопатологичните чревни промени след един и три дни представляват основно остро увреждане, находките от пет дни се считат за представителни за хроничното увреждане, което по-точно прилича на възпалително заболяване на червата при хората. Следователно времето на жертвоприношение беше установено на пет дни след увреждане на червата. Плъховете бяха обезболени отново с интраперитонеален пентобарбитал (75 mg/kg) и бяха умъртвени чрез отворен пневмоторакс. Два чревни сегмента (проксимална йеюнум и дистална илеум; по 10 cm) бяха отстранени и промити със студен физиологичен разтвор, преди да се отчете мокрото тегло. Лигавицата се изстъргва от подлежащата тъкан с предметно стъкло и се претегля. Теглото на червата и лигавицата се изчислява като mg/cm-дължина на червата/100 g-телесно тегло.
Хистологично изследване
Хистологичните секции бяха подготвени от проксималната йеюнум и дисталната част на илеума. Сегментите на тънките черва бяха фиксирани за 24 часа в 4% буфериран формалин, изчистени в ксилол и обработени в стандартни парафинови блокове. Петмикронни парчета тъкан бяха депарафинизирани и оцветени с H&E. Степента на увреждане на чревната тъкан е оценена по степенуваща скала от 0 до 8, както е описано по-рано от Park et al. [6]: 0 - нормална лигавица, 1 - субепителиално пространство на върха на вилуса, 2 - по-разширено субепителиално пространство, 3 - повдигане на епитела по страните на вилите, 4 - оголени вили, 5 - загуба на тъкан на вили, 6 - инфаркт на криптния слой, 7 - трансмукозен инфаркт, 8 - трансмурален инфаркт.
Височината и дълбочината на криптата са измерени в десет вили и крипти, като се използва софтуерът за анализ на изображения Image-Pro Plus 4 (Media Cybernetics, Балтимор, Мериленд, САЩ).
Пролиферация на ентероцити
За да се определи пролиферацията на ентероцити, плъховете се инжектират със стандартен 5-бромодезоксиуридин (5-BrdU) реагент за маркиране (Zymed Laboratories Inc. CA) в доза от 1 ml на 100 g телесно тегло 90 минути преди умъртвяването. Пет микрометров парафинови филийки (5 μm) бяха депарафинизирани с ксилол, рехидратирани със сортиран алкохол и оцветени с биотинилирана моноклонална анти-BrdU система за антитела, използвайки BrdU оцветяващ комплект (Zymed Laboratories Inc. CA). Индексът на пролиферация се определя като съотношението на клетките на криптите, оцветяващи положително BrdU за десет крипти.
Апоптоза на ентероцитите
Апоптотичните клетки бяха идентифицирани с помощта на имунохистохимичен анализ за каспаза-3. Каспаза-3 (CPP32/YAMA) е маркер за ранната апоптотична фаза. Петмикронни парафинови секции бяха обезпарафинирани и рехидратирани с ксилол и сортиран алкохол. Тканевите срезове бяха предварително обработени в микровълнова печка в 10 mM цитратен буфер (рН 6.0). Имунохистохимичният анализ за каспаза-3 беше извършен, използвайки метода на стрептавидин-биотин-пероксидаза съгласно протоколите на производителя. След блокирането на ендогенната активност на биотин, тъканните секции бяха инкубирани с първични антитела (разцепено концентрирано поликлонално антитяло Caspase-3; разреждане 1: 100; Biocare Medical, Walnut Creek, CA) за 1 час при стайна температура, последвано от инкубация с вторични антитела (абсорбирано от човека, биотинилирано, пречистено по афинитет антитяло) за 20 минути. DAB се използва за създаване на интензивно кафяво отлагане около антиген-антитяло-ензимен комплекс в пробата. За всяка група броят на оцветените клетки се отчита в две напречни сечения на червата. Апоптотичният индекс (AI) се дефинира като броят на апоптотичните клетки на десет вили. Контролен комплект от Eurogentec, EGT Group.
Уестърн блотинг
Тъканите се хомогенизират в RIPA лизисен буфер, съдържащ 50 mM Tris-HCl (рН 7,4), 150 mM NaCl, 1% NP-40, 2 mM EDTA, допълнен с коктейл от протеазни и фосфатазни инхибитори. Концентрациите на протеини се определят от реагент на Брадфорд съгласно инструкциите на производителя. Пробите, съдържащи равни количества от общия протеин (30 μg) се разделят чрез SDS-PAGE при редуциращи условия. След електрофореза протеините се прехвърлят в PVDF мембрана и се сондират с различни първични антитела срещу анти-bax антитяло (разреждане 1: 200, sc-493), анти-фосфо-ERK антитяло (разреждане 1: 2500, sc-7383) и анти-β-тубулин (разреждане 1: 5000, Sigma T6557) се използва за нормализиране на протеина. Конюгираното с пероксидаза хрян вторично антитяло е закупено от Jackson ImmunoResearch Laboratories Inc. (West Grove, PA) и подобрен хемилуминесцентен субстрат от Biological Industries (Kibbutz Beth HaEmek, Израел). Оптичната плътност на специфичните протеинови ленти е количествено определена с помощта на денситометър (Vilber Lourmat, Lion, Франция).
Статистически анализ
Данните са изразени като средната стойност ± SEM. Сдвоен студент т-тестът и непараметричният тест на Kruskal-Wallis ANOVA бяха използвани, както е посочено. P
Резултати
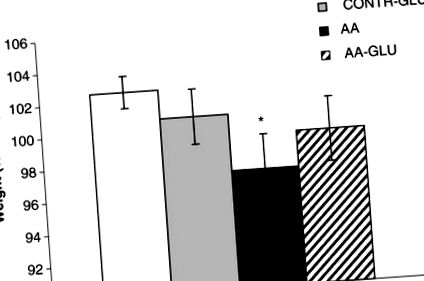
Телесно тегло
Лечението на фалшиви плъхове с ентерален GLN (група CONTR-GLN) не променя значително крайното телесно тегло в сравнение с плъховете CONTR (Фигура 1). АА плъхове демонстрират значително намаляване на крайното телесно тегло (97 ± 2 срещу 103 ± 1% първоначално, p Фигура 1
Резултат от травма на червата
Докато йеюнумът и илеумът на плъховете CONTR и CONTR-GLN показват нормална лигавична архитектура с непокътнати ворсинки, АА животни показват значително хистологично увреждане на увредената йеюнум и по-малко значими промени в илеума (Фигура 2), както и натрупване на възпалителни клетки, оток и кръвоизлив, който се наблюдава главно на мястото на нараняването. AA плъхове (група С) демонстрират значително увеличение на средната степен на увреждане на червата в йеюнума (трикратно, p Фигура 2
Параметри на чревната лигавица
Лечението на контролни животни с ентерален глутамин (група CONTR-GLN) не променя значително теглото на червата и лигавицата в сравнение с контролните животни (група С). 5 дни след увреждане на червата се наблюдава намаляване на дебелината на чревната стена и диаметъра на червата. Плъховете AA са имали значително по-ниско тегло на червата в илеума (44 ± 7 срещу 54 ± 2, p Фигура 3
Микроскопични параметри на лигавицата
AA-плъховете демонстрират значително намаляване на йеюналите (279 ± 52 срещу 421 ± 37 μm, p Фигура 4
Пролиферация на ентероцити и апоптоза
Лечението на контролни плъхове с глутамин (група CONTR-GLN) доведе до леко повишаване на скоростта на клетъчна пролиферация в илеума (165 ± 3 срещу 141 ± 10 BrdU положителни клетки/10 крипти, p Фигура 5
Плъховете CONTR-GLN показват значително увеличение на клетъчната апоптоза в йеюнума (2,4 ± 0,7 срещу 1,1 ± 0,2 положителни клетки на Каспаза-3/10 люспи, p Фигура 6
Уестърн блотинг
Намалените нива на клетъчна пролиферация при АА животни (групи В и С) са придружени от намалени нива на p-ERK протеин. Интересното е, че повишената клетъчна апоптоза е придружена от намалени нива на bax-протеин при АА животни (групи В и С) в сравнение с контролните животни. Лечението с глутамин (група С) не променя значително нивата на p-ERK и Bax протеин в сравнение с нелекувани с АА животни (група В) (Фигура 7).
Дискусия
И накрая, настоящото проучване демонстрира, че оралният GLN отслабва увреждането на чревната лигавица и ускорява възстановяването на червата след индуцирано от АА чревно увреждане при плъхове. Тази полза корелира с увеличаване на пролиферацията на ентероцити и намалена клетъчна апоптоза в чревната лигавица.
Препратки
Ablin J, Shalev O, Okon E, Karmeli F, Rachmilewitz D: Deferiprone, орален хелатор на желязо, подобрява експерименталния колит и стомашни язви при плъхове. Възпаление на червата Dis. 1999, 5: 253-261. 10.1097/00054725-199911000-00003.
Lavy A, Naveh Y, Coleman R, Mokady S, Werman MJ: Диетичният Dunaliella bardawil, богата на бета-каротин водорасли, предпазва от възпаление на тънките черва, предизвикано от оцетна киселина при плъхове. Възпаление на червата Dis. 2003, 9: 372-379. 10.1097/00054725-200311000-00005.
Van der Hulst RR, von Meyenfeldt MF, Soeters PB: Глутамин: основна аминокиселина за червата. Хранене. 1996, 12 (11–12 Допълнение): S78-S81.
Windmuelle HG, Spaeth AE: Поглъщане и метаболизъм на плазмения глутамин от тънките черва. J Biol Chem. 1974, 249: 5070-5079.
Craig M, Coopersmith M, O’Donnell D, Gordon JI: Bcl-2 инхибира индуцирана от исхемия реперфузия апоптоза в чревния епител на трансгенни мишки. Am J Physiol Gastrointest Черен дроб Physiol. 1999, 276: G677-G686.
Park PO, Haglund U, Bulkley GB, Falt K: Последователността на развитие на увреждане на чревната тъкан след странгулационна исхемия и реперфузия. Хирургия. 1990, 107: 574-580.
Podolsky DK: Възпалително заболяване на червата. N Engl J Med. 2002, 347: 417-429. 10.1056/NEJMra020831.
Strober W, Fuss IJ, Blumberg RS: Имунологията на лигавичните модели на възпаление. Annu Rev Immunol. 2002, 20: 495-549. 10.1146/annurev.immunol.20.100301.064816.
Okayasu I, Hatakeyama S, Yamada M, Ohkusa T, Inagaki Y, Nakaya R: Нов метод за индуциране на надежден експериментален остър и хроничен улцерозен колит при мишки. Гастроентерология. 1990, 98: 694-702.
Elson CO, Sartor RB, Tennyson GS, Riddell RH: Експериментални модели на възпалително заболяване на червата. Гастроентерология. 1995, 109: 1344-1367. 10.1016/0016-5085 (95) 90599-5.
Greten FR, Eckmann L, Greten TF, Park JM, Li ZW, Egan LJ, Kagnoff MF, Karin M: IKKbeta свързва възпалението и туморогенезата в миши модел на рак, свързан с колит. Клетка. 2004, 118: 285-296. 10.1016/j.cell.2004.07.013.
Neurath MF, Finotto S: Превод на изследванията на възпалителните заболявания на червата в клинична медицина. Имунитет. 2009, 31: 357-361. 10.1016/j.immuni.2009.08.016.
Rosenstiel P, Sina C, Franke A, Schreiber S: Към карта на молекулярния риск - скорошен напредък в етиологията на възпалителните заболявания на червата. Semin Immunol. 2009, 21: 334-345. 10.1016/j.smim.2009.10.001.
Melis GC, ter Wengel N, Belens PG, van Leeuwen PA: Глутамин: скорошни разработки в клиничното значение на глутамина. Curr Opin Clin Nutr Metab Care. 2004, 7: 59-70. 10.1097/00075197-200401000-00011.
Chapman MA, Grahn MF, Giamundo P, O'Connell PR, Onwu D, Hutton M, Maudsley J, Norton B, Rogers J, Williams NS: Нова техника за измерване на лигавичния метаболизъм и неговото използване за картографиране на използването на субстрата при здравия човек червата. Br J Surg. 1993, 80: 445-449. 10.1002/bjs.1800800412.
Ikeda S, Zarzaur BL, Johnson CD, Fukatsu K, Kudsk KA: Пълното добавяне на парентерално хранене с глутамин подобрява преживяемостта след исхемия/реперфузия на червата. J Parenter Enteral Nutr. 2002, 26: 169-173. 10.1177/0148607102026003169.
Fukatsu K, Ueno C, Hashiguchi Y, Hara E, Kinoshita M, Mochizuki H, Hiraide H: Вливане на глутамин по време на исхемия, вредно в миши ишемия/реперфузия на червата. J Parenter Enteral Nutr. 2003, 27: 187-192. 10.1177/0148607103027003187.
Wu GH, Wang H, Zhang YW, Wu ZH, Wu ZG: Добавеното с глутамин парентерално хранене предотвратява увреждане на чревната исхемия и реперфузия при плъхове. Свят J Gastroenterol. 2004, 10: 2592-2594.
Wasa M, Soh H, Shimizu Y, Fukuzawa M: Глутаминът стимулира транспорта на аминокиселини по време на исхемия-реперфузия в човешките чревни епителни клетки. J Surg Res. 2005, 123: 75-81. 10.1016/j.jss.2004.07.018.
Higashiguchi T, Hasselgren PO, Wagner K, Fischer JE: Ефект на глутамин върху синтеза на протеини в изолирани чревни епителни клетки. J Parenter Enteral Nutr. 1993, 17: 307-314. 10.1177/0148607193017004307.
Mok E, Hankard R: Добавянето на глутамин при болни деца: полезно ли е? J Nutr Metab. 2011, 2011: 617597-
Sukhotnik I, Helou H, Mogilner J, Lurie M, Bernshteyn A, Coran AG, Shiloni E: Пероралният аргинин подобрява възстановяването на червата след нараняване на исхемия и реперфузия при плъхове. Pediatr Surg Int. 2005, 21: 191-196. 10.1007/s00383-004-1318-0.
Noda T, Ivakiri R, Fujimoto K, Matsuo S, Aw TY: Програмирана клетъчна смърт, предизвикана от IR в чревната лигавица на плъхове. Am J Physiol. 1998, 274: 270-276.
Buttke JM, Sandrtrom PA: Оксидативният стрес като медиатор на апоптозата. Имунол днес. 1994, 15: 7-10. 10.1016/0167-5699 (94) 90018-3.
Braga-Neto MB, Warren CA, Oriá RB, Monteiro MS, Maciel AA, Brito GA, Lima AA, Guerrant RL: Добавянето на аланил-глутамин и глутамин подобрява увреждането на чревния епител, предизвикано от 5-флуороурацил инвитро. Dig Dis Sci. 2008, 53: 2687-2696. 10.1007/s10620-008-0215-0.
Larson SD, Li J, Chung DH, Evers B: Молекулярни механизми, допринасящи за преживяемостта на чревни клетки, медиирана от глутамин. Am J Physiol Gastrointest Черен дроб Physiol. 2007, 293: G1262-G1271. 10.1152/ajpgi.00254.2007.
- Диетичните добавки на Bacillus subtilis повлияха на здравето на червата на отбити свине
- Диетичните добавки с 1 -аргинин или N-карбамилглутамат подобряват чревния растеж и
- Диетичните добавки с куркумин подобряват ефективността на растежа, чревното храносмилане и абсорбцията
- Хранителните добавки с женско биле, намаляват индуцираното от диетата наддаване на тегло, отлагане на липиди и
- Хранителна добавка на мазнини и последиците за хипотезата или качеството на яйчниците и ембрионите