Резюме
Заден план
Има все повече доказателства в подкрепа на полезните ефекти от добавянето на директно хранени микроби (DFM) върху производителността, здравословното състояние и имунния отговор на отбити свине. Следователно целта на това проучване е да изследва хранителните добавки на Bacillus subtilis (DSM 25841) относно ефективността на растежа, диарията, пропускливостта на червата и имунитета на отбити прасета, експериментално заразени с патогенен F-18 Ешерихия коли (Е. coli).
Резултати
F18 Е. coli намалена инфекция (P
Заден план
Диарията след отбиването отчита огромни икономически загуби в свинепроизводството поради смъртност и заболеваемост, загуба на тегло и разходи за лекарства [1, 2]. Ентеротоксигенни Ешерихия коли (Е. coli) инфекцията все още е една от най-важните причини за диария след отбиването при свинете. През последните десетилетия антибиотиците се използват като мощен компонент за предотвратяване на диария след отбиване поради Е. coli инфекция. Използването на антибиотици в фуражите за производствени цели в животновъдната индустрия обаче беше напълно забранено в САЩ и ЕС [3], което увеличава забележително предизвикателствата за поддържане на прасетата здрави, особено в периода след отбиването. По този начин всяка надеждна стратегия, която би могла да повиши устойчивостта към болести и производството на отбити свине, ще донесе значителни ползи за индустрията [4, 5].
Материали и методи
Животни, жилища, експериментален дизайн и диета
Клинични наблюдения и събиране на проби
Откриване на β-хемолитични колиформи
Накратко, фекални проби бяха нанесени върху кръвен агар на Колумбия с 5% овча кръв, за да се идентифицират хемолитични колиформи, които могат да лизират червените кръвни клетки около колонията. Фекални проби също се поставят върху агар на MacConkey, за да се изброят общите колиформи. Хемолитични колонии от кръвен агар бяха субкултивирани върху агар MacConkey, за да се потвърди, че те са бактерии, ферментиращи лактоза и плоски розови колонии. Всички плаки се инкубират при 37 ° С в продължение на 24 часа във въздушен инкубатор. Популациите както на общи колиформи, така и на β-хемолитични колиформи на кръвен агар се оценяват визуално, с оценка от 0 до 8 (0 = няма бактериален растеж, 8 = много тежък бактериален растеж). Изчислено е съотношението на резултатите от β-хемолитични колиформи към общите колиформи. Съмнителни колонии бяха суб-култивирани на нови плочи MacConkey и кръвен агар, за да се провери дали те са β-хемолитични Е. coli чрез използване на троен захарен железен агар и лизин железен агар и да се провери дали те са F-18+ Е. coli с помощта на PCR [21].
Анализ на пропускливостта на червата с камера на Ussing
Процедурите за анализ на пропускливостта на червата следват публикувани по-рано методи [22]. Тъканите бяха монтирани в камера на Усинг (Физиологични инструменти, Сан Диего, Калифорния), след като бяха лишени от надлъжния мускул и отворени по мезентериалната граница. Камерата излага повърхността на тъканта (0,5 cm 2) на 2,5 ml кислород Krebs-манитол (10 mmol/L) и Krebs-глюкоза (10 mmol/L) при 37 ° C, съответно на луминалната и серозната страна. След 30-минутен период на уравновесяване бяха измерени ток и проводимост на късо съединение. Трансцелуларната и парацелуларната пропускливост се определят чрез измерване на потока от хрянова пероксидаза (HRP) и FITC-4000 (FD-4) през йеюналната лигавица, съответно. HRP (0.5 mg) и FD-4 (1 mg) бяха добавени към лигавичната камера и 200 μL проба бяха събрани от серозната камера на всеки 30 минути за 1 h. За да се поддържа постоянен обем в камерите, във всяка точка за вземане на проби се замества еквивалентен обем разтвор на глюкоза Krebs. За откриване на HRP при абсорбция 450 nm е използван субстрат на O-дианизидин пероксидаза. Концентрацията на FD-4 беше измерена чрез флуоресценция при възбуждане от 485 nm и емисия от 538 nm.
Чревна морфология
Фиксираните чревни тъкани се вграждат в парафин, разделят се на 5 μm и се оцветяват с високо съдържание на железен диамин и алцианово синьо. Слайдовете бяха сканирани от системата за цифрова патология NanoZoomer (Hamamatsu Co., Bridgewater, NJ) и всички измервания бяха проведени в съответния софтуер за гледане на слайдове (NDP.view; Hamamatsu Co.) и софтуер за обработка и анализ на изображения (Image J, NIH). Избрани са петнадесет прави и интегрирани вили и свързаните с тях крипти и заобиколена площ, за да се анализират височината на вилите, дълбочината на криптата, броят на бокаловите клетки на вили и площта на напречното сечение на сулфо- и сиаломуцин, както е описано от Deplancke и Gaskins [23] и Almeida и сътр. [19].
Количествена PCR в реално време
Статистически анализ
Нормалността на данните беше проверена и бяха идентифицирани извънредни стойности за всички данни, очаквани за пропускливост на червата и честота на диария, използвайки процедурата UNIVARIATE (SAS Inst. Inc., Cary, NC). Въпреки това не бяха открити и премахнати от набора от данни отклонения. За ефективност на растежа, резултат за диария, пропускливост на червата и експресия на гените, данните бяха анализирани от ANOVA, използвайки PROC MIXED of SAS в рандомизиран пълен блок с прасе като експериментална единица. Статистическият модел включва лечението като основен ефект и блокира като случайни ефекти. Средствата за лечение бяха разделени с помощта на оператора LSMEANS и опцията PDIFF на PROC MIXED. Контрастните изявления бяха използвани за тестване на линейни и квадратични ефекти на Bacillus subtilis чрез сравняване с положителната контрола. Тестът хи-квадрат е използван за анализ на честотата на диария. Статистическата значимост и тенденция бяха разгледани при P
Резултати
Ефективност на растежа, резултат от диария, β-хемолитични колиформи
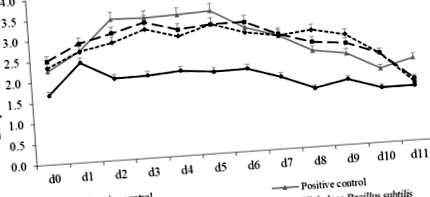
Не се наблюдава разлика в първоначалното тегло на прасетата при диетични лечения (Таблица 2). В сравнение с прасетата с отрицателна контрола, прасетата от групата с положителен контрол са намалили BW на d 5 PI (P Таблица 2 Ефективност на растежа на отбити свине, хранени с диети, допълнени с Bacillus subtilis
В сравнение с отрицателния контрол, F18 Е. coli предизвикателството се увеличи (P Фиг. 1
Не са открити β-хемолитични колиформи в изпражненията на прасета в отрицателната контролна група (фиг. 2). Прасета в положителен контрол, ниска доза и висока доза Bacillus subtilis групата имаше по-висока (P Фиг. 2
Чревна пропускливост и чревна морфология
F18 Е. coli предизвикателството се увеличи (P Фиг. 3
Е. coli предизвикателството също намалено (P Таблица 4 Относителната експресия на иРНК на гени в йеюналната лигавица на отбити свине, хранени с диети, допълнени с Bacillus subtilis
Е. coli предизвикателство нагоре регулирано (P Таблица 5 Относителната експресия на иРНК на гени в лигавицата на илеума на отбити свине, хранени с диети, допълнени с Bacillus subtilis
Дискусия
F18 Е. coli-индуцираната диария е честа причина за заболеваемост и смъртност при отбити свине [26]. Резултатите, разкрити в настоящото проучване, показват, че добавянето на Bacillus subtilis подобрен темп на растеж, намалена пропускливост на червата и може да промени здравето на червата на отбити свине, експериментално предизвикани с F18 Е. coli. Тези констатации са в съгласие с предишни публикувани изследвания, показващи подобряване на растежа и здравния статус при прасенца, хранени с различни щамове Bacillus subtilis [27,28,29]. Потенциалните механизми, свързани с тези ползи, могат да включват, но не се ограничават до: 1) добавяне на Bacillus subtilis (DSM 25841) подобряване на интегритета на червата чрез повишаване на функцията на бариерната функция на червата и намаляване на пропускливостта на червата в йеюнума; 2) допълване на Bacillus subtilis регулиран чревен имунитет на отбити свине; 3) включване на Bacillus subtilis модулира чревния микробиом и техните метаболити. Настоящият експеримент беше фокусиран повече върху първия потенциален механизъм.
Като един от многото потенциални кандидати за частично заместване на антибиотиците в храната, Bacillus subtilis са привлекли много внимание, тъй като са термостабилни по време на обработката на фуражите и са в състояние да доставят своите потенциални ползи за тънкото/дебелото черво след оцеляване при ниско рН в стомаха [5]. Отчетените ефекти на Bacillus subtilis относно честотата на диария при отбити свине са непостоянни. Като пример, Bhandari et al. [37] и Hu et al. [15] разкри, че добавянето на Bacillus subtilis намалена диария при отбити свине или в K88 Е. coli предизвикателство проучване или в нормално жилищно състояние, но това не е случаят в изследването, докладвано от Giang et al. [38]. Въпреки че допълването на Bacillus subtilis не намалява честотата на диария при Е. coli предизвикани прасета в настоящото проучване, той подобри скоростта на растеж и ефективността на хранене на отбити свине след Е. coli инфекция. Тези наблюдения ясно показват, че добавянето на Bacillus subtilis насърчава представянето на отбити свине вероятно чрез други механизми. Провежда се последващ експеримент за изследване на връзката между пропускливостта на червата и общия резултат от диария чрез добавяне на повече точки за вземане на проби и удължаване на експерименталния период.
Други потенциални механизми също могат да бъдат свързани с повишения темп на растеж чрез хранене Bacillus subtilis. Като пример, Бацил-базиран на DFM може да подобри ефективността на растежа на отбити свине чрез подобряване на усвояемостта на енергия и хранителни вещества [29, 54]. По-специално, Бацил-базиран на DFM може да увеличи разграждането на фибрите в чревния тракт на свинете [11, 55]. Бацил-базирана на DFM добавка може също да увеличи популацията на полезни микроорганизми в чревния тракт, които се конкурират с хранителните вещества и местата на прикрепване с патогени, следователно, намалявайки разпространението на патогени [56]. Необходими са допълнителни изследвания, за да се изследват изброените тук потенциални начини на действие.
Заключение
- Диетичните добавки с глутамин предотвратяват увреждане на лигавицата и модулират чревния епител
- Диетичните добавки с 1 -аргинин или N-карбамилглутамат подобряват чревния растеж и
- Диетичните добавки с куркумин подобряват ефективността на растежа, чревното храносмилане и абсорбцията
- Диетични аспекти, свързани със здравето и затлъстяването при синдром на Уилямс, синдром на Даун и Прадер – Уили
- Диетичното съединение, свързано със сърдечни заболявания, може да бъде повлияно от чревния микробиом - ScienceDaily