Резюме
Заден план
Използването на хранителни вещества след хранене и метаболизмът на определена диета е сложен процес. Метаболитната характеристика на прасетата след прием на царевично-соево брашно или диети с казеин-нишесте е до голяма степен неизвестна. Следователно, това проучване е проведено, за да се изследват динамичните промени след хранене на плазмения метаболитен профил, като се използват растящи прасета, като се използва метаболомика.
Методи
Двадесет и четири растящи прасета със средно първоначално телесно тегло (BW) около 30 kg бяха поставени в метаболитни клетки и след това оборудвани с какатери за предкавални вени. Прасетата са хранени ежедневно с 4% от първоначалното телесно тегло. Включени са две експериментални диети: (i) пречистена диета на базата на нишесте и казеин (PD) и (ii) обикновена диета от царевично-соево брашно (CD). Плазмата се събира преди хранене и 0,5 h, 1 h, 2 h, 4 h, 8 h след хранене.
Резултати
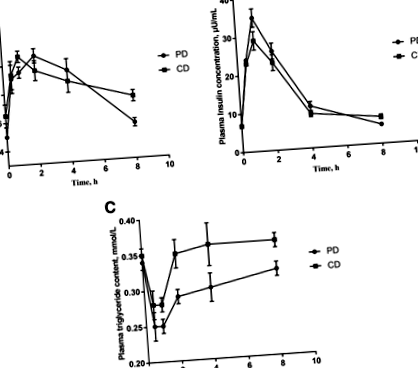
И при двете диети, в сравнение с преди хранене, концентрациите на глюкоза, повечето аминокиселини, метаболити като 5-аминопентанова киселина, пипеколова киселина, орнитин и 5-хидрокси-L-триптофан са значително повишени в плазмата през първия час, докато концентрациите на плазмени триглицериди, глутамат, глицин, палмителаидова киселина, 13-HODE и олеинова киселина са намалени през първия час. В сравнение с PD групата, концентрацията на плазмен левцин и изолевцин намалява след 30 минути в CD групата. Плазмената линолова киселина, сфингозин и много дипептиди са значително по-високи при прасета, хранени с CD.
Заключение
Най-значимите метаболитни промени настъпват през първия час след хранене и след това стават относително стабилни след 2 часа и при двете диети. Тези резултати показват широкообхватна картина на постпрандиалните промени в плазмените метаболити след прием на PD и CD и могат да бъдат ориентир за по-нататъшна интервенция в храненето, както и за проектиране на хранителни изследвания.
Заден план
Царевицата и соята са основните култури в световен мащаб. Царевицата е една от най-важните съставки в храната и фуражите, действайки като основен източник на енергия. Соевото брашно, страничният продукт от соевото масло, се използва широко във фуражите като източник на протеин и съдържа специфични хранителни вещества, включително изофлавон, сапонин и фитостерол [8]. В същото време казеинът и нишестето също се използват като протеин и енергиен източник за различни цели [9]. Диетичните аминокиселини и енергията, доставяни от диети на основата на казеин и царевично нишесте, обикновено се използват като пречистена диета за проверка на реакциите на приема на хранителни вещества [10].
Метаболомът се определя като събиране и глобален анализ на всички метаболити на малки молекули, генерирани в клетка, орган или организъм [11]. Метаболомиката може да помогне за проследяване на взаимодействието между хранителните вещества и метаболизма [12] и да ни даде по-добро разбиране на хранителните вещества, храносмилателната и абсорбиращата кинетика след хранене. Изследването на метаболомиката при мини-прасе показва, че много метаболити показват противоположни тенденции след хранене, което може да бъде компенсаторен механизъм в отговор на притока на хранителни вещества [5].
Следователно, основната цел на настоящото проучване е да се получи широкообхватна картина на промените след хранене на метаболитите след прием на PD и CD при отглеждане на свине, което ще увеличи нашето разбиране за храносмилателната и абсорбиращата кинетика за тези две класически диети и ще осигури основа за избор на времеви петна за вземане на кръв, използвани за различни цели.
Методи
Диета, животни и експериментален дизайн
Хирургия
Всяко прасе е снабдено с катетър в предната куха вена през главичната вена и основната хирургична процедура е описана подробно от Takken et al. [13]. Просто анестезията се предизвиква чрез интрамускулно инжектиране на 5 mg/kg Zoletil 50, след което се пробива кожата на мястото на хирургията (кръстоска на точката на гръдната кост, яремната бразда и цефалните вени) с помощта на куха игла с водещ проводник, след което се изважда иглата поставете катетъра по направляващия проводник. Издърпайте водещия проводник и фиксирайте катетъра с щипка за пеперуди. Катетърът се блокира с разтвор на хепарин и на свинята се прилага интрамускулно инжектиране на антибиотик (Цефазолин) при 50 mg/kg.
Вземане на кръвни проби
Кръвни проби от всяко прасе се събират на d 5 след началото на експерименталния период. Изходните проби бяха събрани 10 минути преди сутрешното хранене и след това кръвните проби бяха събрани 30, 60, 120, 180, 240 и 480 минути след хранене. Пробите се центрофугират (Biofuge22R; Heraeus, Hanau, Германия) при 3000 ×ж в продължение на 10 минути, след това супернатантата се прехвърля в други епруветки и се замразява в течен азот, след което се съхранява при - 80 ° C за метаболомичен анализ.
Химичен анализ
Хранителните проби се смилат, за да преминат през 1-милиметрово сито и се смесват добре за химичен анализ (Таблица 2). Всички химични анализи бяха проведени в два екземпляра. Пробите от съставки и диетата бяха анализирани за сухо вещество (DM) и суров протеин (CP) [14]. Аминокиселинният състав на диетите се определя съгласно процедурите на Асоциацията на официалните аналитични химици (AOAC) (2000). Пробите се хидролизират преди анализ с 6 mol/L HCl за 24 h при 110 ° C и се анализират за 15 AA с автоматичен анализатор на аминокиселини (L-8900 Hitachi Automatic Amino Acid Analyzer, Токио, Япония). След студено окисление с екстрактична киселина за една нощ и хидролиза със 7,5 mol/L HCI за 24 h при 110 ° C, метионинът и цистинът се анализират като метионин сулфон и цистеинова киселина. Триптофанът е определен след LiOH хидролиза за 22 часа при 110 ° C чрез високоефективна течна хроматография (Agilent 1200 Series, Санта Клара, Калифорния, САЩ) [15].
Биохимични анализи
Плазмената концентрация на глюкоза се определя чрез йонообменна хроматография (Agilent 1200). Накратко, пробите бяха избистрени чрез центрофугиране при 12 500 × ж за 10 минути при 4 ° С, след това супернатантите (0.25 mL) се разреждат до 5 mL с вода и се пропускат през хидрофобна филтърна касета преди анализ. Плазмената концентрация на инсулин беше изследвана, използвайки INS ELISA Kit (MSK) от свински инсулин. Триглицеридите, плазменият калций, ALB, HDL, LDL и плазменият азотен карбамид се анализират с помощта на Hitachi 7020 Chemistry Analyzer съгласно Wang et al. [16].
Профилиране на аминокиселини въз основа на LC-MS/MS
Триста μL плазма се пипетира в 2-милилитрова епруветка за центрофугиране, добавят се 12 μL вътрешен стандарт (2,5 mmol/L норлевцин) и се добавят 1,2 mL ледено студен метанол. След завихрянето пробите се центрофугират при 14 000 × ж за 10 минути при 4 ° C (Eppendorf, Хамбург, немски). 500-μL супернатант се изпарява до сухо във вакуумен концентратор (Eppendorf, Hamburg, German). Остатъците бяха ресуспендирани в 100 μL боратен буфер (AccQ-Tag Ultra Derivatization Kit, Waters, САЩ), смесени във вихър и отново центрофугирани при 14 000 × ж за 10 минути при 4 ° С. След това 10-μL аликвотна част от супернатантата се смесва с 50 μL боратен буфер във флакон. След това се добавя 20 μL реагент за дериватизация (AccQ-Tag Ultra Derivatization Kit, Waters, САЩ), разтворен в ацетонитрил. Флаконите се затварят, смесват се във вихър и се загряват до 55 ° С в продължение на 10 минути. След охлаждане до стайна температура, разтворите се прехвърлят във флакони с проби за LC-MS/MS анализ. Стандартните разтвори бяха получени по същия начин. LC-MS/MS е извършена съгласно предишно проучване [17, 18].
Измерване на метаболомиката въз основа на UPLC-MS
Плазмени проби от 12 прасета от всяка обработка бяха извлечени, използвайки 800 μL ледено студена екстракционна смес (ацетонитрил: метанол, 1: 1, об: об) при проба 1: 4: съотношение на екстракционна смес. След 5-минутен вихър, пробите се центрофугират при 18 000 × ж за 10 минути при 4 ° С за депротеинизация. След това супернатантните фракции бяха събрани и изпарени до сухо с помощта на вакуумен концентратор (Concentrator plus, Eppendorf). Получените сухи остатъци се суспендират отново в 200 μL 50% метанол, смесват се вихрово и се центрофугират отново при 18 000 × ж за 10 минути при 4 ° С. Най-накрая супернатантните фракции бяха филтрирани през 0.1-μm мембрана (Millipore, САЩ) и прехвърлени във флакони за вземане на проби, които да бъдат анализирани на LC-MS система.
Плазмените проби бяха анализирани с UPLC-MS система (UPLC, Ultra Performance Liquid Chromatography, ACQUITY UPLC H-Class Bio, Waters; MS, Mass Spectrometry, Q-Exactive, Thermo Scientific), снабдена с източник на нагрявана електроспрей йонизация (HESI). UPLC разделянето се извършва на BEH C18 колона (2.1 mm × 100 mm, 1.7 μm, Waters). Подвижна фаза А: 0,1% воден разтвор на мравчена киселина; B: 0,1% разтвор на мравчена киселина ацетонитрил (всички HPLC клас, Thermo Fisher Scientific, NJ, САЩ). Програмата за градиент, както следва: 95% А на 0 минути до 70% А на 5 минути, 5% А на 10 минути и задържана в продължение на 3 минути, след което се връща в първоначално състояние. Скоростта на потока беше настроена на 0.3 mL/min. Проба от обединена плазма и заготовки се инжектира повторно след всеки шест проби за контрол на качеството. Температурата на колоната беше зададена на 35 ° С и обемът на инжектиране беше 5 μL.
MS анализът беше извършен в електроспрей йонизационен положителен режим. Пълните данни за сканиране бяха получени с резолюция 70 000 в масовия диапазон на m/z 67,7–1 000. В допълнение към пълното сканиране, анализът на тандемната масова спектрометрия (MS/MS) беше извършен с помощта на списък за масово включване, който включваше m/z и време на задържане на целевите диференцирани метаболити, изолационен прозорец 0,8 m/z и бяха избрани масова резолюция от 35 000. За MS/MS анализ се извършват сблъсъци при енергии от 35 V.
Анализ на метаболомичните данни
За обработка на метаболомични данни е използван софтуер SIEVE 2.1 (Thermo Scientific). Софтуерът избира пикове над предварително зададения праг, изважда фона и извлича компонента от суровите данни. Филтриране на съединенията с CV 1.5 и P 1 показва, че метаболитът е бил регулиран нагоре, докато промяната в пъти
Резултати
Енергиен метаболизъм след хранене
Плазмените концентрации на глюкоза на PD и CD (преди хранене и 0–8 часа след хранене) са представени на фиг. 1а. Концентрацията на глюкоза в плазмата се е увеличила значително след 30 минути и при двете диети (P Фиг. 1
Аминокиселинни промени след хранене
Бяха изследвани АА на PD и CD без плазма. Концентрацията на обща аминокиселина (TAA) и незаменима аминокиселина (EAA) след прием на PD значително се увеличава и достига своя пик на 1 час (P Фиг. 2
Други плазмени метаболити се променят
Анализ на пътя, генериран с MetaboAnalyst 4.0 въз основа на диференциални метаболити от CD срещу PD. Размер и значение на радиуса на възела (х- ос) отразява стойностите на въздействието на пътя, изчислени с помощта на централността между тях, което взема предвид глобалната структура на мрежата и измерва броя на най-кратките пътища, преминаващи през метаболитите в рамките на възела. Цвят и посока на възела (Y.-ос) обаче се основава на изчисленото P стойност на обогатяващия анализ. PD: пречистена диета на базата на нишесте и казеин и CD: обща диета от царевично-соево брашно
Дискусия
Физиологичният и биохимичен отговор на приема на определена диета са сложен процес. Резултатите от плазмовите метаболоми след хранене са важни за разкриване на храносмилателната и абсорбционната динамика на хранителните вещества. Основната цел на настоящата работа е да изследва постпрандиалните промени в плазмените метаболити, използвайки метаболомика, комбинирана с целеви аналитични подходи като класическа биохимия и количествено профилиране на свободни аминокиселини. PD и CD са използвани в настоящото проучване за изследване на динамичните промени след приема на тези две диети.
В комбинация с класически метаболитни подходи, метаболомиката предоставя пълна и по-задълбочена информация за глобалния метаболитен профил на плазмата [32, 33]. Лизин, валин, пролин, триптофан и техния непосредствен предшественик или производни като 5-аминопентанова киселина, 4-амино-2-метиленбутанова киселина и 5-хидрокси-L-триптофан са регулирани нагоре и всички тези метаболити са свързани с пътища включително д-аргинин и д-метаболизъм на орнитин, метаболизъм на аргинин и пролин, разграждане на лизин, метаболизъм на глицин, серин и треонин. Тези резултати са в съответствие с аминокиселинното профилиране. Интересното е, че палмителаидовата киселина, 13-HODE, 13-L-хидропероксилинолевата киселина и олеиновата киселина са били много по-ниски след хранене. 13-HODE са кислородни продукти на линолова киселина, за които е установено, че са един от най-силните маркери на оксилипин [33]. Всички тези метаболити са свързани с метаболизма на линолова киселина и могат да се регулират надолу поради бавно усвояване и силен метаболизъм на енергия. Сред всички идентифицирани метаболити, концентрацията на 4-ацетилпиперидиниев хлорид, lysoPE, lysoPC и арахидонат остава на относително стабилно ниво по всяко време, което показва, че те могат да минимизират ефекта от времевата линия, като се използват като потенциални вътрешни референции.
Заключение
Въз основа на биохимичните параметри и резултатите от метаболомиката е показана широка карта на това как след хранене метаболитите се променят с течение на времето след прием на PD и CD. Плазмената глюкоза и повечето аминокиселини показват значително увеличение, докато плазмените триглицериди, глутамат и глицин са по-ниски след прием на двете диети. Резултатите от метаболомиката показват метаболити като 5-аминопентанова киселина, пипеколова киселина, орнитин и 5-хидрокси-L-триптофан са значително повишени в плазмата през първия час, докато концентрациите на плазмените триглицериди, глутамат, глицин, палмителаидна киселина, 13-HODE и олеинова киселина са намалени. Регулирането надолу на някои свързани с липидите метаболити в рамките на 1 час след хранене е в съответствие с по-ниската концентрация на плазмените триглицериди, докато дипептидите се регулират нагоре и концентрацията на плазмен левцин и изолевцин намалява в CD. В обобщение, тези открития осигуряват по-добро познаване на хранителната биохимия и физиология след хранене и са от голямо значение за по-нататъшните хранителни стратегии за намеса.
- Ефекти от изсушена със спрей животинска плазма върху приема на храна и очевидната смилаемост на хранителните вещества от котките
- Промени в приема на протеинови храни, количество и качество на въглехидратите и дългосрочна промяна на теглото
- Всичко, от което се нуждаете, за да започнете Whole30, от план за хранене до списък с хранителни стоки - ABC News
- Доказателства за взаимодействие между гени за чувствителност към диабет тип 2 и прием на мазнини в храната за
- Лесен 30-дневен хранителен план за отслабване - Noom