Джеймс Джи МакМури
1 Медицински партньорски изследователски център, Хънтсвил, Алабама, САЩ
Робърт Фелдман
2 Център за клинични изследвания в Кънектикът, Уотърбъри, CT, САЩ
Стивън М Ауербах
3 Професионални изследвания в Калифорния, Нюпорт Бийч, Калифорния, САЩ
Херб ДеРестал
4 Pfizer Inc, Ню Йорк, Ню Йорк, САЩ
Нийл Уилсън
5 Преди това Pfizer Global Research and Development, Sandwich, UK, в момента PPD Inc, Cambridge, UK
От името на Мултицентровата изследователска група
6 Членовете на многоцентровата изследователска група са изброени в приложението
Резюме
Въведение
През март 1998 г. Американската администрация по храните и лекарствата (FDA) одобри силденафил цитрат (Viagra ®, Pfizer Inc, Ню Йорк, Ню Йорк, САЩ) за лечение на еректилна дисфункция (ED) (FDA 1998). Към декември 2005 г. повече от 27 милиона мъже по целия свят са получавали силденафил за лечение на ЕД, включително около 17 милиона мъже в САЩ (Данни в досието, Pfizer Inc, Ню Йорк, Ню Йорк). По този начин дългосрочната безопасност и ефективност на силденафил вече могат да бъдат оценени при мъже, които са приемали лекарството от няколко години.
Ефикасността, безопасността и поносимостта на силденафил при лечението на мъже с ЕД са демонстрирани в многобройни проучвания с продължителност 1 година или по-малко. Например 1358 мъже с ЕД са завършили 1 от 4 двойно-сляпи проучвания и са продължили с отворено лечение със силденафил в разширени проучвания за обща продължителност на лечението около 1 година (Morales et al 1998; Steers et al 2001). В настоящото проучване 979 от тези мъже впоследствие са получили до още 4 години отворена, гъвкава доза (25, 50 и 100 mg) силденафил. Предварителни (3-годишни) резултати са докладвани по-рано (Carson et al 2002; Padma-Nathan et al 2002) и сега представяме окончателните данни. Популацията включва пациенти с ЕД с органична и психогенна етиология и типични съпътстващи медицински състояния за тази популация (т.е. хипертония, диабет, хиперлипидемия и анамнеза за исхемична болест на сърцето). Нашата цел беше да оценим дългосрочната безопасност и ефективност на лечението със силденафил при мъже с ЕД.
Методи
Това беше 4-годишно, отворено, гъвкаво дозиране (25, 50 и 100 mg) проучване на силденафил. Мъжете, които преди това са завършили и са били в съответствие със лечение със силденафил или плацебо в 1 от 4 двойно-слепи, плацебо-контролирани проучвания и впоследствие са завършили и са били в съответствие с лечението със силденафил в първоначалното отворено удължаване, са били допустими за включване в това дългосрочно разширено проучване. Лекарствата за изследване се предоставят безплатно. Съответствието беше оценено чрез дневници за лекарства и чрез продължително участие в проучването.
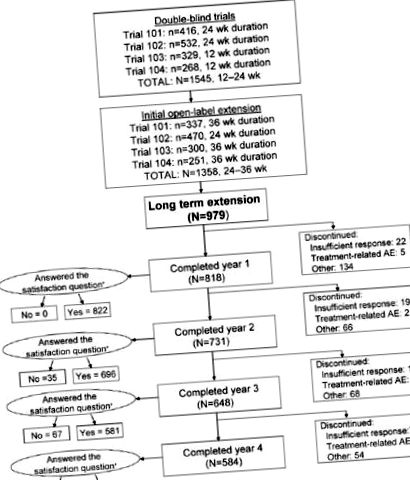
Общо 1545 мъже първоначално са били включени в двойно-сляпите проучвания, като 1358 от тези мъже са продължили в първоначалните открити разширени проучвания. Настоящото проучване включва 979 от първоначалните пациенти, които са се съгласили да участват в дългосрочното удължаване (Фигура 1). Процедурите бяха в съответствие с етичните стандарти на отговорната комисия по експерименти с хора (институционална или регионална).
Брой пациенти и продължителност на лечението в първоначалните двойно-слепи проучвания и първоначалните отворени разширения и разположение в продължение на 4 години от отворено, гъвкаво дозиране (25, 50 и 100 mg) силденафил дългосрочно удължено проучване. От 979 участници, които са участвали в дългосрочното удължено проучване на силденафил, 584 (60%) са завършили всичките 4 години. Причините за прекратяване, различни от недостатъчен клиничен отговор и свързано с лечението нежелано събитие (AE), включват AE, несвързана с лечението, нарушение на протокола, загуба от проследяване и други (например загуба на интерес към участие в клинично проучване, загуба на сексуален партньор и способност да си позволят силденафил след одобрение [следователно, вече няма нужда да участва в клинично проучване за получаване на лекарството]). N за въпроса за удовлетворението („Доволен ли сте от ефекта на лечението върху ерекцията ви?“) Е равен на броя на мъжете, които са отговорили. * Някои от преустановените субекти предоставиха данни за удовлетворението.
По времето, когато проучването стартира, FDA заяви, че има достатъчно рутинни данни за безопасност на силденафил, за да направи излишно събирането на стандартни данни за нежелани събития. Следователно, само сериозни нежелани събития и нежелани събития, водещи до промени в дозировката или до временно или трайно спиране, са регистрирани и оценени от изследователите за свързаност със лечението със силденафил.
Тъй като основният фокус на това проучване е безопасността и то е проектирано преди разработването и валидирането на съобщените от пациентите резултати, за да се оцени удовлетворението от качеството на ерекцията (напр. Въпросник за качество на ерекцията (Porst et al 2007)) или удовлетворението от ED лечение (напр. Инвентаризацията на еректилната дисфункция на удовлетворението от лечението (Althof et al 1999)), ефективността се оценява, като на годишни интервали или при прекратяване се задават прости, невалидирани общи въпроси за ефикасността: „Доволни ли сте от ефекта на лечението върху ерекция? " и „Ако да, лечението подобри ли способността ви да се занимавате със сексуална активност?“ Вторият въпрос се основава на дефиницията на ED за консенсусна конференция на Националните институти по здравеопазване: „... невъзможност за постигане и/или поддържане на ерекция на пениса, достатъчна за задоволително сексуално представяне.“ (Конференция за консенсус на NIH. Импотентност. Панел за разработване на консенсус на NIH за импотентност 1993 г.). Бяха изчислени описателни статистически данни.
Резултати
Като цяло 979 мъже първоначално се съгласиха да участват в проучването, повечето от които бяха бели (89%) и чиято средна възраст беше 58 години (Таблица 1). Продължителността на двойно-слепите проучвания плюс първоначалното отворено удължаване е била 0,9 до 1,2 години (48–60 седмици). Средната продължителност на участието в отвореното, дългосрочно удължено проучване е била 4 години, средният брой на приетите дози е 420 (диапазон, 1–1469) (Фигура 2), а предпочитаната доза е 100 mg при повече от 88 % от мъжете. Степента на задържане е 84% (818/979) през първата година, 75% (731/979) през втората година и 66% (648/979) през третата година; цялото 4-годишно удължено проучване е завършено от 584 от първоначалните 979 мъже (60%) (Фигура 1). Причините за прекратяване включват загуба на интерес към участие в клинично проучване, загуба на сексуален партньор, загуба на последващо проследяване, способност да си позволят силденафил след одобрение (по този начин вече не е необходимо участие в клинично проучване за получаване на лекарството), недостатъчно клиничен отговор и нежелани събития.
Употреба на гъвкава доза (25, 50 и 100 mg) силденафил в продължение на 2–1561 дни от 979 участници, участвали в проучването.
маса 1
Изходни характеристики на 979 мъже
| Възраст, средни (диапазон) години | 58,2 (27–82) |
| Тегло, средно (диапазон) кг | 89,2 (53,5–158,8) |
| Състезание, n (%) | |
| Бял | 873 (89,2) |
| Черен | 68 (6,9) |
| Азиатски | 8 (0,8) |
| Други | 30 (3.1) |
| Продължителност на ED, средни (диапазон) години | 4,5 (0,1–35,8) |
| ED етиология,% органични/смесени/психогенни | 72/17/11 |
| Чести съпътстващи медицински състояния, n (%) | |
| Хипертония | 272 (27,8) |
| Захарен диабет | 213 (21,8) |
| Хиперлипидемия | 139 (14,2) |
| История на исхемична болест на сърцето | 83 (8,5) |
Поносимост
Таблица 2
Нежелани събития, довели до промени в дозировката или до временно или постоянно спиране
| Пациенти с AE, n (%) | 37 (3,8) | 210 (21,5) |
| Преустановено поради AE, n (%) | 11 (1.1) | 55 (5,6) |
| Най-чести (≥0,5%) нежелани реакции, n (%) | ||
| Главоболие | 10 (1,0) | 10 (1,0) |
| Диспепсия | 10 (1,0) | 12 (1.2) |
| Ринит | 6 (0,6) | 6 (0,6) |
| Зачервяване | 5 (0,5) | 5 (0,5) |
| Разстройство на коронарните артерии | 0 | 24 (2,5) |
| Разстройство на простатата | 0 | 16 (1.6) |
| Карцином | 0 | 14 (1.4) |
| Инфаркт на миокарда | 0 | 11 (1.1) б |
| Артрит | 0 | 9 (0,9) |
| Костна фрактура случайна | 0 | 9 (0,9) |
| Случайно нараняване | 0 | 7 (0,7) |
| Цереброваскуларно разстройство | 0 | 7 (0,7) |
| Предсърдно мъждене | 0 | 6 (0,6) |
| Холецистит | 0 | 6 (0,6) |
| Сепсис | 0 | 5 (0,5) |
| Сърдечна недостатъчност | 0 | 5 (0,5) |
| Стомашно-чревен карцином | 0 | 5 (0,5) |
| Костно разстройство | 0 | 5 (0,5) |
Всяка лечебна година по-малко от 1% от мъжете, които са започнали годината, са преустановили приема на силденафил поради нежелани събития, свързани с лечението, за общо само 11 (1,1%) от първоначалните 979 участници през 4-те години на изследването (Таблица 3 ). Прекъсванията са причинени от диспепсия (n = 4), ринит (n = 2), анормално зрение плюс главоболие (n = 1), диспепсия плюс ринит (n = 1) и зачервяване, световъртеж и миалгия (n = 1 всеки).
Таблица 3
Прекратяване в продължение на 4 години
| 1 | 0,5 (5/979) | 2.2 (22/979) | 13,7 (134/979) |
| 2 | 0,2 (2/818) | 2.3 (19/818) | 8,1 (66/818) |
| 3 | 0,1 (1/731) | 1.9 (14/731) | 9,3 (68/731) |
| 4 | 0,5 (3/648) | 1.1 (7/648) | 8,3 (54/648) |
Ефикасност
От 979 мъже, участвали в проучването, 932 (95%) са анализирани за ефикасност. След приключване на всяка година, поне 94% от намаляващия годишно брой участници отчитат удовлетворение от ефекта на лечението със силденафил върху тяхната ерекция, с вариация само с 3,3 процентни пункта в рамките на 4-годишните оценки (Таблица 4). Почти всички от тези мъже съобщават за подобрена способност за участие в сексуална активност.
Таблица 4
Резултат от лечението със силденафил за 4 години
| 1 | 98,1 (806/822) | 99,6 (803/806) |
| 2 | 96,6 (672/696) | 99,9 (671/672) |
| 3 | 94,8 (551/581) | 99,6 (549/551) |
| 4 | 96,3 (550/571) | 100 (550/550) |
Всяка година на лечение по-малко от 3% от мъжете, които са започнали годината, са прекратявали лечението със силденафил поради недостатъчен клиничен отговор. През 4-те години на проучването само 62 (6,3%) от първоначалните 979 участници са прекратили поради недостатъчен отговор (Таблица 3).
Дискусия
- Отслабнете, за да загубите еректилна дисфункция
- Как отслабването може да лекува еректилна дисфункция - урология на Northwoods
- Много жени имат дългосрочно отслабване след; Пъхване на корема,; Отчита пластмасови и реконструктивни
- Хипоталамусна дисфункция MedlinePlus Медицинска енциклопедия
- Липосукция как работи, видове, безопасност, странични ефекти и предимства