Дженифър Шалер
1 Стокбриджско училище по земеделие, Колеж по естествени науки, Университет на Масачузетс в Амхърст, Масачузетс
Джон Стофолано, младши
1 Стокбриджско училище по земеделие, Колеж по естествени науки, Университет на Масачузетс в Амхърст, Масачузетс
Ана Мария Фаусто
2 Dipartimento per la Innovazione nei Sistemi Biologici, Agroalimentari e Forestali, Università della Tuscia, Viterbo, Италия
Габриела Гамбелини
3 Grandi Attrezzature (CGA), Sezione di Microscopia Elettronica Università degli Studi della Tuscia, Витербо, Италия
Джон Буранд
4 Микробиологичен отдел, Колеж по естествени науки, Университет на Масачузетс в Амхърст, Масачузетс
Резюме
Досегашните изследвания на вируса на хипертрофия на слюнчените жлези (SGHV) при три вида мухи се фокусират върху възрастните мухи, които имат достъп до протеинова диета и се хранят с тях. Тъй като много проучвания показват, че диетата засяга вирусна инфекция в много организми, това проучване изследва ефекта на диета без протеини върху ефекта на вируса SGHV при възрастни домашни мухи, Musca domestica. L. Възрастни, заразени с вируса и поддържани само на захарна диета, показват слюнчени жлези със син, а не сивкав цвят и лека хипертрофия в сравнение с мухи, хранени с протеини. Беше възможно извличането на вируса от тези жлези и успешно заразяване на неинфектираните мухи. Когато се инжектират на различни възрасти, женските мухи, хранени само със захар, показват, че независимо от възрастта, хранените със захар мухи все още се заразяват и показват патологията на жлезите. В допълнение, проучванията с електронен микроскоп разкриват на ултраструктурно ниво, че няма разлика между вирусната репликация в клетки от слюнчените жлези на възрастни, хранени с диета без протеини, и тези, които се хранят с протеини.
Въведение
Материали и методи
Получаване и поддържане на мухите и MdSGHV
Инжектиране на MdSGHV
Възрастните са били студено обездвижени за 2 минути при -20 ° C, преди да бъдат инжектирани. Инжекциите се извършват с помощта на инсулинова спринцовка B-D Safety-Lok, 1 ml 29G1/2 (0,3 × 13 mm) с игла ULTRA-FINE, прикрепена към активирана помпа за спринцовки kdScientfic, активирана с крачен педал. С помощта на форцепс BioQuip с олекотена муха мухата се поставя върху иглата на спринцовката, докато 2,5 µl от пробата MdSGHV, разредена 1: 1000 в PBS, се инжектира отстрани на мезоторакса. Мухите, използвани при всяко лечение, са заразени с една и съща вирусна проба, приготвена по същия начин. След инжектиране мухите се поставят в чисти алуминиеви клетки с размери 20 × 20 × 20 cm с вода и само гранулирана захар, или смес от 50:50 гранулирана захар и пълномаслено мляко на прах. След инжектиране мухите в клетка се държат в камера за околна среда на Percival Intellus, настроена на 26 ° C, 40% RH и 16L: 8D фотопериод (Stoffolano 1974) в продължение на 7 дни, при което инфекцията/патологията се оценява чрез дисекция.
Получаване на вирусен инокулум от слюнчените жлези на захарните мухи
Вирусно заразените мухи се дисектират и заразените слюнчени жлези се поставят в епруветки за центрофугиране от 1,5 ml с 0,5 ml PBS и се хомогенизират с ръчен пестик. Инокулумът се филтрира през 0,45 µm филтър за спринцовка, след което се съхранява при -80 ° C фризер, докато се използва за проверка на заразността и за PCR анализ.
Мухи, инжектирани само с PBS, служат като контроли.
Дисекция на слюнчените жлези и изображения
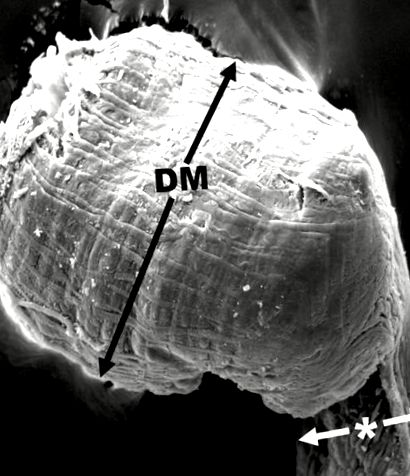
Мухите се поставят в пластмасова чаша и се поставят във фризер -80 ° C за 4 минути, след което се поставят индивидуално върху дисекционен съд с помощта на Ento-щифтове, за да се закрепят под дисекционен микроскоп на Bausch & Lomb. Приблизително 300 µl PBS се използва за заливане на корема на мухата, а неръждаема стомана не. 5 форцепса, използвани за дисекция на корема и отстраняване на слюнчените жлези. За най-добро отстраняване на жлезите слюнчените жлези се хващат в областта на шията от общия канал на слюнчените жлези. Всяка двойка жлези се поставя в епруветки за микроцентрифугиране от 1,5 ml с 50 ul PBS. Жлезите от заразени мухи, използвани за измервания (N = 46 както за хранени със захар, така и N = 44 за мухи, хранени с протеини), бяха поставени върху предметно стъкло в PBS и измерени на Olympus Phase микроскоп с очен микрометър. Бяха направени две измервания: едното се състоеше в измерване на крайната крушка на слюнчената жлеза (фиг. 1, DM), докато другото беше да се измери по-тясната ширина, която беше точно преди крушката (фиг. 1, звездичка). Изображенията са направени с AxioCam ERc5s с програма за изображения Zen.
SEM на дисталния участък на слюнчената жлеза на хранена с протеини възрастна Musca domestica, показваща къде са измерванията за Фиг. Взети са 2 и и 3 3. DM е увеличената дистална луковична част. * Другите измервания са направени точно отзад до тази област (т.е. на по-тясното място). Мащабна лента = 100.0 µm.
PCR протокол
MdSGHV инфекцията на слюнчените жлези от лишени от протеин мухи е потвърдена чрез PCR анализ с два различни набора праймери. ДНК от заразени слюнчени жлези на хранени със захар мухи (N = 10) се пречиства с Qiagen DNeasy Blood & Tissue Kit съгласно протокола на производителя. Условията за PCR циклиране бяха при 94 ° C за 5 минути за първоначална денатурация на матрицата, последвани от 35 цикъла от 94 ° C за 45 s, 45,2 ° C за 45 s, 72 ° C за 1 min, с краен етап от 72 ° C за 7 минути. Използвани са два набора праймери, дегенериран p74 комплект праймери и праймер, специфичен за MdSGHV ORF106 (Abd-Alla et al. 2009). PCR продуктите са анализирани на 1% агарозни гелове (резултатите не са включени).
TEM и SEM на слюнчените жлези
Разделите за ТЕМ бяха подготвени и разгледани съгласно Guerra et al. (2015). За сканираща електронна микроскопия (SEM) мухите се дисектират в PBS, слюнчените жлези се отстраняват внимателно и се поставят в 80% етанол, докато критичната точка се изсуши с помощта на течен CO2. След това жлезите бяха монтирани на кочани, разпръскване, покрито с 15-нм злато и изследвано във FEI Quanta 200 SEM (FEI Company, Hillsboro, OR), при 10 kV в съоръжението за електронна микроскопия в Mt. Холиук колеж, Южен Хадли, Масачузетс.
Ефект на възрастта върху чувствителността на захарните мухи
За да се изследва ефектът от диетата върху чувствителността на мухите в определен ден след раждането, е подготвена клетка от мъжки и женски мухи (N = 110) и мухите получават само гранулирана захар до 14–39 дни, когато женските мухи (всички мъжете в кохортата са починали до 14-ия ден) са инжектирани с вируса, както е посочено по-горе. Седем дни след инжектиране в дни 14–39, всички останали мухи бяха дисектирани, за да се определи чувствителността въз основа на хипертрофия на слюнчените жлези.
Статистика
Използвайки Excel, t-тестът на две проби, като се приемат неравномерни дисперсии, извършени за ширината на тесния регион и крайния луковичен регион на слюнчените жлези на заразени с вируси, възрастни HF, беше извършен за определяне на статистическа значимост.
Резултати
Ефект на вируса върху размера на слюнчената жлеза на захарните мухи
Инжектираният от вируса възрастен HF от двата пола е имал по-малки слюнчени жлези, когато диетата с мухи е била ограничена само до захар (N = 46) в сравнение с мухи, хранени с протеини и захар (N = 44). В рамките на 7 дни след инжектиране с вирус, приготвен от мухи, хранени с протеини, всички заразени, хранени с захар мухи показват тъмносини цветни симптоми на инфекцията SGHV и лека хипертрофия. HF, който е осигурен с протеинова/захарна диета, има слюнчени жлези средно с 23,75% по-големи от мухи, хранени само със захар (Фиг. 2, 3). 3). Извършен е t-тест на две проби, като се приемат неравномерни отклонения, или за по-тясна ширина, или за ширина на луковицата на слюнчените жлези на заразени с вируси на възрастни HF. T Stat беше 5,57, а t критичен 1,66. T Stat е по-голям от t критичната стойност, поради което резултатите са статистически значими.
Влияние на диетата върху слюнчените жлези на заразени с вируси домашни мухи от двата пола, измерени като ширина в тясната част на жлезата (вж. * На фиг. 1). По-тясната ширина е измерена непосредствено преди крайната крушка на жлезата. PS = 350,4 и S = 276,0; P ≤ 0,05.
Ефект от диетата върху дисталната крушка (вж. Фиг. 1, DM) на слюнчената жлеза на заразени с вируса възрастни домашни мухи от двата пола.
Ефект на захарната диета върху компетентността на вируса да заразява други мухи
Мухите, хранени с ограничена диета само със захар, се инжектират с SGHV и се дисектират 7 дни след инжектирането. Слюнчените жлези бяха извлечени и направени в инокулум. Инокулумът се инжектира в неинфектирани мухи, хранени само със захар, за да се тества вирулентността на вируса от мухи с ограничена диета. Всички инжектирани мухи (N = 23) се дисектират 7 дни след инжектирането. Всички тези мухи показаха лека хипертрофия със сините цветни симптоми на SGHV и бяха PCR положителни за наличие на вирус.
Ефект на възрастта върху чувствителността на захарните мухи
От 110 оригинални мухи само женските оцеляват и представляват 72% оцеляване на мухите, дадени само със захар. Броят на мухите, дисектирани в различните дни след склонирането, варира с минимум по една муха на 37 и 39 дни. В противен случай броят на оцелелите мухи в различни дни варира от 3 до 15. Дисекцията на оцелелите 80 женски 7 d postinjection разкрива, че 100% от захранените със захар жени показват патологични симптоми, типични за инфекция с SGHV, което показва способността им да поддържат вирусната репликация.
Ефект на диетата върху ултраструктурата на слюнчените жлези на захарно-фуражни, вирусно инжектирани мухи
ТЕМ на слюнчените жлези само на мухи, хранени със захар, показва ултраструктурни доказателства за вирусна репликация, напомняща тази, показана за мухи, хранени с протеини, в други проучвания, включително събирането на нуклеокапсиди в ядрото и снопове от обвити вирусни частици в цитоплазмата на заразените клетки (Фиг. 4) (Coler et al. 1993, Geden et al. 2008). Докато бяха открити клъстери от нуклеокапсиди, свързани с вирусогенната строма, отделни частици, наблюдавани в периферията на ядрото, често се подравняват и явно излизат от ядрената мембрана.
ТЕМ на слюнчената жлеза на вирусно инфектиран, захранван със захар, възрастен HF. Ядрото (Nu) съдържа множество вирусни нуклеокапсиди, свързани с вирусогенната строма (бели конвергентни стрелки). Черната вертикална стрелка показва нуклеокапсид, напускащ стромата и навлизащ в нуклеоплазмата (вмъкването в долния ляв ъгъл е увеличение на тази област). Нуклеокапсиди, подравнени с ядрената мембрана (Nm) (виж единична бяла стрелка и вложка, показваща уголемяване), преди да влязат в цитоплазмата (Cy). Вложката показва сноп обвити (MdSGHV) нуклеокапсиди (вертикална стрелка) в цитоплазмата и надлъжен разрез (хоризонтална стрелка) на единичен обвит вирион в цитоплазмата, взет от областта, заобиколена в черно. Мащабната лента = 2 µm.
Дискусия
Слюнчените жлези на насекомите са изключително важни в репликационния цикъл и векторирането на различни вирусни патогени. По този начин HF за възрастни и свързаният с него вирус е отлична моделна система за изследване на насекомото векториране на вируси, при което механизмите на заразяване и предаване все още трябва да бъдат изяснени (Kariithi et al. 2017a). Способността на вируса да поеме развитието на яйчниците и да предотврати развитието на яйцеклетките, както и въздействието, което вирусът има върху предотвратяването на чифтосването, може да доведе до разработване на нови начини за борба с този вредител в целия свят в бъдеще.
Заключение
Доказано е, че диетата има физиологични ефекти върху слюнчените жлези на мухата, когато става въпрос за размер. Домашните мухи с протеини в диетата им са имали жлези с 23,75% по-големи от тези, които се хранят само със захар, което предполага, че липсата на протеини в диетата влияе не само на производството на JH, но и на размера на жлезите в сравнение с мухите, хранени с протеини (Yin and Stoffolano 1990) . Дори с липсата на увеличение на размера на слюнчените жлези при мухи, хранени със захар, заразени с вируси, репликацията на вируса в тези жлези изглеждаше нормална и беше инфекциозна, когато се инжектира в незаразени мухи, хранени само със захар.
- Диетични влияния върху кръвното налягане Ефектът на средиземноморската диета върху разпространението на
- Ефект от високо протеинова диета върху поддържането на нивата на кръвното налягане, постигнати след първоначалното тегло
- Ефект на високо протеинова диета върху 24-часовия профил на Грелин, GH (растежен хормон) и IGF-1
- Ефект от диета с високо съдържание на зеленчуци, плодове и ядки върху серумните липиди - ScienceDirect
- ВЪЗДЕЙСТВИЕ НА НИСКОМАСТНА ВИСОКОУГЛЕХИДРАТНА ДИЕТА НА СИМПТОМИТЕ НА ЦИКЛИЧНАТА МАСТОПАТИЯ - ScienceDirect