Катедра по лабораторна медицина, клинична физиология, Каролинска институт, Каролинска университетска болница;
Адрес за заявки за повторно отпечатване и друга кореспонденция: Т. Густафсон, катедра по лабораторна медицина, Секция по клинична физиология, Karolinska Institutet, 141 86 Стокхолм, Швеция (имейл: [имейл защитен]).
Катедра по лабораторна медицина, клинична физиология, Каролинска институт, Каролинска университетска болница;
Отделения по андрология и молекулярна ендокринология, Медицински отдел, Каролинска институт, Университетска болница Каролинска, Стокхолм, Швеция;
Катедра по физиология и фармакология, Karolinska Institutet, Стокхолм, Швеция; и
Лаборатория за човешка ефективност, държавен университет Ball, Мънси, Индиана;
Национална администрация по аеронавтика и космос, Космически център Джонсън, Хюстън, Тексас;
Катедра по физиология и фармакология, Karolinska Institutet, Стокхолм, Швеция; и
Департамент по здравни науки, Университет в Средна Швеция, Естерсунд, Швеция
Резюме
Пътят на Ub-P е съгласувано действие на три ензима на убиквитин лигаза, т.е. Доказано е, че атрогин-1 и MuRF-1, два подтипа E3 убиквитин лигаза, играят централна роля в процеса на мускулна атрофия (6, 18, 26, 39, 42). И двете се регулират от членове на семейството FOXO и се регулират в условия, водещи до загуба на мускули (43). Като се има предвид, че Ub-P разгражда само мономерни актин и миозин, други протеази, например каспаза-3, калпаин-2 и калпаин-3, са необходими, за да подпомогнат разграждането на протеина на Ub-P (4, 14, 20, 25).
Картината обаче е по-сложна и се знае, че и други пътища влияят върху мускулната маса. Например, членовете на пътищата, активирани от митоген протеин киназа (MAPK), например р38, се активират и инициират процеси на разграждане на протеини в отговор на мускулно разтоварване (29). Миостатинът, който е член на транссемейството на трансформиращия растежен фактор (TGF) -β, също се очертава като важен регулатор на мускулния размер (21, 27). Загубата на функция на миостатина насърчава изразена хипертрофия както в скелетните мускули на човека, така и при животните (24, 41), а системното приложение на миостатин предизвиква тежко загуба на мускулна маса (34, 49). Освен това свръхекспресията на миостатин води до кахексия при мишки, придружена от повишена експресия на атрогин-1 и MuRF-1 при мишки (34). Последни проучвания върху скелетни мускули на гризачи също свързват активността на миостатина с пътя PI3K-Akt1 (3, 10).
Нашите изследвания показват, че едностранната суспензия на долните крайници (ULLS) предизвиква протеолиза след 3 дни (45), а силната атрофия на цели мускули е очевидна само за няколко седмици от ULLS (5, 19, 44). Настоящото разследване изследва ефектите на 3-дневния ULLS върху потенциалните кандидат-сигнални пътища в мускулите с тегло при здрави възрастни мъже. Ние предположихме, че 3 дни ULLS предизвикват загуба на мускулна маса чрез намалено активиране на PI3K-Akt1 и повишена експресия на миостатин. Тъй като трицепс сура показва по-голяма атрофия от мускула на квадрицепса в отговор на продължителна почивка в леглото (1, 46), ние също проучихме сигналните пътища и генната експресия в двете носещи тегло мускули Огромни латерали (VL) и Солеус (Сол) преди и след 3 дни ULLS. Ние предположихме, че сигналните пътища, които инициират процеси, водещи до мускулна атрофия, ще бъдат по-изразени в Sol.
Субекти.
Осем здрави възрастни мъже (средно ± SD; 25 ± 5 години, 183 ± 3 см, 76 ± 8 кг) бяха наети от столичния район на Стокхолм. Пробата на пациента варира от физически активни до заседнали индивиди. Преди експериментите субектите бяха скринирани за всяка история на патология на долните крайници, нервно-мускулно разстройство или сърдечно-съдови заболявания. Писмено съгласие беше получено от всеки субект, след като беше информиран за процедурите, рисковете и потенциалните ползи, свързани с експериментите. Протоколът за изследване е одобрен от Комитета по етика към Института Каролинска.
Разтоварване.
ULLS се осъществява, както е описано по-рано (44, 45). Накратко, изправените или амбулаторни дейности бяха подпомогнати от патерици с къса дължина с ръкохватка и опора на предмишницата, отдалечени до лакътя (Swereco Rehab AB, Sollentuna, Швеция). Десният крак е снабден с обувка, снабдена с дебела подметка с дебелина 10 см, за да се премахне тежестта, натоварена от левия ненатоварен крайник. На обувката нямаше ремъци, задържащи движението на глезена или колянната става. Субектите са живели у дома и са поддържали нормалните си професионални задачи през целия експериментален период. Съответствието беше насърчавано чрез ежедневно взаимодействие с един от следователите. Две седмици преди интервенцията на ULLS, всички субекти преминаха четири сесии, за да практикуват ходене на патерици и ежедневни задачи, свързани с интервенцията на ULLS. Субектите се въздържаха от всякакви тежки физически натоварвания 3 дни преди появата на ULLS, но въпреки това поддържаха нормалните си хранителни навици. Въпреки това, 24 часа преди каквито и да било измервания, диетата беше осигурена като стандартизирани ястия, състоящи се от тестени изделия и зеленчуци.
Събиране на мускулни проби.
Мускулни биопсии са получени от десния крак преди ULLS и от левия крак след завършване на 3 дни (72 h) ULLS, преди да се възобнови каквато и да е дейност с тегло. След бърза нощ и след инжектиране на локален анестетик (карбокаин) и разрез на кожата се получават мускулни биопсии от VL и Sol с помощта на 5-мм игла Bergström (Bergström 1962). Мускулните проби се почистват от излишната кръв, съединителната тъкан и мазнините и след това се замразяват в течен азот и се съхраняват при -80 ° C до по-нататъшен анализ.
Екстракция на протеини и Western blot.
РНК изолация, обратна транскрипция и количествена PCR в реално време (RT).
Статистика.
След тест за нормалност беше използван непараметричен тест за сдвоени проби на Wilcoxon, за да се оцени ефекта от времето (преди; след) и мускулите (VL; Sol) върху протеиновото фосфорилиране и експресията на иРНК (Statistica, StatSoft, Tulsa, OK). Разликите преди V пост след теста бяха тествани спрямо разликите преди Sol в Sol, за да се идентифицира взаимодействието между двете мускули. Значението беше прието в P 0,05; Фиг. 1). Преди ULLS, експресиите на IGF1, FOXO-1A, FOXO-3A, каспаза-3 и калпаин-2 и -3 иРНК бяха по-големи за Sol от VL (P 0,05; Фиг. 2). Нямаше разлики (P > 0,05) в изходната mRNA експресия на атрогин-1, MuRF-1, 4E-BP1 или миостатин между мускулите. Атрогин-1 обикновено е по-висок в Sol в сравнение с VL (P = 0,12; данните не са показани). Atrogin-1 и MuRF-1 се увеличават в VL, но не и Sol, след ULLS (време на взаимодействие и мускули P 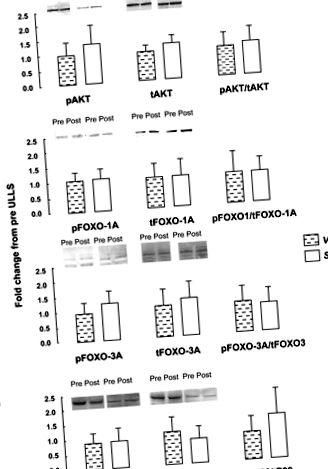
Фиг. 1.Фосфорилирано и общо количество протеин и съотношението на фосфорилираното (p) към общото (t) количество протеин за Akt1–1 (A), Вилична кутия клас O (FOXO) -1A (Б.), FOXO-3A (° С) и p38 (д) преди (Pre) и след (Post) 3 дни едностранно суспендиране на долните крайници (ULLS) в мускула ogromus lateralis (VL) и мускула на солеуса (Sol) (н = 8). Колоните показват средната стойност, а стълбовете означават SD.
Фиг. 2.Промени в експресията на иРНК на IGF1, FOXO-1A и FOXO-3A (A) и на каспаза-3, калпаин-2 и калпаин-3 (Б.) във VL и Sol. експресиите на иРНК се нормализират към гена за поддържане на GAPDH. Графиките в кутиите показват 25–75 процентила и средни стойности (н = 8).
Фиг. 3.Fold променя mRNA експресията на атрогин-1 и MuRF-1 във VL и Sol. Атрогин-1 се нормализира както към 18S, така и към GAPDH, за да се демонстрира, че промените в съотношенията на целевия ген/домакински гени са независими от промените в специфичен ген за домакинство. # Разлика (P
Фиг. 4.A: кратни промени на еукариотния фактор за иницииране на транслация на транслация 4Е, свързващ протеин 1 (4E-BP1) нива на иРНК в VL и Sol. иРНК се нормализират до GADPH като домакински ген. Б.: кратните промени във фосфорилирания 4E-BP1 са нормализирани нива на общия протеин в VL и Sol. # Разлика (P
Фиг. 5.A: кратни промени в нивата на иРНК на миостатин в VL и Sol. иРНК се нормализира до GADPH като домакински ген. Б.: кратни промени в нивата на миостатин протеин в VL и Sol. * Значителна разлика (P
Разпадането на скелетната мускулатура е очевидно в рамките на дни (45) и здрава атрофия на цели мускули се появява в рамките на седмици при здрави индивиди, подложени на ULLS (5, 19, 44). Предвид тези наблюдения беше хипотезирано, че генната експресия и сигналните пътища, контролиращи атрофичните процеси в мускулната клетъчна култура и животинските модели, ще бъдат променени в човешките скелетни мускули само след няколко дни без тегло. Всъщност, ние показахме повишени нива на иРНК на атрогин-1 и MuRF-1, ключови фактори в активирането на пътя на Ub-P, след 3 дни ULLS. Макар и паралелни промени в фосфорилирането на Akt1 не настъпиха, имаше едновременно повишаване на нивата на mRNA на миостатин и протеини.
Двата специфични за мускулите E3 убиквитин лигазни протеини, атрогин-1 и MuRF-1, се активират в експериментални модели, които предизвикват загуба на мускулна маса. Следователно тези фактори са определени като маркери за деградация на скелетната мускулатура (4, 6, 18, 26, 39, 42). В скорошно проучване съобщихме засилена протеолиза на актин и миозин (45) и настоящото разследване показа повишени нива на атрогин-1 и MuRF-1 на иРНК след 3 дни ULLS. Колективно тези открития предполагат, че протеолизата на скелетните мускули се появява в началото на атрофичния процес чрез активиране на Ub-P пътя. И все пак, на ниво иРНК, факторите „нагоре“ в процеса на разграждане на протеина, т.е. каспаза-3, калпаин-2 и калпаин-3, са непроменени след ULLS. Това наблюдение е в съответствие с общата идея, че тези ензими се активират протеолитично чрез разцепване на предварително образувани протеини (4, 17, 25). По този начин бъдещите изследвания на ULLS, изследващи промените в активността или съдържанието на скелетните мускули, са оправдани.
Мускулната атрофия също може да бъде улеснена чрез компрометиран протеинов синтез (6, 15, 16, 42). Докато регулирането на протеиновия синтез се медиира чрез редица транслационни фактори (32, 37), изглежда дефосфорилирането на 4E-BP1 контролира скоростта на протеинов синтез чрез инхибиране на протеиновото транслация чрез засилено свързване с eIF-4E. В настоящото проучване 4E-BP1 иРНК и съотношението на фосфорилиране и протеин нарастват паралелно. Значението на промяната в един фактор обаче не трябва да се надценява, но не поддържа намален протеинов синтез в ранната фаза на ULLS. Това контрастира с добре документираната констатация на атенюиран протеинов синтез след по-удължено време на мускулна недостатъчност (35).
- Ендотоксемия и чернодробно увреждане в модел на гризачи за разтоварване на задните крайници Journal of Applied Physiology
- Ефекти от високо протеиновата диета върху дебелото черво при хора с наднормено тегло - изглед в пълен текст
- Ефекти от диетата върху клиничните признаци на екзокринна панкреатична недостатъчност при кучета
- Инхибират ли диетите с високо съдържание на мазнини мускулна хипертрофия при хората
- Ефекти от затлъстяването върху размера на гърдите, структурата и функцията на гръдния кош на гръбначния стълб, горната част на торса
