Резюме
Животински модел. В това проучване са използвани мъжки плъхове Wistar (250-300 g), мишки C57BL/6 и мишки C3H/HEJ (20-25 g). Животните бяха хранени със стандартна лабораторна чау, получиха свободен достъп до вода и се поддържаха в 12: 12-часов цикъл светлина-тъмнина. HU (н = 8 животни/щам на гризачи) е постигнато с помощта на модела, адаптиран от Wronski и Morey-Holton (53); несуспендираните животни, настанени поотделно, са използвани като контроли (н = 6 животни/щам на гризачи). Накратко, животните се анестезират с помощта на кетамин-ксилазин коктейл и апарат, подобен на отливка, се прилага върху опашката. За да се улесни свободното движение около клетката, гипсът беше прикрепен към въртящ се елемент, закрепен към върха на клетката, позволяващ обхват на 360 °. Животните бяха окачени в позиция на наклон 30 °. По време на HU ъгълът на окачване беше коригиран с увеличаване на размера на тялото, за да се предотврати тежестта върху задните крайници. Тъй като окачените животни имат ограничено движение, животните се подстригват ежедневно, за да се предотвратят усложнения като попарване на урина и инфекция. Този протокол за боравене с животни беше одобрен от Комитета по изследване на животните на Baylor College of Medicine преди проучването.
Измерване на ендотоксини. След 4 седмици се вземат хепаринизирани кръвни проби от порталната вена или куха вена. Подобрен метод за откриване, разработен по-рано, беше използван за измерване на ендотоксин (42). Накратко, пробите се центрофугират при 50 ° С ж в продължение на 10 минути и богата на тромбоцити плазма (PRP) се съхранява при -80 ° C. Плазмените проби се разреждат 1:10 и се загряват до 75 ° С в продължение на 10 минути, за да денатурират протеини, които пречат на анализа. Впоследствие ендотоксинът се измерва чрез използване на кинетичен тест с хромогенен субстрат, базиран на анализа на лимуза на амебоцити Limulus (BioWhittaker). Концентрацията на ендотоксин се изчислява от стандартите, изготвени за всеки анализ в плазма от нетретирани животни. За да се предотврати замърсяването с екзогенен ендотоксин, беше използвана строга непирогенна техника за вземане на проби и процедура за анализ.
Хистопатология. В края на експеримента малка част от черния дроб беше дисектирана и консервирана в буферно формализиран цинк. Впоследствие тъканите бяха обработени за рутинно оцветяване с хематоксилин и еозин, за да се оцени общата архитектура и нараняване. Съдържанието на чернодробни неутрофили се определя чрез имунохистохимично оцветяване с клон анти-неутрофилни антитела 7/4 (serotec). Преброен е броят на положително оцветените неутрофили в 70-mm 2 зона.
Ензимна активност. Непосредствено преди смъртта се вземат кръвни проби от долната куха вена и серум, съхраняван при -80 ° C. Активността на ALT и AST се измерва като маркери на увреждане съгласно стандартните процедури за ензимен анализ (8).
Фактор на туморна некроза-α. Измерването на фактор на туморна некроза-α (TNF-α) беше извършено в кръвни проби от контролни и HU гризачи с помощта на цитоскринен комплект за имуноанализ (Bio-source International, Camarillo, CA).
Цитохром P-450 ELISA. Микрозомни фракции бяха изолирани от чернодробни хомогенати чрез метода на утаяване с калциев хлорид (12). Общото съдържание на протеин в микрозомалната фракция се определя по метода на Брадфорд (9). Впоследствие, протеинови нива на цитохром P-450 2B и 3A бяха измерени при 37 ° C на микроплаки съгласно стандартна ELISA кит процедура (Amersham Biosciences, Бъкингамшир, Великобритания).
Молекулни сонди. Специфична cDNA сонда за реагента с остра фаза на серумен амилоид А (SAA) се приготвя чрез RT-PCR, като се използват следните праймери: смислов праймер, 5′-TATGATGCTGCYMAAAGGGG-3 '; антисмислен грунд, 5′-CTCAGACAAATACTTCCATG-3 ′. Проведени са протоколи за обратна транскрипция с 5 μg обща РНК. Аликвотни части от реакцията на обратна транскрипция се усилват с използване на 5 U Taq ДНК полимераза (Promega, Madison, WI) за 30 цикъла при 93 ° С за 1 мин, 55 ° С за 2 минути и 72 ° С за 3 минути. Полученият 222-базисен двойка фрагмент се пречиства и клонира в pGEM-T лесния вектор (Promega) преди секвениране. КДНК клонингите за хаптоглобин и липополизахариден свързващ протеин (LBP) са получени в търговската мрежа (ATCC, Manassas, VA).
Изолация на РНК. Черният дроб, получен от контролни и HU животни, незабавно се замразява в течен азот. Общата РНК се извлича от замразен черен дроб чрез киселинния гуаниев тиоцианат-фенол-хлороформ метод (11). Впоследствие 10 μg от общата РНК, съдържаща етидиев бромид, се електрофорезира върху 1% агарозни гелове, съдържащи формалдехид, и след това се прехвърля в найлонова мембрана (Gene Screen Plus; New England Nuclear, Бостън, Масачузетс) чрез стандартни процедури.
Северна хибридизация. Мембраните бяха хибридизирани в QuikHyb (Stratagene, La Jolla, CA) при 68 ° C в продължение на 2 часа с 1 × 10 6 dpm случайни хексамер 32 P-маркирани cDNA сонди и филтрите бяха обработени, както е описано по-горе (44). Количественото определяне на резултатите от северната хибридизация се извършва чрез денситометрия. Плътността се нормализира до интензивността на 18S рибозомната РНК субединица, както е описано по-горе (17).
Анализ на данни. Статистическият анализ на представените тук данни е извършен с помощта на Student т-тест или двупосочен ANOVA с тест за множество сравнения на Tukey, където е подходящо; P 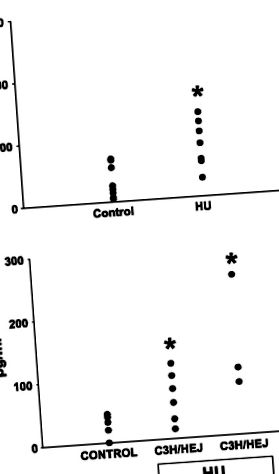
Фиг. 1.Нива на ендотоксин в порталната вена на плъхове (A) и мишки (Б.). HU, разтоварване на задните крайници. Непосредствено преди смъртта се вземат кръвни проби от порталната вена и ендотоксинът се измерва в богата на тромбоцити плазма с помощта на анализа на лимулатния амебоцитен лизат. Стойностите са средни стойности ± SE от 4-6 наблюдения на група; данни от плъхове (A) бяха анализирани с помощта на Student's т-тест; двупосочен ANOVA е използван за анализ на данни от мишки (Б.). * P
Фиг. 2.Чернодробно увреждане след HU. Хематоксилин и еозин оцветени чернодробни секции за контрол (A-° С) и 4-седмичен HU (д-F). Представителните секции са от плъхове (A и д), C57BL/6 мишки (Б. и Е.) и мишки C3H/HEJ (° С и F).
Фиг. 3.Серумни ензими на плъхове (A) и мишки (Б.). Серумните нива на аспартат аминотрансфераза (AST) и аланин аминотрансфераза (ALT) се измерват чрез използване на стандартни спектрофотометрични тестове, както е описано в методите. Стойностите са средни стойности ± SE от 4 наблюдения на група. Данни от плъхове (A) бяха анализирани с помощта на Student's т-тест; двупосочен ANOVA е използван за анализ на данни от мишки (Б.). * P
Фиг. 4.Нива на плазмен тумор некротичен фактор-α (TNF-α) или плъхове (A) и мишки (Б.). TNF-α е измерен в кръвни проби, събрани по време на смъртта. Данните са средно ± SE от 4 наблюдения на група за плъхове (A) и мишки (Б.). Данните от мишки бяха анализирани чрез използване на двупосочен ANOVA; * P
Доказателства за реакция на остра фаза. Добре известно е, че ендотоксемията може да стимулира експресията на реагенти с остра фаза (7, 22); следователно се анализира експресията на иРНК на представителните реагенти SAA, хаптоглобин и LBP. Хаптоглобинът и LBP са съответно 1,06 ± 0,4 и 1,60 ± 0,05 при контролни плъхове (н = 4). Експресията на тези протеини се повишава значително с ~ 50 и 60%, съответно, след 3 седмици HU (н = 5; P
Фиг. 5.експресия на иРНК на протеини с остра фаза при мишки. Обща тРНК е изолирана от черния дроб на C57BL/6 (A) и мишки C3H/HEJ (Б.); иРНК за протеините с остра фаза хаптоглобин (HP), серумен амилоид A (SAA) и липополизахариден свързващ протеин (LBP) бяха открити чрез анализ на Northern blot. Плътността на всяка лента беше определена спрямо 18S лентата. Числата над всяка лента показват гъвкавото увеличение на плътността спрямо най-ниската плътност за всяка сонда в този експеримент. Пътища 1-4 са от независими контроли; платна 5-7 и 8-10 са чернодробни проби, събрани съответно след 3 и 4 седмици HU.
Цитохром P-450 2B и 3A експресия. Експресия на протеин на CYP 2B и CYP 3A, две представителни изоформи на цитохром P-450, беше измерена чрез ELISA, за да се определи дали HU-индуцираното увреждане на черния дроб е променило метаболитния капацитет на черния дроб. Експресията на протеин на CYP 2B и CYP 3A е съответно 231,0 ± 85 и 29,6 ± 1,7 μg/mg микрозомен протеин при контролни плъхове. След 4 седмици HU, протеиновата експресия на тези изоформи е намалена с 30-70% (Фиг. 6). От друга страна, при мишки експресията на протеини на тези ензими не се влияе от HU (данните не са показани).
Фиг. 6.Ефект на опашната суспензия върху нивата на протеин на цитохрома P-450 2B (A) и 3A (Б.). Черният дроб от контролните плъхове, суспендирани за 4 седмици, се изрязва, замразява се в течен азот и се съхранява при -80 ° С. Микрозомната фракция се изолира и съдържанието на CYP3A и 2B се измерва чрез ELISA, както е описано в методите. Стойностите са средни стойности ± SE от 4 наблюдения на група. * P
HU води до ендотоксимия на порталната вена и отговор на остра фаза. Ендотоксинът (липополизахарид) е полимер във външната мембрана на грам-отрицателни бактерии, открити предимно в илеума и дебелото черво. Обикновено чревната стена осигурява защитна бариера срещу освобождаването на големи количества ендотоксин в системната циркулация. Въпреки това, при патофизиологични условия, чревната пропускливост може да се увеличи значително, което позволява на бактериите и бактериалните компоненти да изтекат в кръвообращението.
Механизмът, лежащ в основата на порталната ендотоксемия, не е идентифициран. Съдови промени, включително повишен приток на кръв към стомашно-чревния тракт, са докладвани след HU (14, 25). Смята се, че подвижността на червата е по-бавна по време на излагане на микрогравитация (5). Тези промени могат да доведат до транслокация на бактерии и бактериални продукти като ендотоксин от лумена на червата в циркулацията.
Като механизъм за възстановяване на хомеостатичното състояние след травма и инфекция, глюкокортикоидите и получените от макрофаги цитокини инициират синтеза и секрецията на реагенти с остра фаза; голяма част от тези реагенти се произвеждат от черния дроб. Ендотоксемията е мощен индуктор на реакцията на острата фаза (7), феномен, най-вероятно медииран от получените от Kupffer цитокини. В подкрепа на HU като модел на ендотоксемия, експресията на клас I протеини с остра фаза хаптоглобин, SAA и LBP беше подобрена при мишки C57BL/6 само след 3 седмици HU (Фиг. 5). При мишки C3H/HEJ експресията на SAA е повишена само в 4-седмичен момент. Това наблюдавано забавяне на повишената експресия на SAA при ендотоксин-резистентни мишки показва, че ендотоксинът играе роля в ранния остър фазов отговор след HU. Въпреки това, допълнителни фактори най-вероятно допринасят за резултата от острата фаза в по-късни моменти.
Индуцирано от HU нараняване води до промяна на чернодробната функция. Провъзпалителните цитокини като TNF-α са известни с това, че предизвикват чернодробно увреждане и дисфункция (13). В действителност е доказано, че TNF-α играе важна роля в механизмите, лежащи в основата на увреждането на черния дроб и може директно да намали нивата на протеин на цитохрома P-450 (34, 39). Както се съобщава тук, TNF-α се увеличава при мишки C57BL/6 след HU и се наблюдава тенденция към повишаване на серумните нива на този цитокин при плъхове HU в сравнение с несуспендираните контроли (Фиг. 4). Вероятно е повишеният циркулиращ TNF-α да допринесе за развитието на нараняване и чернодробна недостатъчност поради HU.
Това е публикация на Министерството на земеделието на САЩ (USDA), Службата за земеделски изследвания (ARS) Детски изследователски център за хранене, Департамент по педиатрия, Медицински колеж Бейлор и Тексаска детска болница, Хюстън, Тексас. Тази работа беше подкрепена от федерални средства от USDA/ARS по грант USDA 6250-5100-037, Център за храносмилателни болести на брега на Тексаския залив (под Националния институт по здравеопазване Грант DK-56338) и Националния космически институт за биомедицински изследвания (NCC9- 58). Съдържанието на тази публикация не отразява непременно възгледите или политиките на USDA, нито споменаването на търговски наименования, търговски продукти или организации не предполага одобрение от правителството на САЩ.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Благодарим на д-р Сюзън Блумфийлд (доцент, Катедра по здравеопазване и кинезиология, Тексаски университет A&M) за съдействието с модела HU.
- Ефекти от 3-дневно разтоварване върху молекулярните регулатори на мускулния размер при хора Journal of Applied
- Безклетъчно увреждане на пълноклетъчни хепатоцити и ниша на чернодробните стволови клетки в прогресията на
- Диета и изразяване на микроРНК Систематичен преглед - McNaughton - 2017 - The FASEB Journal - Wiley
- Фокална нодуларна хиперплазия и чернодробен аденом Епидемиология и патология - FullText - Храносмилателна система
- Вестник Food & Nutrition (ISSN 2575-7091) - Издатели Gavin
