Емануела Виджано
1 Катедра по експериментална медицина - Секция по човешка физиология, Втори университет в Неапол, Неапол, Италия
2 Катедра по медицина, Университет в Падуа, Падуа, Италия
Мария Пина Молика
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Лила Лионети
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Джина Кавалиер
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Джована Тринчезе
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Киара Де Филипо
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Серджо Киефи
1 Катедра по експериментална медицина - Секция по физиология на човека, Втори университет в Неапол, Неапол, Италия
Марчело Гайта
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Антонио Барлета
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Бруно Де Лука
1 Катедра по експериментална медицина - Секция по физиология на човека, Втори университет в Неапол, Неапол, Италия
Мариана Криспино
3 Катедра по биология, Университет в Неапол Федерико II, Неапол, Италия
Марчелино Монда
1 Катедра по експериментална медицина - Секция по физиология на човека, Втори университет в Неапол, Неапол, Италия
Свързани данни
Резюме
Въведение
Затлъстяването и диабетът са основните причини за заболеваемост и смъртност в западния свят и могат да доведат до възпалителни реакции и оксидативен стрес в периферните тъкани (Hotamisligil, 2006). Няколко данни показват, че свързаните с прехранване заболявания също са свързани с възпаление и повишени нива на реактивни кислородни видове (ROS) в мозъка (Cai, 2009). Хипоталамусът е мозъчният регион, отговорен за различни метаболитни регулации и много заболявания, свързани с прехранване, са етиологично свързани с дерегулациите на хипоталамусните неврони, които са много уязвими към хранителния оксидативен стрес и възпаление (Cai, 2009). Доказано е, че прекомерното хранене може да активира IKKβ/NF-κB в медиобазалния регион на хипоталамуса, който е зоната, отчитаща хранителния статус и регулираща метаболизма (Zhang et al., 2008). IKKβ/NF-κB е главен превключвател и централен регулатор на вродения имунитет и свързаните с него функции. Някои проучвания предполагат, че IKKβ/NF-κB, като медиатор на метаболитно възпаление, може да представлява връзката между прекомерното хранене и дисфункциите на хипоталамусната сигнализация, които причиняват затлъстяване и свързаните с тях проблеми (Zhang et al., 2008).
Един от мощните контрарегулатори на възпалителните сигнални пътища е аденозин монофосфат-зависимата киназа (AMPK; Salt and Palmer, 2012; Hernández-Aguilera et al., 2013). AMPK, еволюционно запазена серин/треонин киназа, е хетеротримерен комплекс, образуван от каталитична α субединица и регулаторни β и γ субединици. Фосфорилирането на α субединицата, в Thr172, превръща AMPK в активирана форма pAMPK. AMPK е сензор за клетъчно енергийно състояние, който, когато се активира от метаболитен стрес, е в състояние да поддържа хомеостазата на клетъчната енергия чрез включване по катаболни пътища (Hardie, 2014).
Няколко проучвания демонстрират, че AMPK в хифоталамуса регулира приема на храна и че неговата активност се модулира от няколко хормона като лептин, адипонектин и инсулин. Тъй като тези хормони участват в контрола на телесното тегло и метаболизма на глюкозата и липидите, тези открития предполагат, че AMPK може да служи като ефектор надолу по веригата на лептин и инсулин и по този начин да играе роля като сигнална молекула по време на метаболитни реакции, предизвикани от хормони. Докато лептинът инхибира AMPK активността в дъгообразните и в паравентрикуларните ядра на хипоталамуса, инсулинът е известен с това, че инхибира AMPK активността в страничните, вентромедиалните и дорзомедиалните хипоталамусни области (Minokoshi et al., 2004). Всички тези мозъчни региони участват в контрола на приема на храна (Monda et al., 1993; Viggiano et al., 2006) и в енергийните разходи (Monda et al., 1996; Messina et al., 2013).
Полиненаситените мастни киселини ω-3 (PUFA), докозахексаеновата киселина (DHA) и ейкозапентаеновата киселина (EPA) са диетични съединения, които интензивно се изучават като мощни противовъзпалителни продукти, способни да намалят риска от инсулинова резистентност и да подобрят свързаното със затлъстяването нарушения, засягащи хормоналния контрол и модулиращи активността на AMPK (Xue et al., 2012; Martínez-Fernández et al., 2015). Наскоро демонстрирахме, че заместването на свинска мас, богата на наситени мастни киселини (SFA), с рибено масло (богато на ω-3 PUFA) при диета с високо съдържание на мазнини (HFD) е в състояние да ограничи развитието на системно и тъканно възпаление, чернодробна стеатоза и за намаляване на инсулиновата резистентност (Lionetti et al., 2014a, b; Cavaliere et al., 2016).
Тук тествахме на ниво хипоталамус ефекта на заместване на наситени с ненаситени мастни киселини върху AMPK, активиран AMPK (pAMPK при Thr 172), IKKβ, възпаление и оксидативен стрес. Нещо повече, ние също анализирахме при същите животни участието на инсулин, лептин и възпалителни параметри в модулацията на AMPK.
Материали и методи
Всички химикали са закупени от Sigma – Aldrich (Сейнт Луис, Мисури, САЩ), освен ако не е посочено друго. Млади мъжки плъхове Wistar (на 60 дни; 345 ± 7 g; Charles River, Calco, Lecco, Италия) бяха индивидуално поставени в клетка в контролирана от температурата стая и изложени на ежедневен цикъл 12/12 h светлина/тъмнина със свободен достъп до чау диета и питейна вода. Плъховете бяха разделени на три експериментални групи (n = 8) според различен 6-седмичен хранителен режим: първата група (контролна диета, CD) получи стандартна диета (10,6% мазнини J/J); втората група (LD) получи HFD, богата на свинска мас (40% мазнини J/J); и третата група (FD) получи HFD, богата на рибено масло (40% мазнини J/J). Съставът на всички диетични режими е докладван в Таблица Таблица1 1 .
маса 1
Диетичен състав.
| Стандартно подаване | 100 | 51,30 | 51,30 |
| Казеин a g | - | 9.25 | 9.25 |
| Свинска мас g | - | 21.80 | - |
| Рибено масло b g | - | - | 21.80 |
| Слънчогледово олио g | - | 1.24 | 1.24 |
| AIN 76 минерална смес c g | - | 1.46 | 1.46 |
| AIN 76 витаминен микс d g | - | 0,42 | 0,42 |
| Холин битартрат | - | 0,08 | 0,08 |
| Метионин g | - | 0,12 | 0,12 |
| Енергийна плътност kJ/g диета | 15,88 | 20. | 20. |
| Протеин% | 29 | 29 | 29 |
| Липиди% | 10.60 | 40 | 40 |
| Въглехидрати% | 60,40 | 31 | 31 |
a Пречистен казеин с високо съдържание на азот, съдържащ 88% протеин, b Рибено масло = Масло от черен дроб на треска, c Американски институт по хранене (1977), d Американски институт по хранене (1980).
През целия експериментален период телесното тегло и приема на храна се наблюдават ежедневно, за да се изчисли наддаването на телесно тегло и брутният енергиен прием. Разлятата храна се събира и компенсира при пренастройване на изчислението на приема на храна. Брутната енергийна плътност за стандарт или HFD (съответно 15,8 или 20 kJ/g) се определя от бомбен калориметър (Parr адиабатичен калориметър, Parr Istrumentes Co, Moline, IL, САЩ).
Друг набор от CD, LD и FD животни (n = 5 на група) на 6 седмици от лечението се инжектира i.p. с инсулин (хомолог бързодействащ, 10 единици/kg телесно тегло; Novartis, Базел, Швейцария).
В края на експерименталните лечения плъховете се анестезират чрез i.p. инжекция на хлоралхидрат (40 mg/100 g телесно тегло), обезглавена с гилотина и кръвта е взета от долната куха вена. Хипоталамусът бързо се дисектира от мозъка и се прехвърля в подходящия буфер. Всички проби, които не бяха използвани веднага, се съхраняват при -80 ° C.
Параметри на серума
Серумните нива на холестерол, триглицериди, NEFA и глюкоза се измерват със стандартни процедури. Серумните нива на инсулин (Mercodia AB, Упсала, Швеция), TNF-α (Biovendor R&D, Бърно, Чехия), адипонектин и лептин (B-Bridge International Mountain View, Калифорния, САЩ) бяха измерени с помощта на наличните в търговската мрежа комплекти ELISA.
Анализ на липидната пероксидация
За да се определи липидната пероксидация в хипоталамовия хомогенат, нивото на малондиалдехид (MDA) беше измерено с помощта на метода на реакцията на тиобарбитурова киселина (TBAR). MDA реагира с тиобарбитурова киселина (TBA), за да образува розов хромоген, който се открива при дължина на вълната 532. Стойностите на MDA са изразени като наномоли на милиграм мозъчен протеин (Lu et al., 2009).
Редукционен статус и активирани ензимни фактори, свързани с еритроид 2 (Nrf2) Дейности, активирани
Намалените концентрации на глутатион (γ-L-глутамил-L-цистеинил-глицин, GSH) и окислени концентрации на глутатион (γ-глутамил-L-цитенил-глицин дисулфид, GSSG) в хипоталамуса бяха измерени с помощта на дитионитробензоена киселина (DTNB) (Bergamo et al., 2007); съотношението GSH/GSSG се използва като маркер за оксидативен стрес. Ензимните активности на глутатион S-трансфераза (GST) и NAD (P) H-хинон оксидоредуктаза (NQO1) бяха оценени спектрофотометрично в мозъчни цитоплазмени екстракти със стандартни протоколи (Benson et al., 1980; Levine et al., 1990).
Западно петно
Хипоталамусът се хомогенизира в лизисния буфер (10 mM HEPES, 10 mM KCl, 1,5 mM MgCl2, 12% глицерол, 0,5 mM DTT, 0,1 mM EGTA) с коктейл от протеазни инхибитори (Sigma Aldrich). Протеините (20 или 40 μg/лента) се разделят на 12% SDS-PAGE и се прехвърлят в нитроцелулозни мембрани. Петните бяха инкубирани с AMPKα заешко моноклонално антитяло (Cell Signaling Technology; dil 1: 1000), pAMPKα (Thr172) заешко моноклонално антитяло (Cell Signaling Technology; dil 1: 1000), IKK-β заешко моноклонално антитяло (Abcam; dil 1: 500) или α-тубулиново мише антитяло (Sigma Aldrich; dil 1: 1000) за една нощ при 4 ° C и след това с вторично антитяло срещу заешки или миши IgG (Promega; dil 1: 2500) за 1 h при RT. Сигналите са визуализирани с ECL системата (Pierce). Нивото на експресия на α-тубулин е използвано за нормализиране на данните.
Статистически анализ
Статистическите анализи бяха проведени с помощта на SPSS 13.0 (SPSS Inc., Чикаго, IL, САЩ). ANCOVA или еднопосочен ANOVA, последван от post hoc тест на Tukey, е използван за оценка на разликите между групите. Стойностите на P, по-малки от 0,05, се считат за статистически значими.
Декларация за етика
Процедурите, включващи животни и грижата за тях, са проведени в съответствие с международното и националното законодателство и политики (Директива 2010/63/ЕС на ЕС за опити с животни, насоки ARRIVE и декларацията от Базел, включително концепцията 3R). Процедурите, докладвани тук, бяха одобрени от Институционалния комитет по етика на опитите с животни (CSV) на Университета в Неапол Федерико II и от Ministero della Salute .
Резултати
Ефект от диета с високо съдържание на мазнини, обогатена със свинска мас или рибено масло върху наддаването на телесно тегло и приема на енергия
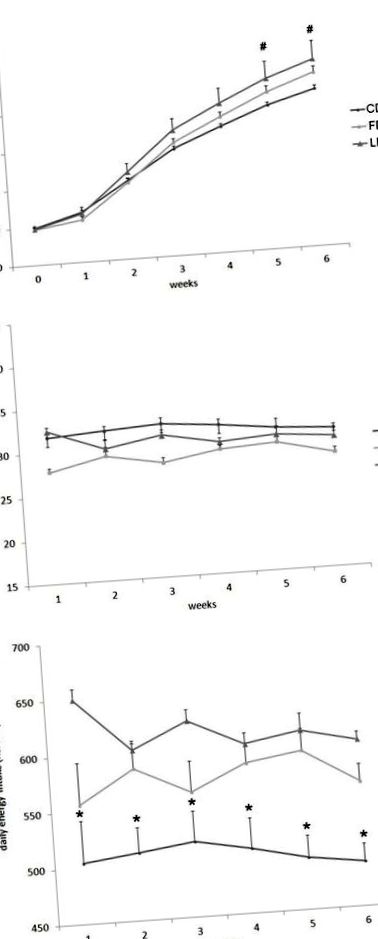
Фигура Фигура1 1 отчита промените в телесното тегло, дневната консумация на храна (g/ден) и енергийния прием при плъхове, хранени с LD или FD, в сравнение с CD на 1-6 седмици лечение. Във всеки момент от време телесното тегло е било по-високо при LD в сравнение с CD, но разликата е била статистически значима само след 5 и 6 седмици лечение (Фигура (Фигура 1А). 1А). От друга страна, трите групи плъхове не показват никаква разлика в дневната консумация на храна (g/диета, Фигура Фигура 1B). 1Б). като има предвид, че енергийният прием (kJ/диета) е бил значително по-висок в LD и FD групите в сравнение с CD групата във всеки момент от времето (Фигура (Фигура 1C 1C).
Ефект на диета с високо съдържание на мазнини, обогатена със свинска мас или рибено масло върху телесното тегло, консумацията на храна и енергийния прием. Телесно тегло (А), консумация на храна (Б) и дневен енергиен прием (° С) по време на 6 седмично лечение с контролна диета (CD), обогатена с рибено масло диета (FD) или диета, обогатена с мас (LD). Стойностите са изразени като Средно ± SEM. # P Фигура2, 2, HFD, обогатен с рибено масло за 6 седмици, увеличава значително базалната гликемия в сравнение с CD (P (Фигура3). 3). За да изследваме ефектите на HFD върху активността на този протеин, ние също анализирахме нивото на експресия на pAMPK (фосфорилираната активна форма на AMPK) и не наблюдавахме никаква разлика между FD и CD групите (Фигура (Фигура 3), 3 ), което показва, че обогатената с рибено масло диета не е променила нивото на експресия на хипоталамуса на AMPK и неговото ниво на активиране. Интересно е обаче, че нивото на експресия на pAMPKα значително се е увеличило в LD групата в сравнение с FD групата (Фигура (Фигура 3 3).
Ефект на диета с високо съдържание на мазнини, обогатена със свинска мас или рибено масло върху хипоталамус IKKβ
За да изследваме молекулярните механизми, залегнали в основата на HFD-зависимото активиране на AMPK, анализирахме нивото на експресия на IKKβ (активатор на NFKB пътя) в хипоталамуса на третираните животни. Не наблюдавахме значителни промени на този медиатор в LD или FD групи в сравнение с CD, което предполага, че механизмът, индуциран от обогатена с LD диета и водещ до активиране на хипоталамусния AMPK е независим от IKKβ (данните не са показани).
Ефект на диета с високо съдържание на мазнини, обогатена със свинска мас или рибено масло върху възпалението и окислителния стрес в хипоталамуса
HFD, обогатен с LD, причинява нарастване на оксидативния стрес в хипоталамуса, както се демонстрира от значителното увеличение на MDA (P (Фигура 4). 4). В допълнение, незначителните разлики в GST и NQO1 дейностите в LD и FD групи в сравнение с CD показват, че Nrf2 пътят не участва в HFD-медиираната модулация на редокс състоянието (данните не са показани).
Ефект на диета с високо съдържание на мазнини, обогатена със свинска мас или рибено масло върху хипоталамусния оксидативен стрес. Хипоталамусни нива на малоновия диалдехид (MDA, A), TNF-a (Б), редуциран глутатион (GSH, ° С) и съотношение редуциран/окислен глутатион (GSH/GSSG, д) при животни, лекувани в продължение на 6 седмици с контролна диета (CD), обогатена с рибено масло диета (FD) или диета, обогатена със свинска мас (LD). Стойностите са изразени като Средно ± SEM. * P (67K, jpeg)
- Ранни ефекти на диетата с високо съдържание на мазнини върху нервно-съдовата функция и фокалната исхемична мозъчна травма американец
- Ефекти от скандинавската хайверна паста, обогатена със стабилно рибено масло върху плазмените фосфолипидни мазнини
- Ефекти от диетата с високо съдържание на мазнини върху увреждане на невроните, глиоза, възпалителен процес и оксидативен стрес при
- Цитрусовото съединение предпазва от ефектите на диетата с високо съдържание на мазнини, съобщава проучване от Корея и Япония
- Консумацията на диета с високо съдържание на мазнини в рибеното масло разделя растежа на затлъстяването и тумора на млечните жлези чрез