Салваторе Москаритоло
1 звено за качество на зърнените култури (CRA-QCE), Съвет за земеделски изследвания и икономически изследвания, Рома 00189, Италия; [email protected]
Лусия Трепиччоне
2 Институт по хранителни науки, CNR, Avellino 83100, Италия; moc.liamg@pertaicul (L.T.); ti.rnc.asi@onirbmottoa (А.О.)
Антонио Остомбрино
2 Институт по хранителни науки, CNR, Avellino 83100, Италия; moc.liamg@pertaicul (L.T.); ti.rnc.asi@onirbmottoa (А.О.)
Мауро Роси
2 Институт по хранителни науки, CNR, Avellino 83100, Италия; moc.liamg@pertaicul (L.T.); ti.rnc.asi@onirbmottoa (А.О.)
Резюме
Целиакия (CD) е имунно-медиирано разстройство, причинено от поглъщането на пшеничен глутен. За облекчаване на симптомите и нормализиране на чревната лигавица е необходима диета без глутен през целия живот. По-рано установихме, че реакцията на трансамидиране чрез микробна трансглутаминаза (mTG) е ефективна при регулиране надолу на специфичния за глиадин имунен отговор при пациенти с CD. В това проучване е приет двустепенният протокол за трансамидация за пилотно третиране на грис от търговски пшеница. Ефективността на ензимната реакция беше тествана с помощта на консолидирани биохимични и имунологични методи върху изолирани проламини. Установихме, че неразтворимият във вода добив на глиадин и глутенин намалява при пшеничен грис съответно до 5,9% ± 0,3% и 11,6% ± 0,1%, след двустепенна реакция на трансамидиране. Използвайки трансгенни мишки DQ8 като модел на чувствителност към глутен, наблюдаваме драстично намаляване на продукцията на IFN-y в клетки на далак, предизвикано in vitro с остатъчния неразтворим глиадин от трансамидиран грис (N = 6; средни стойности: 850 срещу 102; контрола срещу трансамидиран грис, p Ключови думи: цьолиакия, трансамидация, пшеничен грис
1. Въведение
2. Материали и методи
2.1. Качествени характеристики на грис от твърда пшеница
Химичните и технологични характеристики на гриса са извършени чрез стандартни анализи: съдържание на протеин (ICC 105/2 Kieldhal), съдържание на глутен% (ICC 137/1; 155; 158), жълт индекс (Minolta Chrommeter CR-300, CEN стандартен метод 15465 ), алвеографски тест (ICC 121), Braabender Farinograph (ICC 115/1). За тестване е използвана търговска твърда пшеница. Грисът е получен от пилотен мелничен завод (Buhler MLU 202, Uzwil, Швейцария). Данните се посочват като средно за повторни анализи и разликите между повторенията са включени в специфичните граници на всеки метод.
2.2. Реакция на трансамидиране на грис от твърда пшеница
Хранителна микробна трансглутаминаза (mTG) е от Ajinomoto Foods (Хамбург, Германия; ACTIVA ® WM; 81–135 U/g); лизин етилов естер (K-C2H5) е от NutraBio (NutraBio.com, Middlesex, NJ, USA). Грисът се суспендира в два обема вода, съдържащи 8 U/g mTG и 20 mM K-C2H5. Инкубацията се извършва в реакторна инсталация Micro MFCS (BBraun AG, Melsungen, Германия) с номинален капацитет от 16 литра. Реакторната инсталация беше предварително стерилизирана, след което температурата беше намалена при 30 ° С. Първият етап се провежда в продължение на 2 часа при 30 ° С и суспензията се възстановява чрез центрофугиране (1000 х g, 10 минути). След обширно измиване на реактора с чешмяна вода се провежда втори етап на ензима в продължение на 3 часа при 30 ° С с пресен ензим и K-C2H5 при същите концентрации. Суспензията накрая се центрофугира (15 000 × g, 10 минути) и тестото се възстановява.
2.3. Биохимичен анализ на трансамидирането на пшеничен грис
Проба от 20 ml суспензия от грис се центрофугира при 3000 × g за 10 минути. Остатъчните фракции на глиадин и глутенин бяха извлечени от протеиновите пелети, използвайки модифицирана процедура на Osborne [15]. Съдържанието на протеини е оценено чрез анализ на Брадфорд [16].
2.4. Имунологичен анализ на трансамидирането на пшеничен грис
Трансгенни мишки, експресиращи молекулата HLA-DQ8 в отсъствието на ендогенни гени от клас II на мишки [17], бяха отгледани в продължение на няколко поколения на GF диета (Altromin-MT-mod, Rieper SpA, Bolzano, Италия) в условия без патогени в нашата съоръжение за животни (акредитация № 164/99-A). Всички процедури отговарят на указанията на италианското министерство на здравеопазването. Шестседмични мишки бяха грундирани чрез интраперитонеална инжекция с глиадини (300 μg), емулгирани в пълния адювант на Freund (Sigma) (ден 0). Бустери, съдържащи същото количество антиген в непълния адювант на Freund, се инжектират на 7 и 14 ден. Мишките се умъртвяват на 21 ден, за да възстановят далаците си. Слезките се прекарват през телена мрежа от неръждаема стомана, за да се дисоциират клетките. Еритроцитите се отстраняват чрез третиране на клетъчните суспензии с разтвор на амониев хлорид, буфериран с Tris. За всяка проба 5 × 105 клетки се инкубират в 0,2 ml хранителна среда в 96-ямкови плоски дънни плаки при 37 ° С в продължение на 96 h в присъствието на глиадини (200 μg/ml). След 72 часа супернатантите се събират и анализират за нивата на IFN-y протеин чрез вътрешен сандвич ELISA.
2.5. Процедура за производство на паста
Грисът се използва за производство на тестени проби от пилотен завод (Намад - Рим, Италия). Трансамидираното мокро тесто, показващо индекс на хидратация 30%, се хомогенизира в продължение на 5 минути при стайна температура в тестомесителна машина и след това се прехвърля в смесителната камера под вакуум. В следващия етап трансамидираното мокро тесто се пресова до 100 бара през винт (300 mm дълъг и 45 mm диаметър) при 30 ° C. Тестото се оформя в спагети (размер ∅ = 1,30 мм) с помощта на бронзов екструдер. След това тестените изделия бяха изсушени с пилотно съоръжение за сушене на растения (Afrem — Clextral sas, Firminy, Франция), приемайки следния график температура (° C)/относителна влажност (rh): 77 ° C/85% rh, 3 h; 70 ° C/77% rh, 3 h; понижаване от 70 ° C до 35 ° C/70% rh, 1 h; 35 ° C/65% rh, 20 h; изсушените макарони най-накрая се съхраняват при стайна температура при контролирана атмосфера. Качеството на готвене на паста е оценено чрез сензорен анализ съгласно D’Egidio et al. [18]. Резултатите, свързани с аспектите на качеството, бяха изразени като средни стойности на три определяния.
2.6. Статистическа оценка
Статистическата значимост беше определена чрез теста на Крускал-Уолис и анализа на post-hoc теста на Dunn, използвайки софтуера GraphPad PRISM 4.0 (GraphPad Software, Inc., La Jolla, CA, USA). Стойността на р от 0,05 или по-малко се счита за значима.
3. Резултати
3.1. Качествени характеристики на грис и сушени макаронени изделия
Химичните и реологични характеристики са оценени по класически методи: съдържанието на протеин в грис е 12,4% ± 0,1% (d.m.) със съдържание на глутен 10,3% ± 0,1% (d.m. основа); жълтият индекс (b) е бил съответно 17,5 ± 0,1 и 15,7 ± 0,2 за грис и сушени макарони; и реологичните характеристики дадоха резултати от алвеографски тест на W 210 (10 -4 джаула) и p/L 4.5 и фаринограф braabender с абсорбция 55% и стабилност 5.0 минути.
3.2. Пилотно производство на трансамидиран грис
Емпирично определихме, че най-доброто представяне на реактора може да бъде постигнато чрез ензимно третиране на максимум 6,0 kg грис от твърда пшеница в краен обем 13,5 L. Съответно, грисът бавно се суспендира в 10,0 L 20 mM воден разтвор K-C2H5 и суспензията се прехвърля в реактора. ACTIVA ® WM се добавя внимателно при условия на разбъркване. Впоследствие скоростта на смесване беше увеличена и установихме, че са необходими 450 rpm, за да се получи равномерно разпределение на ензима. След центрофугиране, утайката се суспендира в 20 mM K-C2H5 (12.0 L краен обем), за да се извърши втората стъпка. Чрез възприемането на този подход получихме добив от 9,6 кг трансамидирано тесто.
3.3. Анализ на трансамидираните проламини
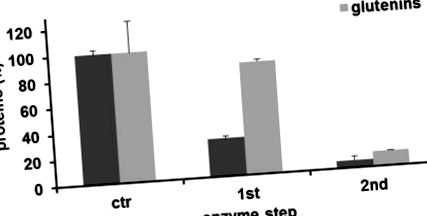
Производството на изопептидни връзки от каталитичната активност на mTG драстично намалява добива на глиадин до 29,3% ± 1,9% и 5,9% ± 0,3% след втория етап (средно ± SD; Фигура 1). Напротив, добивът на глутенини е бил доста засегнат след първия ензимен етап (86,6% ± 1,6%) и той е намалял до 11,6% ± 0,1% след втория етап. След това се фокусирахме върху имунологичните ефекти на глиадини, извлечени от грис, след двустепенен процес на трансамидиране. За да определим възможни модификации в Т-клетъчно-медиирания отговор, използвахме HLA-DQ8 трансгенни мишки, които експресират само човешката молекула MHC клас II, която е свързана с CD [17]. След имунизация с глиадини, клетките на далака бяха възстановени и стимулирани in vitro с различни глиадинови препарати. Имунният отговор се анализира чрез оценка на експресията на IFN-y. Резултатите, показани на фигура 2, показват, че клетките на далака от имунизирани мишки индуцират значителни нива на цитокинов протеин след 72 h култура, когато се стимулират с естествен глиадин. По-специално, когато специфичните за глиадин клетки на далака се стимулират с остатъчен неразтворим глиадин, изолиран от грис, подложен на двустепенно трансамидиране, производството на IFN-γ е драматично блокирано.
Оценка на остатъчните фракции на глиадин и глутенин протеин след реакцията на трансамидиране, пречистени съгласно модифицираната процедура на Осборн. Всяка лента представлява стойности (означава ± SD), изчислени като процент на контрола (необработен грис) от трикратни експерименти.
- Ефекти от диетичното елиминиране на глутен при пациенти с повтарящ се лек афтозен стоматит и не
- Сравняване на ефектите от диетата с ниска енергия и диетата с ниско съдържание на мазнини с високо съдържание на протеини върху сексуалните и ендотелните
- Пухкави пълнозърнести палачинки от хляб от тикви Амбициозна кухня
- Сравняване на изолиран соев протеин с ленено масло срещу изолиран соев протеин с царевично масло и пшеница
- Нововъзникващи иновации за намаляване на съдържанието на сол в сиренето; Ефекти на солта върху вкуса, текстурата и