Резюме
Въпреки съобщенията от 2 десетилетия, документиращи свързаните с хеликобактер стомашно-чревни заболявания при мишки, инфекциите продължават да продължават да съществуват широко не само в академичните институции в САЩ, но и при търговските доставчици в други региони на света. 1, 3, 31, 44 В рамките на академичната обстановка политиките за мониторинг и изключване на здравето се различават значително между университетите и дори в рамките на различни животински съоръжения в една институция. Често тези политики се основават на финансови фактори (разходите за скрининг чрез PCR и ресурсите, необходими за отглеждане на заразени животни), в допълнение към възможността инфекциите с хеликобактер да объркат изследванията.
Опитът за предсказване на общия ефект на инфекцията върху изследванията също може да бъде проблематичен. Развитието и тежестта на стомашно-чревната патология може да варира значително в зависимост от щама на мишката, вида хеликобактер и модела на заболяването. Някои щамове мишки, включително A/JCr, BALB/cAnNCr, C3H/HeNCr и SJL/NCr, са особено податливи и развиват хронично ентерохепатално заболяване със значителна тежест. 19, 21, 30, 49, 50 В допълнение, няколко имунодефицитни щама на мишки развиват тежко заболяване след хронична инфекция. C.B-17/Icr-Prkdc scid (SCID/NCr) мишки, които нямат функционални Т и В клетки, развиват прогресиращ хепатит и пролиферативен тифлоколит след естествена инфекция с H. hepaticus. 30 IL10 -/- мишки като B6.129P2-IL-10 t m1Cgn/J развиват тежък тифлоколит след инфекция с няколко Helicobacter spp. 51, 52 За разлика от имунокомпетентните щамове, имунодефицитните мишки могат да проявят клинични признаци като диария, перианално кървене и ректален пролапс с различна тежест. 18, 29, 51
Видовете Helicobacter влияят върху тежестта на заболяването. Въпреки че H. hepaticus остава най-добре изученият ентерохепатичен вид мишки, други тясно свързани Helicobacter spp. също водят до стомашно-чревни заболявания. 15, 31 Естествената и експериментална моноинфекция с H. typhlonius доведе до тифкололит при мишки C57BL/6J IL-10 -/- и SCID/NCr. 18, 22, 23 инфекцията с H. mastomyrinus доведе до грануломатозен тифлоколит (възпалително заболяване на червата, IBD) при мишки с дефицит на теломераза C57BL/6J по време на решаващи проучвания за ранно стареене. 15 Интересното е, че стомашно-чревното заболяване е значително по-тежко при мишки, заразени с H. mastomyrinus, отколкото при тези, заразени с H. hepaticus. 15
В допълнение, изследователското въздействие на хеликобактерните инфекции варира в зависимост от модела на заболяването в сложна динамика, произтичаща от взаимодействия между стомашно-чревния имунитет на приемника, микрофлората, диетата и условията на околната среда. Моделите на мишки с IBD подчертават тези сложности. Helicobacter spp. Установено е, че инфекцията, а не генетичната модификация, е отговорна за чувствителността и модела на развитие на IBD при мишки с мутантни αβ рецептори на Т-клетки. 6, 10 Умишлено инокулиране е използвано за изследване на свързани с Helicobacter spp.промени в резидентната чревна микрофлора и индукция и тежест на IBD при имунодефицитни мишки. 51
Повторното извличане чрез кръстосано подхранване се използва за елиминиране на ензоотични Helicobacter spp. инфекции. 1, 46 Тази техника е по-евтина и трудоемка и изисква по-малко опит от трансфера на ембриони. 1, 42, 46 Едно проучване, сравняващо 2 кръстосани подхранващи парадигми за елиминиране на Helicobacter spp., Миши норовирус, миши вирус на хепатит и Syphacia obvelata установи, че успехът зависи както от възрастта на кученцата по време на трансфера, така и от промяната на постелките. 1 Кученца, прехвърлени в рамките на 24 часа след раждането от клетки, които са претърпели промени в постелките на всеки 24 часа, са с отрицателен резултат по-често, отколкото малките, прехвърлени в рамките на 48 часа след раждането, от клетки, съдържащи до 7-дневна мръсна постелка. 1 Въпреки това нито една от парадигмите не е била напълно успешна в елиминирането на Helicobacter, както се вижда от последващо PCR тестване на кръстосано насърчавано потомство. 1 Освен това, изолирането на H. hepaticus от вътрешностите на няколко късни стадии на C.B-17/Icr-Prkdc scid (SCID/NCr) ембриони, принадлежащи към заразен язовир, предполага, че е възможно трансплацентарно предаване при имунодефицитни мишки. 30
Въпреки че от десетилетие се предлага по-нова медикаментозна диета, съдържаща амоксицилин, кларитромицин, метронидазол и омепразол, съобщенията за ефикасност все още са доста ограничени. Едно проучване демонстрира успешно ликвидиране на H. hepaticus и H. bilis от колония 129 × 1/SvJ десмин-нул и хетерозиготни мишки след 8 седмици непрекъснато лечение и 19 месеца на PCR последващо тестване. 28 В допълнение, терапията с 4 лекарства беше успешна при елиминирането на Helicobacter spp. от няколко генетично модифицирани щамове на плъхове, при което заразените мъжки плъхове са били лекувани в продължение на 3-двуседмични цикли, а бременните язовири и потомци са били хранени непрекъснато от 7-ия ден на бременността чрез отбиване. 26 Последващи тестове за последващо лечение за 8 месеца чрез фекална PCR потвърдиха, че всички лекувани плъхове остават отрицателни. 26 Съвсем наскоро съобщихме за успешното унищожаване на H. hepaticus, H. bilis и H. rodentium от 2 щама мишки с вродена имунна недостатъчност. 9
Материали и методи
Поколение на заразени с хеликобактер мишки.
Жилище.
Мишките бяха настанени в акредитирано от AAALAC съоръжение в съответствие с Ръководството за грижа и използване на лабораторни животни 25 и процедурите бяха одобрени от Johns Hopkins IACUC (Балтимор, MD). Мишките бяха настанени по двойка с единичен квадрат за гнездене на памук в индивидуално проветриви клетки (Allentown Caging Equipment, Allentown, NJ), сглобени с постелки от царевичен кочан (Harlan Laboratories, Indianapolis, IN) и автоклавирани като единица. Облъчен фураж се добавя към всяка клетка впоследствие в станция за смяна на филтриран въздух (Lab Products, Seaford, DE) с използване на дезинфектант на основата на хлорен диоксид (100 ppm, Vimoba, Quip Laboratories, Wilmington, DE). Всички мишки получиха вода, обработена с обратна осмоза, посредством автоматизирана система за напояване в клетката (Rees Scientific, Trenton, NJ). Промените в клетките се случиха при двуседмичен цикъл в станции за смяна на филтриран въздух (лабораторни продукти) с използване на дезинфектант на основата на хлорен диоксид (100 ppm, Vimoba) и предпазни мерки, които включваха смяна на ръкавици между клетките за предотвратяване на кръстосано замърсяване и разпръскване на дезинфектант обилно върху станцията за смяна, извън клетките и ръцете в ръкавици.
Здравно наблюдение.
Всички изследвани мишки, както и тези, използвани за разплод, бяха наблюдавани чрез използването на замърсени легла, които останаха свободни от вируса на Сендай, вируса на пневмония на мишките, вируса на миши хепатит, миши минутен вирус, парвовируса на мишка 1 и 2, мишката Theiler вирус на енцефаломиелит, реовирус, епизоотична диария на новородени мишки, вирус на лимфоцитен хориоменингит, вирус на ектомелия, миши аденовирус, миши цитомегаловирус, микоплазма пулмонис, акари и острици.
Проучвателни групи.
Хеликобактер-позитивни голи и Rag1 мишки (възраст, 7 седмици) бяха разпределени произволно или към експериментални, или към контролни групи (6 до 8 мъжки мишки и 6 до 8 женски мишки във всяка група), за да получат 8 седмици медикаментозна диета, 8 седмици контрол диета, 8 седмици медикаментозна диета, последвана от 8 седмици контролна диета, 16 седмици медикаментозна диета или 16 седмици контролна диета. Същите експериментални и контролни групи бяха установени за Helicobacter-отрицателни мишки.
Диета и протокол за хранене.
Контролната диета се състоеше от 5 g, облъчена и пълноценна с хранителен състав таблетка с вкус на бекон (продукт № S05072, BioServ, Frenchtown, NJ). Медикаментозната диета е същата диета с добавяне на 3,0 mg амоксицилин, 0,5 mg кларитромицин, 1,0 mg метронидазол и 0,02 mg омепразол към всяка таблетка от 5 g (продукт № S05723, Rodent Helicobacter MD Four-Drug Combo, BioServ). Тъй като диетите, използвани за изследване, се различават от тези, които обикновено се използват в съоръжението, всички мишки се приспособяват към контролната диета, хранена ad libitum от отбиването (21 до 23 дни) до започване на проучването (на възраст 7 седмици).
Записване на телесно тегло.
Теглото на тялото се записва ежеседмично (един и същи ден и час всяка седмица) за всяка мишка в хода на периода на проучване от 8 или 16 седмици.
Груба патология.
Пълни некропсии за оценка на грубата патология бяха извършени на всички мишки след 8- или 16-седмичния период на изследване. Документирани са чернодробни, слепи и общи телесни тегла. Ceca бяха систематично изрязани in situ в илеоцекалната връзка (проксимално) и проксимално дебело черво (дистално) непосредствено при отваряне на коремната кухина, с минимална манипулация на луминалното съдържание преди всяко записване на теглото. Събирането на тъкани за хистопатология е ограничено до черния дроб (представителен участък от левия страничен и среден дял), хранопровода, стомаха и тънките и дебелите черва, тъй като това са тъканите, които са най-вероятно засегнати от инфекция с хеликобактер или прилагане на медикаментозна диета . Всички събрани тъкани бяха фиксирани в 10% буфериран формалин, вградени в парафинови блокове, разделени (дебелина, 5 μm) и оцветени с хематоксилин и еозин за хистопатологично изследване. Допълнителни участъци на хранопровода и стомаха бяха изследвани с помощта на оцветявания по Gram, Gomori methenamine silver и периодични петна от киселина – Schiff.
Хистопатология.
Тестване на хеликобактер.
Статистически анализ.
Статистическите анализи бяха извършени с използване на Prism 6.0 (GraphPad, Сан Диего, Калифорния). Седмичните промени в телесното тегло между групите според състоянието на инфекция (заразени и неинфектирани) и типа на диетата (медикаментозно и немедикаментозно) през периода на изследване от 16 седмици бяха сравнени чрез използване на многократни двупосочни ANOVA, последвани от многократни сравнителни тестове на Tukey. Съотношенията на теглото към телесното тяло между видовете диети (медикаментозни и немедицински) и продължителността на проучването (8 и 16 седмици) бяха сравнени чрез използване на двупосочен ANOVA, последван от множество тестове за сравнение posthoc Tukey. Хистологичните резултати са анализирани с помощта на теста на Kruskal – Wallis за непараметрични данни, последван от теста за множествено сравнение на Dunn. Резултатите от фекални PCR на Helicobacter не са сравнени статистически, тъй като само 100% ерадикация се счита за релевантна. Резултатите от анализите се считат за статистически значими, когато стойността на P е по-малка или равна на 0,05.
Резултати
Клинични здравни наблюдения.
Нито една от изследваните мишки не е показала никакви клинични признаци, свързани с инфекция с хеликобактер или с медикаментозно диетично лечение. Лек ректален пролапс се наблюдава при 1 от 8 незаразени мъжки голи мишки, хранени с 8 седмици медикаментозна диета. Нито една от другите мишки, евтаназирани нито в 8-, нито в 16-седмичен период, не е показала никакви доказателства за ректален пролапс.
Телесно тегло.
Голи мишки.
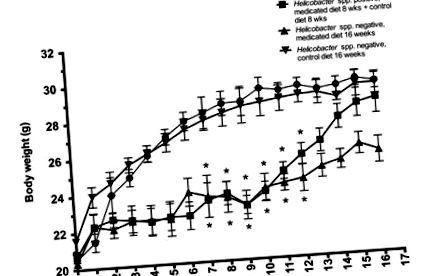
Статистическите анализи бяха проведени отделно за мъжки и женски мишки. Тъй като тенденциите в теглото не се различават статистически, средното телесно тегло и стандартните отклонения, отчетени на фигура 1, отразяват двата пола, взети заедно. Независимо от първоначалния статус на инфекция, мъжките и женските голи мишки на медикаментозна диета тежат значително (P Фигура 1). Впоследствие всички мишки са хранени с 8 седмици контролна диета, нормализирана в тегло в сравнение с техните немедицински контроли до седмица 11 (Фигура 1). Всички групи, които са продължили медикаментозна диета за допълнителни 8 седмици (общо 16 седмици при медикаментозна диета) остават значително (P ≤ 0,02) по-леки от тези на контролна диета за периода на проучването (Фигура 1).
Медикаментозната диета значително (*, P Фигура 2 отразява комбинираните два пола. Независимо от първоначалния статус на инфекция, мишките Rag1, хранени с медикаментозна диета, претеглят значително (мъжки мишки, P Фигура 2). Всички мишки впоследствие са хранени с 8 седмици контролна диета, нормализирана в тегло в сравнение с техните немедицински контроли до седмица 13. Всички групи, които са продължили медикаментозна диета за допълнителни 8 седмици (общо 16 седмици на медикаментозна диета) остават значително (P ≤ 0,02) по-леки от тези на контролна диета за продължителността на проучването (Фигура 2).
Медикаментозната диета значително намалява наддаването на тегло при всички Rag1 мишки до седмица 7 от 8-седмичното лечение. *, Значително (P Фигура 3 отразява комбинираните два пола. Независимо от първоначалния статус на инфекция, мишките, евтаназирани директно след 8 или 16 седмици медикаментозна диета, са имали значително (P Фигура 3). Повишените съотношения не се различават между групите, хранени с 8 или 16 седмици на медикаментозна диета. Нормални съотношения на цекум към телесно тегло се наблюдават при мишки, хранени с 8 или 16 седмици контролна диета и тези, хранени с 8 седмици медикаментозна диета, последвани от 8 седмици контролна диета. Мишки Rag1.
Съотношенията на цекума: телесното тегло на голи мишки, хранени с медикаментозна диета за 8 или 16 седмици, са били значително (P Фигура 4 отразява двата пола, взети заедно. Констатациите от цекума към телесно тегло при мъжки мишки Rag1 са в съответствие с тези, съобщени както за мъже, така и за женски голи мишки (P Фигура 4 B). За разлика от голи мишки и Rag1 мъжки мишки, Rag1 женски мишки, хранени с 8 седмици медикаментозна диета, последвани от 8 седмици контролна диета, все още са имали значително (P Фигура 4 A). Повишените съотношения не се различават статистически се различават между женските мишки, хранени с 8 или 16 седмици медикаментозна диета и тези, хранени с 8 седмици медикаментозна диета, последвани от 8 седмици контролна диета.
Съотношенията на цекума: телесното тегло на Rag1 мишки, хранени с медикаментозна диета за 8 или 16 седмици, са били значително (P Фигура 5). Чернодробният, жлъчният мехур, хранопровода, стомаха, тънките черва и останалите сегменти на дебелото черво изглеждат напълно нормални при всички мишки, подложени на некропсия. Чернодробните тегла не се различават значително между никоя от експерименталните или контролните групи на двата щама.
Значителен (P Фигура 6 Б). Не е установена значителна разлика между групите, лекувани за 8 в сравнение с 16 седмици. Групи, които са получавали медикаментозна диета за 8 седмици, последвана от контролна диета за 8 седмици, показват лека до умерена езофагеална хиперкератоза (резултат, по-голям или равен на 1,5 до 2,5), което е значително (P Фигура 6 A). Специални петна (Gram, Gomori methenamine silver и периодична киселина – Schiff) на хранопровода и стомаха от медикаментозната диета и контролните групи не показват наличие на организми. Състоянието на инфекция, щам и секс не оказват влияние върху хистологичните находки. Цеца от медикаментозни мишки бяха хистологично нормални, въпреки че бяха значително увеличени при груб преглед. Всички останали участъци от стомашно-чревния тракт и черния дроб също са хистологично незабележими.
(А) Хистологичен външен вид на нормален хранопровод на голи и Rag1 мишки, хранени с контролна диета. (Б) Тежка хиперкератоза (*) на лигавицата на хранопровода, установена при всички мишки, хранени с 8 или 16 седмици медикаментозна диета. Тежестта не се различава между 8- и 16-седмичните медикаментозни групи. Оцветяване от хематоксилин и еозин; бар, 50 µm.
Дискусия
Алтернативните хипотези за намалено наддаване на тегло са по-сложни, но могат да включват взаимодействия между чревната микросреда, енергийния баланс, генната експресия и имунната функция. Антибиотиците имат потенциал да нарушат биологичните процеси и да намалят цялостното здраве. 8 Промените в телесното тегло и състава след приложението на антибиотици са били интересни както за животните, така и за хората. 5, 7 Въпреки че включването на ниски дози антибиотици във фуражите за добитък като стратегия за стимулиране на растежа все още е често срещана практика в Съединените щати, подобни протоколи за субтерапевтично антибиотично лечение при мишки не са успели да възпроизведат напълно това явление. 7 Ранни изследвания, използващи швейцарски мишки за изследване на ефекта на антибиотиците и диетичните формулировки върху микрофлората 11, 13, 14, 39, документират намалено наддаване на тегло след приложение на антибиотик, 12 но има дълбоки промени в диетата на гризачите, генетиката и състоянието на инфекцията в лаборатория мишки, тъй като тези предишни проучвания бяха публикувани, което затруднява директните сравнения с настоящите проучвания.
Това проучване демонстрира успешното унищожаване на H. hepaticus и H. typhlonius от млади голи и Rag1 мишки след 8 седмици лечение с медикаментозна диета, съдържаща амоксицилин, кларитромицин, метронидазол и омепразол. Последствията от лечението включват намаляване на скоростта на растеж, гастроезофагеална хиперкератоза и разширение на цекулата, но тези промени са до голяма степен отменени след връщане към нормалната диета. Този резултат предполага потенциално приложение за широко диетично лечение за елиминиране на хеликобактерни инфекции от мишки с адаптивна имунна недостатъчност.
Благодарности
Това проучване беше подкрепено от NIH Training Grant NIH R25OD010913, а допълнителна подкрепа беше предоставена от д-р Робърт Джей Адамс и Джон Хопкинс Research Animal Resources. Изразяваме своята благодарност към всички онези, които помогнаха за управлението на колонии, събирането и обработката на проби. Благодарим на д-р Karen M Froberg-Fejko (BioServ, Frenchtown, NJ) за дарението на диетите за лечение и контрол. Този проект не е повлиян от BioServ или някой от неговите членове, освен от спазването на препоръките на производителя за продължителността на лечението.
- Ефекти от 7 дни върху ad libitum веганска диета с ниско съдържание на мазнини Кохорта Nutrition на програмата McDougall
- Може ли сокът от грейпфрут да ограничи ефектите от диета с високо съдържание на мазнини
- Ефекти от кетогенната диета при жени с наднормено тегло със синдром на поликистозните яйчници Journal of
- Ефекти от диетата върху липопротеиновия холестерол с висока плътност - PubMed
- Ефекти от диетичните промени върху метаболизма - изглед в пълен текст