MK Parr
1 Институт по фармацевтична и медицинска химия, Катедра по биология, химия, фармация, Freie Universität Берлин, Германия
F Ботре
2 Laboratorio Antidoping, Federazione Medico Sportiva Italiana, Рим, Италия
A Naß
1 Институт по фармацевтична и медицинска химия, Катедра по биология, химия, фармация, Freie Universität Берлин, Германия
J Hengevoss
3 Катедра по клетъчна и молекулярна спортна медицина, Институт за сърдечно-съдови изследвания и спортна медицина, Немски спортен университет, Кьолн, Германия
P Diel
3 Катедра по клетъчна и молекулярна спортна медицина, Институт за сърдечно-съдови изследвания и спортна медицина, Немски спортен университет, Кьолн, Германия
G Wolber
1 Институт по фармацевтична и медицинска химия, Катедра по биология, химия, фармация, Freie Universität Берлин, Германия
Резюме
Все повече хранителни добавки с екдистероиди се предлагат на пазара като „естествени анаболни агенти“. Резултати от скорошни проучвания показват, че техният анаболен ефект се медиира от свързването на естрогенните рецептори (ER). В рамките на това проучване анаболната сила на екдистерона беше сравнена с добре характеризираните анаболни вещества. Ефектите върху размерите на влакната на мускула на солеуса при плъхове, както и диаметърът на получените от C2C12 миотръби се използват като биологични показания. Екдистеронът проявява силен хипертрофичен ефект върху размера на влакната на плъховия мускул, който е установен още по-силен в сравнение с тестваните съединения метандиенон (дианабол), естрадиендион (тренболокс) и SARM S 1, всички прилагани в същата доза (5 mg/kg телесно тегло, за 21 дни). В миотръбите C2C12 екдистеронът (1 µM) индуцира значително увеличение на диаметъра, сравним с дихидротестостерона (1 µM) и IGF 1 (1.3 nM). Експериментите с молекулярно докинг поддържат ERβ медиираното действие на екдистерона. За да се изясни статутът му в спорта, екдистеронът трябва да се счита за включен в класа „S1.2 Други анаболни агенти“ от списъка на забранените вещества на Световната антидопингова агенция.
ВЪВЕДЕНИЕ
Екдистероидите са широко предлагани на пазара за спортисти като хранителна добавка, реклама за увеличаване на силата и мускулната маса по време на тренировка за съпротива, за намаляване на умората и за облекчаване на възстановяването. Няколко проучвания съобщават за широк спектър от фармакологични ефекти на екдистероидите при бозайници, повечето от които са полезни за организма. През 80-те години се подозира, че най-активният фитоекстистероид, екдистерон (бета-екдизон, „руска тайна“), се използва от руските олимпийски спортисти. Нивата на екдистероиди в западната диета обикновено са ниски (обикновено в диапазона по-малко от 1 mg на ден -1), докато дозите, използвани от културистите, са посочени в диапазон до 1000 mg на ден -1 .
Съобщава се за обширни разследвания на възможните ефекти за стимулиране на растежа на екдистерона при различни животински видове (плъхове, мишки, японски пъдпъдъци и говеда) и при хора [1–13] и оттогава се разпространяват много слухове за злоупотребата му от спортисти. Доказано е, че екдистеронът увеличава синтеза на протеини в скелетните мускули [14]. Gorelick и сътр. предложена директна или индиректна стимулация на сигналния път PI3K/Akt като механизъм за този увеличен синтез на протеини [9, 15].
Обратно на анаболно-андрогенните стероиди (AAS), които увеличават мускулната маса главно чрез свързването им с андрогенния рецептор (AR), досега при бозайниците не е описан ядрен рецептор, който да е хомологичен на екдизоновия ядрен рецептор, открит в насекомите [9] . Съвсем наскоро свързването на екдистерон с човешкия ERβ (ED50 = 13 nM) може да бъде показано в експерименти с клетъчни култури и индуцирането на хипертрофия в клетките на C2C12 е опосредствано от ERβ активирането [2]. Целта на това проучване е да изясни анаболната сила на екдистерона в сравнение с други известни анаболни агенти и да подкрепи хипотезата за ERβ медиирано действие чрез in-silico моделиране.
МАТЕРИАЛИ И МЕТОДИ
Модел за хипертрофия In-Vitro
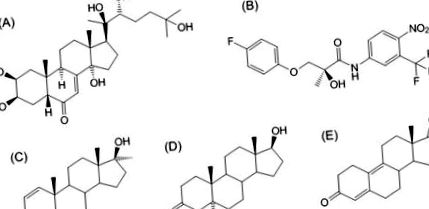
Анаболните свойства на екдистерона бяха тествани чрез инкубация на миотръби, получени от C2C12, с тестваните съединения и определяне на диаметри от 47 миотръби на група (средни стойности на измервания на всеки 10-20 µm по миотръбата), както е описано по-горе [2]. Концентрациите, приложени в това проучване, са 1 µM за екдистерон и дихидротестостерон (химични структури на фигура 1) и 1,3 nM за растежен фактор IGF-1.
Химична структура на екдистерон (A), както и на други анаболни агенти, използвани за сравнение (B: селективен андрогенен рецепторен модулатор (SARM) S-1, C: анаболен андрогенен стероид (AAS) метандиенон, D: AAS дихидротестостерон, E: AAS estradienedione)
Проучване върху животни
Мъжки плъхове Wistar (n = 42, Janvier, Le-Genest St-Isle, Франция) бяха разпределени на случаен принцип във verum и контролни групи. Животните бяха държани при контролирани условия (T = 20 ± 1 ° C, относителна влажност Φ = 50–80%, 12 часа светлина/12 часа тъмнина) със свободен достъп до стандартна диета (SSniff GmbH, Soest, Германия) и вода. За да се имитира ситуацията при спортисти, непокътнатите (т.е. некастрирани) животни се третират с 5 mg · kg -1 телесно тегло от съответното вещество веднъж дневно в продължение на 21 дни. Групите Verum получават инжекции на екдистерон, метандиенон, естрадиендион или S-1, всяка от които се разрежда в разтвор от 20% DMSO и 80% фъстъчено масло. Контролните групи се инжектират само с носител. С животните се работи в съответствие с приетата ветеринарномедицинска практика и с одобрението на Комитета за хуманно отношение към животните. Допълнителни експериментални подробности бяха извършени, както е описано по-рано [2].
Анаболната сила на екдистерона се определя като се използва размерът на мускулните влакна на мускула на солеуса при мъжки плъхове Wistar като мярка. Ефектът е сравнен с анаболните андрогенни стероиди метандиенон (дианабол) и естрадиендион (тренболокс), както и селективния модулатор на андрогенните рецептори S-1 (химични структури на фигура 1).
In-silico моделиране на свързване на стероидни рецептори
Проведени са експерименти с молекулярно моделиране в подкрепа на данните, че анаболният ефект на екдистерона се медиира от ERβ свързване, а не от AR, както е известно за класическите анаболни андрогенни стероиди. По този начин екдистеронът е докиран в кристални структури на двата подтипа ERα и ERβ, както и AR (PDB записи 3UUD [16] за ERα, 3OLL [17] за ERβ и 2AM9 за AR [18], съответно). Тези кристални структури представляват комплекси с естрадиол за ER и тестостерон за AR, за да се уверят, че представляват протеиновата конформация, важна за агонизма. Експериментът с докинг е извършен с помощта на софтуера GOLD [19], позволяващ гъвкавост на страничната верига в свързващите области, за да позволи адаптиране към значително по-големия лиганд екдистерон. Свързващите пози бяха анализирани за ключови характеристики на взаимодействие с помощта на платформата за 3D фармакофорно моделиране LigandScout [20, 21].
Статистика
Оценката на статистическите данни беше извършена чрез тест на Kruskal – Wallis, последван от двойно сравнение с U-теста на Mann-Whitney. Графиките на кутии и мустаци на Фигура 2 и Фигура 3 представляват минимум, 25-ти, 50-ти (медиана), 75-и персентил и максимум на разпределението. Нивото на значимост е установено при p ≤ 0,05.
Ефекти на DHT (10 -6 M), IGF-1 (10 ng · mL -1) и екдистерон (Ecdy, 10 -6 M) върху диаметъра на миотръбите C2C12. Определяне на диаметри от 47 миотръби на група.
Няма значителни разлики в рамките на лечебните групи, * значими спрямо контрола, p ≤ 0,05 от H-тест на Kruskal – Wallis и U-тест на Mann-Whitney
Анаболен ефект на екдистерон (Ecdy), изразен като размер на влакната на солес мускула при непокътнати плъхове.
Значително по-голямо увеличение на размера на влакната на мускула на солеуса след Ecdy в сравнение с естрадиендион (EDD), метандиенон (MD) и SARM S 1 (S1), * значително спрямо контрола, + значително спрямо Ecdy, p ≤ 0,05 от H-тест на Kruskal – Wallis и U-тест на Mann-Whitney
РЕЗУЛТАТИ
Определяне на анаболните свойства
Получените от C2C12 миотръби се използват като in vitro модел за тестване на анаболни дейности. Инкубацията с екдистерон показва значително увеличен диаметър на миотръбите в сравнение с контролните клетки, третирани с носител (Фигура 2). Сравнявайки ефекта с ендогенния анаболен андрогенен стероид дихидротестостерон при същата концентрация и анаболния растежен фактор IGF-1 (концентрация за сравнение е 1,3 nM) се наблюдава малко по-висок (не статистически значим) ефект.
За да се имитира ситуацията при спортисти, непокътнати мъжки плъхове Wistar са били третирани с тестовите компоненти в продължение на 21 дни. След лечението с екдистерон се определят значително увеличени размери на влакната на мускула на солеуса. Сравнението с животните, лекувани с анаболните андрогенни стероиди метандиенон или естрадиендион и SARM S-1, дава значително по-висок ефект при третирани с екдистерон животни, когато се прилагат същите дози (Фигура 3).
In-silico изследване на свързването на стероидни рецептори
За да се подчертае правдоподобността на предложения ERβ медииран анаболен механизъм, бяха проведени експерименти за молекулно докиране на екдистерон в човешките полови стероидни рецептори, за да се получат механистични прозрения в свързването на екдистерон.
В сравнение с рентгеновата структура на AR/тестостероновия комплекс, in silico молекулярното докиране на екдистерон в AR разкрива неблагоприятна свързваща поза и напълно различна триизмерна ориентация в AR/екдистероновия комплекс: На тези позиции, където са метиловите групи намерено за ендогенния лиганд тестостерон, хидроксилните групи стерично пречат на рецептора в случай на екдистерон. В допълнение, водна молекула, медиираща важно взаимодействие в тестостероновия комплекс, се заменя с метилова група за дозата на екдистерона, което води до неблагоприятен модел на взаимодействие.
За разлика от това, двете ER изоформи предлагат свързваща странична форма, по-подходяща за настаняване на екдистерон. Докинг позите и в двата подтипа споделят няколко взаимодействия, показани на Фигура 4. Три допълнителни водородни връзки се образуват изключително в докинг позата на екдистерон в ERβ, което може да обясни експериментално наблюдаваното предпочитание на изоформа [2, 22]: В ERβ лигандът може да адаптира конформация, достатъчно близка до Met343 и да образува водородна връзка с хидроксила група в позиция 2 на екдистерон. Освен това могат да се наблюдават още две водородни връзки с крайната хидроксилна група към гръбнака на β-подтипа (съответно Leu346, Phe404 и Leu387).
ERα (PDB 3UUD [16], отгоре) и ERβ (PDB 3OLL [17], отдолу) с инцидентен докиран екдистерон.
ERβ образува допълнителни водородни връзки с Met343 към хидроксилна група на екдистерон и с протеиновия скелет към крайната алкихидроксилна група. Стрелките показват водородни връзки (зелено: донор, червено: акцептор), докато жълтите сфери показват хидрофобни взаимодействия. Номерирането на остатъците е избрано в съответствие с използваните PDB записи.
ДИСКУСИЯ
Данните, представени тук, показват, че екдистеронът предизвиква хипертрофия на мускулите със сравнима или дори по-висока сила, както е показано за анаболни андрогенни стероиди, SARMs или IGF-1. Аналогични находки са докладвани и от Syrov et al. [14]. Те съобщават за увеличено наддаване на телесно тегло и тегло, както и за повишено съдържание на протеин в мускула на пищяла при плъхове след приложение на екдистерон (5 mg · kg -1 тегло, перорално, в продължение на 10 дни).
Генерираните докинг пози подкрепят хипотезата, че екдистеронът не показва значително свързване при AR, а към ER с предпочитание към ERβ подтипа.
ЗАКЛЮЧЕНИЯ
Анаболната активност на екдистерона беше ясно потвърдена от нашето разследване. Анаболната сила на екдистерона е сравнима или дори по-висока, както е установено за анаболните андрогенни стероиди, SARMs или IGF-1. Освен това експериментите за докинг в силико поддържат постулирания неандрогенен механизъм на екдистерон. По-вероятно и в съгласие с експерименталните данни анаболната активност на екдистерона се медиира чрез свързване с ER, особено ER бета. По отношение на превенцията на допинга, високата анаболна сила на екдистерона оправдава класификацията му като анаболен агент и следователно трябва да бъде включен в категорията „S1 анаболни агенти“ в списъка на забранените вещества на Световната антидопингова агенция
Конфликт на интереси
Авторите не декларират конфликт на интереси по отношение на публикуването на този ръкопис.
- ECDYSTEROIDS Потребителски оценки за ефективност, странични ефекти, безопасност и взаимодействия - WebMD
- Осемгодишната принцеса Феникс Reborn Глава 698 Английски дебат - MTL роман
- Готвач AJ; s Ultimate програма за отслабване на живо; В клас на хора; Представено от Тами Крамер
- Преглед на класа на Equinox Tabata
- Изпит 5 Протезиране PartFoot, Bilat, HighLE, UE ReadingGuide и Class дискусия Flashcards от