Сяо-Вей Дзян
1 магистърска програма за традиционна китайска ветеринарна медицина, Китайски медицински университет, Тайчунг 40402, Тайван
И-Уен Лин
2 Завършил Институт по акупунктурни науки, Колеж по китайска медицина, Китайски медицински университет, Тайчунг 40402, Тайван
3 Китайски изследователски център по медицина, Китайски медицински университет, Тайчунг 40402, Тайван
Ching-Liang Hsieh
2 Завършил Институт по акупунктурни науки, Колеж по китайска медицина, Китайски медицински университет, Тайчунг 40402, Тайван
3 Китайски изследователски център по медицина, Китайски медицински университет, Тайчунг 40402, Тайван
4 Завършил Институт по интегрирана медицина, Колеж по китайска медицина, Китайски медицински университет, Тайчунг 40402, Тайван
5 Катедра по китайска медицина, Китайска медицинска университетска болница, Тайчунг 40447, Тайван
Резюме
1. Въведение
Аденозинът се освобождава от пресинаптичните терминали, за да свърже постсинаптичните А1, А2А, А2В и А3 рецептори за сърдечно-съдови, имунни и нервни функции [6, 7]. Аденозин А1 рецепторът (A1R) се намира главно в периферните сензорни терминали [8], SC [9] и глиалните клетки [10, 11]. Активирането на A1R произвежда аналгетичен ефект при възпалителни и невропатични модели на болка [12, 13]. Съобщава се, че A1R активира Gi протеин и инхибира цикличния път на аденозин монофосфат-протеин киназа А [14]. Инжектирането на аденозин може надеждно да отслаби алодинията и хипералгезията при много симптоми на болка [7, 15]. Въпреки това, няколко странични ефекти са резултат от активиране на аденозин А2 рецептор (A2R). Той може да предизвика вазодилатация, намален сърдечен ритъм и тежки сърдечно-съдови пречки.
GABA рецепторите са основните инхибиторни невротрансмитери в централната нервна система на бозайниците. GABA рецепторите могат да бъдат допълнително подразделени на GABAA, GABAB и GABAC. GABAA е йонен канал, който медиира бързото инхибиторно синаптично предаване и индуцира приток на хлорид, което води до стабилност на невронната мембрана. Няколко фактора могат да активират GABAA за намаляване на невронната възбудимост и те често се използват за анестезия и управление на болката. Инжектирането на GABA агонисти се счита за най-ефективният метод за намаляване на сигнализирането за болка [16, 17]. При невропатична болка GABAergic интернейроните инициират апоптоза по пътя на каспаза-3 [18]. Освен това, след нараняване на нервите, GABA и глутамат декарбоксилазата 65 са докладвани за по-ниски [19, 20].
Преходният рецепторен потенциал (TRP) е неселективен йонен канал, който може да се активира след нараняване на тъканите [21]. Преходен потенциален катионен канал на подсемейство V член 1 (TRPV1) съществува в ноцицепторите и дорзалния рог на SC за сигнализиране за болка [22, 23]. TRPV1 може да се активира от капсаицин, вредна топлина (над 43 ° C) и механично усещане [24-26]. TRPV1 е силно експресиран в малки неврони на дорзален корен ганглий (DRG) от C-влакна и тригеминални и нодозни ганглии [27]. Активирането на TRPV1 индуцира приток на натрий и калций за невронална деполяризация [28, 29]. Изчерпването на гена TRPV1 води до нечувствителност към вредна топлина, радиална топлина и тестове с котлони [30]. Индуцираната от възпалителен материал термична хипералгезия е отслабена при TRPV1 нокаутиращи мишки, което предполага решаващата роля на TRPV1 в усещането за термична болка [31].
TRPV4 е полимодален рецептор, който действа като осмотичен, механичен и термичен рецептор [32]. Активирането на TRPV4 освобождава свързания с калцитонин ген пептид и вещество Р в дорзалния рог на SC [33]. TRPV4 е широко експресиран в космените клетки, бъбреците, белите дробове и периферните сензорни ганглии [34]. TRPV4, експресиран в хетероложни системи, обикновено се активира от осмотични стимули, което води до подуване на клетките [35]. TRPV4 може също да участва в намаляването на висцералната болка [32]. Коекспресията на TRPV1 и TRPV4 може да играе синергична роля в ноцицепцията [36].
Невропатичната болка от операция може да увреди c- и Aδ влакна, за да увеличи освобождаването на глутамат. Глутаматът е основен възбуждащ невротрансмитер в централната нервна система на бозайниците, който се освобождава от пресинаптичните терминали за свързване с четири рецепторни подтипа: α-амино-3-хидрокси-5-метил-4-изоксазолпропионова киселина, NMDA, KA и метаботропен глутаматен рецептор (mGluR) [37]. Показано е, че mGluR участва в невропатична болка [38].
Акупунктурата се използва за лечение на болести от хилядолетия. Все повече доказателства предполагат, че електроакупунктурата (ЕА) може да се използва за лечение на учене и увреждане на паметта при плъхове с исхемия [39], епилепсия [40], контрол на телесното тегло [41] и болка [42, 43]. Съответно, целта на настоящото проучване е да се установи дали EA, прилагана в акупунктурите на Hua Tuo Jia Ji, може да намали невропатичната болка, причинена от хронична констрикция (CCI-) при модели на плъхове. По-нататък проучихме дали A1R, GABAA, TRPV1, TRPV4 и mGluR3 участват в аналгетичния ефект на EA чрез оценка на нивата на DRG, SC и соматосензорна кора (SSC).
2. Материали и методи
2.1. Животни
2.2. EA Лечение
EA се прилага на 7, 8 и 9 ден, като се използват игли от неръждаема стомана (0,5 ′ ′, 32 G, Yu-Kuang, Тайван), поставени в акупунктурите на Hua Tuo Jia Ji на дълбочина 2-3 mm, на 5 mm от гръбначния стълб при L4 и L6. ЕА се прилага за 20 минути веднага след невропатичната инжекция. Стимулатор (Trio 300, Ito, Япония) доставя квадратни импулси от 100 μs от 2 mA за 15 минути при 2 или 15 Hz. За контролната група на фалшиви, ние само поставихме иглата и свързахме животните към стимулатора без токов вход.
2.3. Поведение на животните
Тестът на von Frey е приет за изследване на механичната хипералгезия (IITC; Life Science Inc., САЩ). Плъховете се поставят върху метална мрежа и се стимулират чрез прилагане на тънка нишка на задната лапа. Силите се записват автоматично, когато плъховете изтеглят дясната си задна лапа. Тестът със студена плоча се използва за оценка на термична хипералгезия, по време на която плъховете се поставят върху апарат със студена плоча (Panlab, Испания), с температура 4 ° C. Общият брой вдигания на краката е преброен (дясна задна лапа) за 5 минути. По време на експериментите и анализите лабораторните служители са слепи за разпределението на лечението.
2.4. Анализ на Western Blot
DRG, SC и SSC на плъхове бяха незабавно изрязани на ден 9 след тест за поведение за екстракция на протеин. Следвахме методите на Liao et al. 2016 г. [40]. Общият протеин се приготвя чрез хомогенизиране на хипокампи за 1 h при 4 ° C в лизисен буфер, съдържащ 20 mmol/L имидазол-HCl (pH 6.8), 100 mmol/L KCl, 2 mmol/L MgCl2, 20 mmol/L етилен гликол тетраоцетна киселина (pH 7,0), 300 mmol/L захароза, 1 mmol/L NaF, 1 mmol/L натриев ванадат, 1 mmol/L натриев молибдат, 0,2% Triton X-100 и коктейл с протеиназен инхибитор. От всяка проба се екстрахират 30 μg протеин и се анализират чрез анализ на протеин на бицинхонинова киселина. Екстрахираният протеин се подлага на 10% -15% натриев додецил сулфат-Трис-глицин гел електрофореза и се прехвърля върху нитроцелулозна мембрана. Мембраната се блокира с 5% обезмаслено мляко в TBST буфер (10 mmol/L буфериран физиологичен разтвор, pH 7.5; 100 mmol/L NaCl; и 0.1% Tween 20) и се инкубира през нощта при 4 ° C с анти-GABAA антитяло (1: 1000, Аломон, Израел), анти-A1R антитяло (1: 1000, Аломон), анти-TRPV1 (1: 1000, Аломон), анти-TRPV4 антитяло (1: 1000, Аломон) и анти-GluR3 антитяло (1: 1000, аломон) в TBST, съдържащо говежди серумен албумин. Като вторично антитяло се използва конюгирано с пероксидаза антитяло (1: 500). Мембраната беше оценена с помощта на ECL-Plus комплект за откриване на протеин.
2.5. Статистически анализ
Всички данни са представени като средна стойност ± стандартна грешка. Статистически значимите разлики между фалшивите, 2-Hz EA и 15-Hz EA групи бяха анализирани чрез еднопосочен дисперсионен анализ, последван от post hoc тест на Tukey. Стойността на р по-малка от 0,05 се счита за статистически значима.
3. Резултати
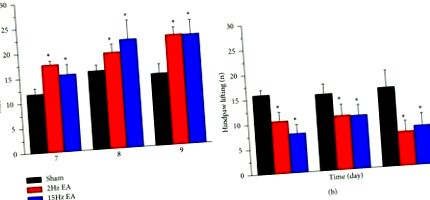
За първи път използвахме теста на von Frey, за да осигурим индуцирането на индуцирана от CCI механична хипералгезия. Нашите данни показват, че CCI е инициирала механична хипералгезия от ден 7 до ден 9 след индукция в фалшивата група (Фигура 1 (а); 11,77 ± 1,16 g, 15,76 ± 1,15 g, 14,4 ± 1,92 g, съответно). След това открихме, че 2-Hz EA групата има значително по-ниска механична хипералгезия от фалшивата група (Фигура 1 (а); 17,53 ± 0,79 g, 19,21 ± 1,69 g, 21,98 ± 1,47 g, съответно). Подобни резултати са наблюдавани и в 15-Hz EA група (Фигура 1 (а); 15,39 ± 2,04 g, 21,63 ± 3,86 g, 21,84 ± 2,89 g, съответно). След това извършихме теста със студена плоча, за да определим дали термичната хипералгезия участва в инициираната от CCI невропатична болка. Нашите резултати показват, че CCI надеждно индуцира термична хипералгезия от ден 7 до ден 9 в фалшивата група (Фигура 1 (b); брой повдигания на задните лапи: съответно 15,83 ± 1,05, 15,33 ± 2,01, 15,83 ± 3,44). И в 2-Hz група (Фигура 1 (b); 10,4 ± 1,9, 10,8 ± 2,28, 6,8 ± 2,13) и в 15-Hz група (Фигура 1 (b); 7,8 ± 1,85, 10,6 ± 2,18, 7,8 ± 2,48), EA успешно атенюира термичната хипералгезия. Съответно предлагаме 2- и 15-Hz EA да могат надеждно да отслабят както механичната, така и термичната хипералгезия.
Прагове на изтегляне и повдигане на задната лапа на плъхове в бутафорните (n = 6), 2-Hz EA (n = 6) и 15-Hz EA (n = 6) групи (N = 18) след индукция на CCI в дни 7 до 9. (а) Механични сили на невропатични болкови плъхове в дни 7 (7), 8 (8) и 9 (9). (б) Повдигане на задната лапа на невропатични болкови плъхове на 7 (7), 8 (8) и 9 (9) ден. ∗ p Фигура 2 (а); 100,01% ± 17,97%, 94,44% ± 25,91% и 90,17% ± 14,62%, съответно; р> 0,05, п = 6). След това проверихме ефекта на аналгетичния A1R върху периферните DRG неврони. Установихме, че няма разлика между бутафорните, 2-Hz EA и 15-Hz EA групи (Фигура 2 (b); 100,01% ± 7,6%, 86,01% ± 16,43% и 93,51% ± 10,61%, съответно; р> 0,05, п = 6). Феноменът е наблюдаван и за TRPV1 (Фигура 2 (в); 100.01% ± 11.15%, 94.61% ± 16.50% и 96.81% ± 11.53%; p> 0.05, n = 6), TRPV4 (Фигура 2 (d); 100,01% ± 8,66%, 89,68% ± 8,41% и 99,81% ± 10,95%; p> 0,05, n = 6) и mGluR3 (Фигура 2 (д); 100,04% ± 28,14%, 101,16% ± 19,23% и 137,52% ± 45,89%; p> 0,05, n = 6) експресия в DRG на плъх.
- Електроакупунктура в акупунктурите на Hua Tuo Jia Ji Намалява невропатичната болка и увеличава GABAA
- Първи кардио упражнения; дори когато имате болки във врата или гърба; Ортопедия за акупунктура на Санта Круз
- Може ли високото кръвно налягане да бъде намалено чрез кръвопускане Плюс Дали Кейн Крамер е изобретил iPod-а
- Джинджифил, ползи, Yeh; s Изкуство на лечение, терапевтичен масаж, каросерия, шиацу, артрит, болка,
- Могат ли хапчетата за болка да убият вашите печалби от културизма