Деметриос Петракис
1 Катедра по съдебни науки и токсикология, Медицински факултет, Университет на Крит, 71003 Ираклион, Крит, Гърция; [email protected] (L.V.); rg.cou@akastast (A.M.T.)
Лукия Василопулу
1 Катедра по съдебни науки и токсикология, Медицински факултет, Университет на Крит, 71003 Ираклион, Крит, Гърция; [email protected] (L.V.); rg.cou@akastast (A.M.T.)
Харалампос Мамулакис
2 Катедра по урология, Университетска обща болница в Ираклион, Медицинско училище, Университет на Крит, 71003 Ираклион, Крит, Гърция
Христос Психаракис
3 Катедра по акушерство и гинекология, Венизелейо - Обща болница Pananio в Ираклион, 71409 Ираклион, Крит, Гърция; moc.liamtoh@sikarahcyspsirhc
Алики Анифантаки
Ставрос Сифакис
5 Mitera Hospital, 71409 Ираклион, Крит, Гърция; [email protected]
Анка Оана Доцеа
6 Катедра по токсикология, Фармацевтичен факултет, Университет по медицина и фармация, Петру Рарес, 200349 Крайова, Румъния; moc.liamg@aecodacna
Джон Циауси
7 Лаборатория по анатомия-хистология-ембриология, Медицинско училище, Университет на Крит, 71003 Ираклион, Крит, Гърция; moc.liamtoh@sissuoaistj
Антониос Макригианакис
8 Катедра по акушерство и гинекология, Медицинско училище, Университет на Крит, 71003 Ираклион, Крит, Гърция; rg.cou@aigyrkam
Аристидес М. Цацакис
1 Катедра по съдебни науки и токсикология, Медицински факултет, Университет на Крит, 71003 Ираклион, Крит, Гърция; [email protected] (L.V.); rg.cou@akastast (A.M.T.)
Резюме
Прегледът има за цел да представи изчерпателно въздействието на излагане на ендокринни разрушители (ЕД) във връзка с клиничната проява на затлъстяване и свързани заболявания, включително захарен диабет, метаболитен синдром, сърдечно-съдови заболявания, канцерогенеза и безплодие. EDs са силни участници в пейзажа на затлъстяването, като се намесват в клетъчните морфологични и биохимични процеси; чрез предизвикване на възпалителни реакции; и чрез представяне на транскрипционна и онкогенна активност. Подобряването на затлъстяването и липотоксичността се осъществява чрез препрограмиране и/или ремоделиране на епигеном на зародишна линия чрез излагане на ED. Специфични групи от населението са уязвими на излагане на ED поради настоящите диетични и екологични условия. Затлъстяването, заболеваемостта и канцерогенността, предизвикани от експозицията на ЕД, са променяща се реалност. Следователно, нов колективен стратегически подход се счита за съществен за преоценката на настоящите глобални условия, свързани с управлението на енергията.
1. Въведение
маса 1
Механизми на нарушаване на функцията на половите хормони от пестициди (модифициран от [11]).
| Дилдрин | ↑ | ↑ | ↓ | - |
| Ендосулфан | ↑ | ↑ | ↓ | ↓ |
| Метиокарб | ↑ | ↑ | ↓ | - |
| Пиримикарб | - | ↑ | - | ↑ |
| Пропамокарб | - | ↑ | - | ↑ |
| Фенаримол | ↑ | ↑ | ↓ | ↓ |
| Прохлораз | ↓ | ↓ | ↓ | ↓ |
(↑) Повишен отговор; (↓) намален отговор; (-) без ефект.
2. Ендокринни нарушения при индукция на затлъстяването
Ендокринните разрушители могат да действат директно или индиректно като обезогени, чрез насърчаване на адипогенезата чрез контрол/засилване на липидното натрупване [19] или чрез енергиен баланс; последното се постига чрез преминаване към съхранение на калории чрез модифициране на основния метаболизъм, промяна на чревната микробиота [20], насърчаване на съхранението на храна и промяна на хормоналния контрол [21] на апетита и ситостта [22]. В днешно време новите обезогенни ED се идентифицират с нарастваща скорост [23], насърчавайки липидния метаболизъм [24], диабет и затлъстяване на черния дроб [25].
Липидната тъкан е вид съединителна тъкан, състояща се от предшественици и зрели адипоцити, ендотелни клетки, клетки от стромална съдова фракция, съдови клетки на гладката мускулатура, макрофаги и инобласти. Той действа предимно като отделение за съхранение на енергия, където триглицеридите се съхраняват в адипоцитни агрегати, потенциално използвани за реакция на тялото при ниски температури, глад/гладуване и интензивни мускулни натоварвания. Мастната тъкан обаче оказва значително въздействие и върху хомеостазата, действайки като мощен биосинтетичен механизъм на фактори, проявяващи ендокринната функция. Клетките на мастната тъкан са способни да произвеждат различни ендокринни молекули (липокини), които включват цитокини (фактор на туморна некроза-1 (TNF-α) и интерлевкин-6 (IL-6)), простагландини (PG), хемокини, протеини на алтернативен път на комплемента (адипсин, С3 и В), ангиотензиноген, фактори, участващи в глюкозната хомеостаза (ретинол свързващ протеин (RBP) и адипонектин), в ангиогенезата (съдов ендотелен растежен фактор (VEGF)) и в хемостазата (инхибитор на плазминогенов активатор протеин-1 (PAI-1)), както и други молекули (напр. Лептин, висфатин, резистин и апелин, глюкокортикоиди и свободни мастни киселини).
Дисрегулирането на гореспоменатите пътища води до затлъстяване. Натрупването на макрофаги в мастната тъкан е отговорно за експресията на мастната TNF-α, NOS2 (азотен оксид синтаза 2) и IL-6 [26,27]. Съобщава се за силна връзка между степента на инфилтриране на макрофаги в мастната тъкан, други провъзпалителни имунни клетки и няколко провъзпалителни медиатори (TNF-α, IL-1β и IL-6), които са засилени при затлъстяване [28] . Нивата на TNF-α се увеличават поради излишната секреция от макрофаги, пребиваващи в мастната тъкан. Индуцира се липолиза, което води до повишени нива на IL-6, докато адипонектинът е намален. IL-6 участва в систематично възпаление, насърчавайки чернодробната експресия на С-реактивен протеин и протеини с остра фаза, възпрепятствайки действието на инсулина в мускулните и чернодробните клетки. Хемокините показват подобен модел; тъй като увеличават затлъстяването, те задълбочават тази патология допълнително. Адипсин взаимодейства с фактори С3 и В, предизвиквайки съхранение на триглицериди чрез естерификация на мастни киселини и инхибиране на липолизата. Нивата на адипонектин са недостатъчни при затлъстяване, докато лептинът (възпалителен липокин) увеличава производството на TNF-α и IL-6.
Биохимичната роля на EDs при затлъстяване е широко проучена. Доказано е, че различни ксенобиотици насърчават затлъстяването [1]. Съобщава се, че фунгициди като винклозолин и генистеин се намесват в диференциацията на клетъчната линия на 3T3-L1 в мастните клетки [29]. Съобщава се, че излагането на бисфенол А (BPA) по време на бременност агрегира чернодробните триглицериди при потомци [30]. Органохлорините (OC) насърчават диференциацията на адипоцитите чрез експресия на протеин 4, свързващ мастните киселини, и протеин-1с, свързващ регулаторния елемент на стерола, индуцирайки регулиране на лептина и синтазата на мастни киселини, повишаващи адипогенезата/вътреклетъчното натрупване на липиди в преадипоцитите чрез регулиране на отговорните молекули за съхранение на липиди [31]. Те също така влияят на диференциацията на адипоцитите, индуцирайки дейностите на растежен фактор (костни морфогенетични протеини (BMP), рецептор на епидермален растежен фактор (EGFR) и инсулиноподобен растежен фактор 1 (IGF-1)) до мезенхимни стволови клетки, които могат да повлияят на диференциацията на фибробластите към пред- и зрели адипоцити [32].
3. Разстройства на ендокринната система - роля в заболяванията, свързани със затлъстяването
3.1. Участие на ендокринните разрушители в метаболитния синдром
Таблица 2
Затлъстяването, захарният диабет тип 2 и липидните нарушения, индуцирани от ендокринни разрушители, участват в метаболитния синдром с малка (х), средна (хх) и голяма (ххх) качествена корелация (модифицирана от [61]).
| Бисфенол А | ххх | ххх | ххх |
| Ди (2-етилхексил) фталат | ххх | ххх | ххх |
| Дихлордифенилтрихлороетан / Дихлородифенилдихлороетилен | ххх | хх | х |
| Полибромиран дифенил етер | х | ||
| Перфлуороктанова киселина | хх | ххх | |
| Перфлуороктансулфонова киселина | х | ххх | |
| Трибутилтин | ххх | ххх | ххх |
| Замърсяване на въздуха | хх | ххх | ххх |
| Полициклични ароматни въглеводороди | |||
| Полихлорирани бифенили | х | ххх | ххх |
| 2,3,7,8-тетрахлордибензо-р-диоксин | хх | ххх | |
| Атразин | х | хх | |
| Бензо (а) пирен | х | хх |
3.2. Ендокринни разрушители и инсулинова резистентност
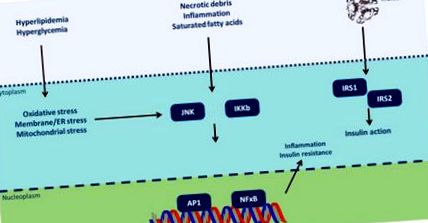
Инсулиновата резистентност може да бъде провокирана от различни молекулярни модели, срещани при обезогенни събития (Фигура 1) [67]. TNF-α намалява инсулиновата чувствителност, като ограничава функцията на транспортер на глюкоза тип 4 (GLUT4) [68]. Лептинът регулира вътреклетъчните липидни нива в чернодробните и β-панкреатичните клетки, подобрявайки инсулиновата чувствителност [69]. Напротив, резистинът насърчава инсулиновия толеранс чрез активиране на TNF-α и IL-6 [70]. Висфатин имитира инсулин и насърчава трансформацията на преадипоцити в зрели адипоцити [71]. Взаимодействието Adipsin-C3/B инхибира липолизата и транспортирането на глюкоза [72]. Освен това, RBP-4 (ретинол свързващ протеин-4), прекалено експресиран в анормална мастна тъкан, инхибира експресията на GLUT4, водеща до инсулинова резистентност [73]. С настъпването на инсулинова резистентност се увеличава глюкозата на гладно и се възпрепятства глюкозният толеранс. Това метаболитно състояние предизвиква по-нататъшно освобождаване на инсулин, което в крайна сметка води до хиперинсулинемия, която симулира транскрипционни фактори в черния дроб, стимулирайки хипертриглицеридемия и чернодробна стеатоза [74].
Възпалителните сигнални пътища свързват излишъка на хранителни вещества с инсулиновата резистентност (модифицирана от [67]). Цитоплазматичните/ядрени реакции чрез тирозин фосфорилиране на инсулиновия рецепторен субстрат (IRS) -1 и IRS-2 се активират от присъствието на инсулин на клетъчната повърхност. Въпреки това, инсулиновата сигнализация е потенциално инхибирана от сериново фосфорилиране на тези протеини от Jun N-терминални кинази (JNK) и инхибитор на ядрен фактор κB (NF-κB) кинази (IKK). Различни интра/извънклетъчни последствия от хроничен излишък на хранителни вещества активират тези сигнални пътища, свързвайки прехранването с инсулинова резистентност. JNK и IKK активирането предизвиква възпалително производство на цитокини, активирайки JNK/IKK по автокринен/паракринен начин, допълнително засилвайки инсулиновата резистентност. ER: ендоплазмен ретикулум; AP-1: активатор протеин-1).
Жените, изложени на диетилхексил фталат по време на бременността/перинаталното развитие, проявяват хипергликемия с намалени нива на инсулин [75]. Перинаталното излагане на BPA увеличава тежестта на инсулита (възпаление на островчетата Лангерханс) и по този начин разпространението на диабета [76]. Ендокринните разрушители индуцират промени в генома по време на бременност или ранен живот и заковават в намалена експресия на панкреатичен/дуоденален хомеобокс 1 ген на транскрипционен фактор (PDX-1)/увеличаване на диабет тип 2 [77], което предполага, че вътреутробното излагане на под или над -храненето е риск за затлъстяване и прогресиране на диабета в зряла възраст. Ендокринните разрушители ограничават запаса от основни метаболитни субстрати до плода и причиняват вътрематочно забавяне на растежа, представяйки се като фетален глад и метаболитна основа, която предизвиква прогресиране на диабета при PDX-1. Пренаталното и ранно излагане на замърсители като фталати, BPA, перфлуорирани съединения, PCB и диоксини могат да повлияят отрицателно върху развитието на имунната система, което води, наред с другото, до захарен диабет тип 1 чрез затруднени панкреатични β-клетъчни и имуно-клетъчни функции като както и имуномодулация, чрез хормонални и/или епигенетични промени [78,79].
Пренаталното/ранно излагане на замърсители (фталати, BPA, перфлуорирани съединения, PCB и диоксини) може да повлияе отрицателно върху развитието на имунната система, което води до захарен диабет тип 1 чрез нарушени функции на бета-клетките/имунните клетки на панкреаса и имуномодулация чрез хормонални и/или епигенетични изменения, наред с други [78,79]. Ендокринните разрушители влияят върху количествената секреция на инсулин и имунитета, но също така променят инсулинозависимата иРНК стабилност. Тъй като промоторът, свързващ протеиновия ген, свързващ инсулиноподобния растежен фактор (IGFBP-1), регулира нивата на кръвната глюкоза, специфичното регулиране на IGFBP-1 mRNA в човешки хепатоцити и HepG2 човешки хепатомни клетки (съответно 2,5- и 8-кратно), дори в присъствието на инсулин, може да обясни разрушителните ефекти на TCDD върху метаболизма на глюкозата [95].
3.3. Участие на ендокринните разрушители в проявата на сърдечно-съдови заболявания
Таблица 3
Категоризиране на биомаркерите на оксидативния стрес според ендокринния тип разрушител.
- Ендокринни разрушители и затлъстяване; Obesogens Endocrinología y Nutrición (английско издание)
- Ендокринни разрушители в обикновените пластмаси, свързани с риска от затлъстяване - ScienceDaily
- Условия, свързани със стъпалата, причинени от затлъстяване
- Болести и рискове за здравето, свързани със затлъстяването
- Дерматологични прояви на затлъстяване - Част 2 Ендокринни аномалии