Резюме
Затлъстяването е сложно заболяване, което включва взаимодействия между фактори на околната среда и генетични фактори. Затлъстяването е резултат от дисбаланс между приема на храна и разхода на енергия в продължение на няколко години. Генетичният подход, както при животински модели, така и при хора, позволи огромен напредък в разбирането на регулирането на телесното тегло. Моногенните форми на затлъстяване при хората са характеризирани и са резултат от мутации в гени, участващи в централните пътища на регулиране на приема на храна. Тези случаи обаче са изключително редки и като цяло затлъстяването трябва да се разглежда като сложно полигенно заболяване, включващо взаимодействия между множество гени и околната среда. Многобройни проучвания, включително проучвания при деца, се опитват да идентифицират гените на „чувствителност“. Понастоящем резултатите не са убедителни, доколкото те са силно променливи между проучванията и тъй като относителният риск, свързващ специфичен генен алел и затлъстяване, остава нисък. По този начин изглежда изключително преждевременно за генотип пациенти със затлъстяване в голям мащаб за прогностично тестване. Когато обаче станат достъпни специфични фармакологични лечения въз основа на скорошни открития, генетичните тестове могат да помогнат да се направи разлика между подвидовете затлъстяване, които могат да реагират диференцирано на лечението.
Затлъстяването се превърна в основен здравословен проблем в съвременните общества, с разпространение до 25% в някои страни и нарастваща честота при деца (1). Същевременно генетичният подход на затлъстяването напредва бързо. Този кратък преглед обсъжда механизмите на съхранение на енергия, връзката между затлъстяването и генетиката и въпроса за мястото на генетиката в лечението на затлъстяването.
ЕНЕРГИЙЕН БАЛАНС
Ако разходът на енергия (механична работа и топлина) е по-малък от приема, енергията ще се съхранява. Основната форма на съхранение на енергия е триглицеридите, съдържащи се в мастната тъкан. Съхранението на енергия е физиологичен процес, участващ в оцеляването. Всъщност освобождаването на мастни киселини чрез хидролиза на запасите от триглицериди на бялата мастна тъкан ни позволява да се сблъскаме с периоди на недостиг на храна или увеличени енергийни разходи.
Белите адипоцити произхождат от прекурсорни клетки чрез процес на ангажиране и диференциация, който може да се осъществи през целия живот (2). Локализацията на мастната тъкан е различна при мъжете (обикновено горната част на багажника и интраабдоминално) и жените (долната част на багажника и подкожната). Интраабдоминалното затлъстяване е по-често свързано със сърдечно-съдови заболявания (3).
Друга ключова функция на мастната тъкан е секрецията на фактори, включително цитокини, ангиогенни фактори, имунородни фактори, простагландини, ангиотензиноген и протеини, участващи в регулирането на енергийния баланс и въглехидратния метаболизъм (напр. резистин, адипонектин) (4). Някои от тези фактори са сигнали за затлъстяване, секретирани пропорционално на масата на мастната тъкан и биха могли да участват в развитието на свързаните със затлъстяването усложнения.
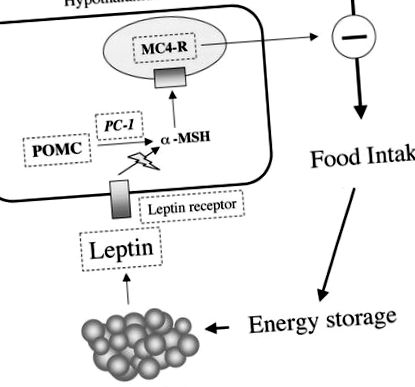
Енергийният баланс може да се регулира или на ниво прием на храна, или на разход на енергия. Значителен напредък в разбирането на регулирането на съхранението на енергия произтича от откриването на лептин. Лептинът е цитокиноподобен полипептид, произведен от адипоцита, който контролира приема на храна чрез активиране на хипоталамусните рецептори (5). Лептинът се произвежда пропорционално на мастната маса и по този начин информира мозъка за нивото на мазнините. В дъгообразното ядро на хипоталамуса лептинът индуцира синтеза и секрецията на α-MSH от прохормона POMC. α-MSH се свързва с MC4R в ядрата на хипоталамуса и инхибира приема на храна. Лептинът също така намалява експресията на орексични пептиди като невропептид Y. Други хормони, грелин (орексик), инсулин (анорексик) и холецистокинин (анорексик), участват в краткосрочния контрол на енергийния прием.
Освен това, при гризачите лептинът може да регулира енергийната продукция чрез стимулиране на симпатиково активиране на кафява мастна тъкан (2). Тази тъкан се характеризира с наличието на специфичен β-адренергичен рецептор (β3) и голям брой митохондрии. Във вътрешната мембрана на тези митохондрии UCP1 позволява производството на топлина от окисляването на мастните киселини. По този начин, когато тази тъкан се активира, свръхпредлагането на енергия може да се разсейва като топлина, като по този начин се намалява съхранението на мазнини. Кафява мастна тъкан съществува при малки (гризачи) или млади бозайници, включително човешкото бебе. Той продължава до зряла възраст при гризачи, но има тенденция да изчезва при възрастни хора. Кафявата мастна тъкан е описана при възрастни хора само в близост до надбъбречни тумори (феохромоцитоми) и в някои групи, изложени за много дълги периоди на студ. Други UCP-подобни протеини (2 и 3) са описани в различни тъкани, включително мускули, но тяхната роля в термогенезата се счита за съмнителна. По този начин все още не е ясно дали съществуват механизми за регулиране на енергийното производство при хората.
ЗАТЪЛВАНЕ
Затлъстяването се определя като натрупване на излишни телесни мазнини до такава степен, че здравето може да бъде нарушено (определение на Световната здравна организация). В ежедневната си практика лекарите използват ИТМ (телесно тегло в килограми, разделено на квадратен ръст в метри)> 30, за да определят затлъстяването (въпреки че ИТМ не е точно отражение на мастната маса). BMI диаграмите също са достъпни за деца и вземат предвид възрастта и пола (6). Различните видове затлъстяване (android, gynoid) могат да бъдат определени според местоположението на депата на мастната тъкан. Обикновено затлъстяването включва увеличаване както на броя, така и на размера на адипоцитите (2). In vivo проучвания при хора, включително деца и юноши, са показали, че развитието на затлъстяване с течение на времето е предимно резултат от периоди на прехранване, а не дефект в основния разход на енергия.
ЕКОЛОГИЧНИ И ГЕНЕТИЧНИ ФАКТОРИ
Както беше посочено по-горе, съхранението на енергия под формата на мазнини е важна адаптация за оцеляване. По този начин е вероятно комбинацията от гени да е избрана по време на еволюцията, за да благоприятства съхранението на енергия (хипотезата „пестелив ген“) (2). В нашия контекст на повишена наличност на храна и намалена физическа активност, тези гени ще дадат податливост на развитието на затлъстяване и поддържането му (8). Участието на генетични фактори в контрола на телесното тегло е показано от проучвания на монозиготни близнаци, показващи висока съвместимост на телесния състав и реакция на прехранване (8). Генетичната податливост в повечето случаи е полигенна, като всеки ген вероятно допринася за малка част и рядко е резултат от менделовски ген (моногенно затлъстяване). Дали по-малък брой гени с по-големи фенотипни ефекти (т.е. основни гени) ще бъдат открити в общата затлъстела популация все още е неизвестна.
В допълнение към факта, че генетичните фактори могат да модулират съхранението на хранителни вещества, хранителните вещества са в състояние да модулират генната експресия (9). По този начин затлъстяването е резултат от сложни генетични и екологични взаимодействия. Това прави търсенето на гени за податливост при хората изключително трудно.
ГЕНЕТИЧНИ СИНДРОМИ, ПРИСЪЕДИНЯВАЩИ СЪС ЗАТЪЛВАНЕТО
Затлъстяването е една от характеристиките, придружаващи многобройни генетични синдроми (поне 25). Повечето от най-често срещаните синдромни форми на затлъстяване, като Prader-Willi, Cohen, Alstrom и Bardet-Biedl (BBS), са генетично картографирани (10). Предизвикателството сега е да се определят специфичните гени - някои наскоро бяха идентифицирани, като MMKS в BBS или ALM1 при болестта на Alstrom - и протеините, които те кодират. И накрая, ще бъде необходимо да се определи тяхната роля като гени за чувствителност към затлъстяване, диабет, сензорен дефицит и по-общо при заболявания с множество и хетерогенни характеристики.
ЧОВЕШКО МОНОГЕННО ЗАТЪЛВАНЕ С ПОЗНАТА ГЕНА И ФУНКЦИЯ НА ПРОТЕИНА
Първата идентификация на ген при затлъстели хора е свързана с скрининга за гени, идентифицирани преди това в модели на гризачи за моногенно затлъстяване. Тези модели на затлъстяване на гризачи включват главно гени в регулаторния път на приема на храна. Подобни засегнати пътища са характеризирани при моногенно затлъстяване при хора (фиг. 1).
Схематично представяне на лептиновата регулация на приема на храна и протеини, мутирали в моногенно човешко затлъстяване. Лептинът се секретира от адипоцитите. Той се свързва с хипоталамусните рецептори в дъгообразното ядро и това предизвиква, наред с други ефекти, повишен синтез и секреция на α-MSH. α-MSH се образува от POMC чрез протеолитично разцепване, медиирано от PC-1. α-MSH се свързва с MC4R в паравентрикуларното ядро. Това от своя страна инхибира ефекторите на приема на храна. Стъпките, които са идентифицирани като мутирали в човешки моногенни форми на затлъстяване, се кръжат с пунктирана линия.
Лептин и лептинов рецептор.
Хомозиготните носители на мутация на загуба на функция в лептиновия ген проявяват болезнено затлъстяване с поява през първите месеци от живота, хипогонадотропен хипогонадизъм и централен хипотиреоидизъм (8). Засегнатите лица непрекъснато търсят храна и ядат значително повече от своите братя и сестри. Нито един от хетерозиготните родители или братя и сестри не е болестно затлъстял. В един случай, дете с дефицит на лептин е било лекувано чрез заместване на лептин. В това 9-годишно момиче всеки ден s.c. инжектирането на рекомбинантен човешки лептин в продължение на една година се понася добре и води до важна и продължителна загуба на мастна маса и подобряване на възрастовата функция на репродуктивната ос (8).
Едно семейство е идентифицирано с мутация на лептинов рецептор (11). При тримата субекти с хомозиготна мутация, отрязването на рецептора премахва сигнализирането за лептин, което води до фенотип, подобен на този при индивиди с лептинов дефицит, макар и по-тежък. Трите сестри, носещи мутация на лептинов рецептор, също показват значително забавяне на растежа, причинено от нарушена секреция на GH. В момента са описани седем случая на мутации на лептин или рецептор на лептин (10).
Меланокортинов път.
POMC е пептид, експресиран в човешкия мозък, червата, плацентата и панкреаса. Той е предшественик на много хормони, включително ACTH и α-MSH, произведени от PC-1-зависимо разцепване (5). Тъй като α-MSH участва в регулирането на приема на храна, а също и в пигментацията на косата, може да се предвиди, че фенотипът, свързан с дефект във функцията POMC, ще включва затлъстяване, променена пигментация и дефицит на ACTH. Както се очаква, две деца с хомозиготни или съставни хетерозиготни мутации на загуба на функция в POMC проявяват фенотип, включващ затлъстяване, зачервена коса и надбъбречна недостатъчност, отразяващи липсата на хипофизни невропептиди, получени от гена POMC (12). Мутациите на PC-1 също са описани и са свързани със затлъстяване и ACTH недостатъчност, както при POMC мутациите. Тези субекти обаче демонстрират и хиперпроинсулинемия, тъй като PC-1 участва в превръщането на проинсулин в инсулин в β-клетката на панкреаса (8).
За разлика от формите на моногенно затлъстяване, свързани с множество ендокринни дисфункции, мутациите в MC4R (рецепторът на α-MSH) причиняват доминиращо и рецесивно наследено несиндромно затлъстяване с непълна проникване (мутацията не винаги е свързано със затлъстяване) и променлива експресия (a подобна мутация може да доведе до различна степен на затлъстяване) (8, 13). Човешкото затлъстяване, причинено от MC4R мутации, е подобно на по-често срещаните форми на затлъстяване, с по-ранна възраст на настъпване. Интересното е, че се съобщава за тенденция към по-голяма честота на детско затлъстяване и прекомерен глад и поведение при търсене на храна от 6 до 8 месеца. Освен това беше отбелязана общата връзка на детското затлъстяване с повишена скорост на растеж. MC4R мутациите представляват значителна причина за затлъстяване при деца със затлъстяване и затлъстяване (0,5–6%) (14). Описани са поне 27 различни мутации при 68 индивида (10). Ролята на тези мутации остава да бъде изяснена, доколкото индивидите с тези различни мутации имат различни нива на затлъстяване.
Дори като се вземе предвид последния случай, затлъстяването, при което един ген може да бъде идентифициран като основна причина, е рядкост. Повечето от гените, участващи в моногенни форми на затлъстяване, участват в регулирането на приема на храна. Това обаче не изключва, че при най-често срещаните форми на затлъстяване (вж. По-долу) гените, участващи в множество пътища, от абсорбцията на хранителни вещества до енергийните разходи, играят роля.
ОБЩИ ФОРМИ НА ЗАТЪЛВАНЕ
Гени за чувствителност.
Възможни са два подхода за идентифициране на гени за чувствителност. Първият се състои от сканирания в целия геном, насочени към откриване на хромозомни области, показващи връзка със затлъстяването в големи колекции от ядрени семейства, състоящи се предимно от възрастни двойки братя и сестри. Петдесет и девет локуса са свързани със затлъстяването във всички хромозоми с изключение на хромозома Y, но все още не е характеризиран ген, участващ в честото затлъстяване (10). Вторият метод е кандидат генният подход. Това включва тестване на връзката между затлъстяването и специфичен алел на ген, който изглежда добър кандидат (напр. ген, участващ в регулирането на приема на храна), или в семейно проучване, или в големи кохорти от несвързани контроли и пациенти.
Кандидат-гени: регулиране на приема на храна.
Плазменият лептин при пациенти със затлъстяване обикновено е нормален за тяхната мастна маса, което показва, че липсата на лептин не е основната причина за честото затлъстяване. Проучванията за свързване и асоцииране обаче са дали доказателства, макар и понякога непоследователни, за участието на лептин - или поне локус на лептинов ген - в сложния детерминизъм на затлъстяването и свързаните с него фенотипи при затлъстяване в началото. Показано е, че един генен вариант, съседен на последователностите, участващи в транскрипцията на лептинов ген, модулира отговора на калоричните ограничения при жените със силно затлъстяване. Хомозиготни затлъстели момичета, носещи варианта алел, са имали 25% намаление на нивата на лептин въпреки подобна маса на телесните мазнини (15). Подобни взаимоотношения са описани между вариант в некодиращия регион на екзон 1 и нивата на циркулиращ лептин при възрастни с френско затлъстяване. Тези проучвания предполагат, че генетичните вариации в лептиновия ген могат да обяснят вариацията в нивата на циркулиращия лептин и по този начин могат да модифицират способността на мозъка да усеща количеството мазнини, съхранявани в бялата мастна тъкан. За разлика от генетичните изследвания върху лептиновия ген, не е потвърдена връзка между затлъстяването и лептиновия рецепторен ген в мета-анализ (16).
Въпреки че все още са ограничени по брой и значение в сравнение с проучвания за възрастни, други гени са оценени като правдоподобни кандидати при деца и в популации с преобладаване на умерено до тежко ювенилно затлъстяване. Някои от тези проучвания за свързване или асоцииране при млада популация са описани от Rankinen и др(10). Генът POMC е правдоподобен кандидат за полигенно затлъстяване. Той присъства в един локус и е свързан със затлъстяването при сканиращ анализ на целия геном. Едно проучване описва по-високи нива на лептин при италиански деца със затлъстяване с мутация в гена POMC (17). Необходими са функционални проучвания, както и анализ при по-големи популации, за да се потвърди участието на POMC в развитието на често срещано затлъстяване при деца.
Други невропептиди, участващи в контрола на приема на храна, като CART (кокаин и регулиран от амфетамин транскрипт) или невромедин В (свързан с бомбезин пептид) също са тествани като вероятни кандидати, но са установени неубедителни резултати.
Кандидат-гени: регулиране на метаболизма.
Инсулинът се счита за важен сигнал за затлъстяване за мозъка. В проучване на ранното начало на затлъстяването е анализиран ефектът от вариантите на инсулиновия ген сред 615 деца със затлъстяване. Интересното е, че е показано, че специфична алелна комбинация предизвиква по-висока секреция на инсулин и по-висок риск от развитие на ювенилно затлъстяване (18).
Гените-кандидати също включват гени, участващи в пътищата на енергийни разходи и метаболизма на липидите и мастната тъкан. Бета-адренергичните рецептори (β2 и β3), както и UCP1 са обект на много проучвания за асоцииране, включително проучвания при деца. Тези проучвания обаче като цяло дадоха неубедителни резултати. Проучване, проведено при момичета в юношеска възраст, предполага, че носителите на специфичен вариант на PPARγ, транскрипционен фактор, участващ в диференциацията на адипоцитите и метаболизма (2), имат повишена годишна скорост на промяна на варианта на BMI аланин на активирания от пероксизома пролифератор ген-гама2 относно индекса на телесна маса при деца и юноши. Fertil Steril 76: 741–747 „href ="/articles/pr2003291 # ref-CR19 "> (19). За разлика от това при възрастни пациенти проучванията за асоцииране с варианти на PPARγ дават ограничени или несигурни връзки с фенотипите на затлъстяването. такова многофакторно и полигенно заболяване, в момента е изключително трудно да се свърже ген с по-висок риск от затлъстяване по ясен и възпроизводим начин.
Затлъстелите деца представляват интересна целева популация за генетични изследвания, тъй като промяната в телесната мастна маса и появата на затлъстяване може да са по-малко зависими от натиска на околната среда. Към днешна дата обаче нарастващият брой проучвания за асоцииране при деца показват, че ролята на кандидат-гените при затлъстяване в началото може да бъде умерена и трябва да се разглежда в комбинация с други фактори, точно както при възрастните популации. Все още трябва да се докаже точността на подхода за широко геномно сканиране в способността му да идентифицира причинителите.
КАКВО МОГАТ ДА НАУЧАТ ПЕДИАТРИТЕ ОТ ГЕНЕТИЧНИ ИЗСЛЕДВАНИЯ ПРИ ЗАТЪЛВАНЕ?
На настоящия етап не е ясно дали консултирането и генетичните тестове (прогностична генетика) ще бъдат интегрирани в практиката на превенцията и управлението на затлъстяването. Преди това да се случи, са необходими отговори на няколко въпроса, в допълнение към отговор на по-общите психологически, социални и етични въпроси, които може да повдигне перспективата за генетично изследване.
Първо, можем ли да определим прогнозиращия риск, свързан със затлъстяването, за генни вариации или мутации в кандидат-гени? Въпреки че генетичната прогноза за моногенни заболявания е много висока и може да бъде изчислена, прогнозиращият риск обикновено е малък и в момента е трудно да се определи за по-чести причини за затлъстяване. Например относителните рискове от високо наддаване на тегло, поява на диабет или затлъстяване при алелни носители на няколко кандидат-гена (β3AR, сулфонилурейни рецептори, апоВ) обикновено са
ЗАКЛЮЧЕНИЕ
Един от основните интереси на генетичния подход и по-общо на клиничните генетични проучвания при пациенти е да осигури пробиви в разбирането на молекулярните механизми, участващи в регулирането на телесното тегло (8). Това от своя страна може да осигури нови цели за разработването на общи терапии за затлъстяване, цел, която ще бъде постигната в близко бъдеще. Прогностичната генетика е проблематична при често срещаните форми на затлъстяване и не оправдава широкомащабни тестове, стига да не са налице специфични лечения. След като обаче тези терапии бъдат разработени, генетичното тестване може да позволи класифициране на пациентите в различни подгрупи, за които може да се тества ефективността на различните лечения (8).
- Изследване на циркулацията на епидемиологията на затлъстяването и диабета и техните сърдечно-съдови усложнения
- Допринасящи за детското затлъстяване в юношеска възраст Повече от просто енергиен дисбаланс
- Кучешко и котешко затлъстяване преглед на патофизиологията, епидемиологията, VMRR
- Диета срещу упражнения за профилактика на детското затлъстяване ролята на упражненията International Journal
- Детско затлъстяване - Новини, изследвания и анализи - Разговорът - страница 1