Резюме
Въведение
Нашият скорошен анализ на NOD2/КАРТА15 ген показва, че честотата на Т алела при 802С/Т полиморфизъм е значително по-висока (32,8%) в групата пациенти в сравнение с общата популационна група (18,1%), с относителен риск от 1,8. В групата пациенти честотата на генотипа CC е 51,1%, CT 32,1% и TT 16,8% (относителен риск: съответно 0,7, 1,1 и 4,2), докато в популационната група: 69,0, 25,7 и 5,3% (относителен риск: 1.0, 0.9 и 1.3, съответно) (Hnatyszyn et al. Т полиморфизъм на гена NOD2/CARD15 с хроничен гастрит и предразположение към рак при пациенти, заразени с H. pylori. Exp Mol Pathol 88: 388–393 "href ="/статия /10.1007/s00005-013-0245-y#ref-CR18 "> 2010).
Това предполага, че генният полиморфизъм на възпалителния отговор на гостоприемника може да повлияе на характера и степента на стомашната лигавица, свързана с H. pylori инфекция. Целта на нашите изследвания беше анализът на асоциациите на провъзпалителни гени на цитокини: IL1A и IL1B с появата на промени в стомашната лигавица. За тази цел честотата на алела и генотипа на IL1A генен полиморфизъм –889C> T и на IL1B генният полиморфизъм + 3954C> T е сравнен между общото полско население и пациентите с хроничен гастрит, атрофия, чревна метаплазия, дисплазия, чревен тип рак на стомаха с H. pylori инфекция.
Материали и методи
Пациенти
Гастроскопски прегледи
Всички ендоскопски изследвания на стомаха са извършени в местна упойка (2% лигнокаин) с помощта на видеогастроскоп (GiF Q 165 Olympus, Токио, Япония) от същия ендоскопист. Никой от пациентите не е подложен на обща анестезия. Макроскопската оценка на ендоскопския образ на възпалителните промени на стомашната лигавица (оток, хиперемия, гранулиране на лигавицата, наличие на ерозии и язви, хипертрофия или атрофия на стомашни гънки) е извършена в съответствие с актуализираната класификация в Сидни (Dixon et al. . 1996; Мисевич 1991). В хода на извършените изследвания са взети следните пет тъканни проби: от областта на пилора, ъгъла и корпуса на стомаха от по-голямата и по-малката кривина. Взети са допълнителни две биопсии от антрум и от корпус на стомаха H. pylori откриване с помощта на бърз тест за уреаза (Институт по храните и храненето, Варшава). Експериментите бяха приети от Биоетичната комисия на Познанския университет по медицински науки. Всички пациенти, както и родители и деца, имаха достъп до пълна информация относно експериментите и представиха писменото си съгласие за тяхното изпълнение.
Хистологични изследвания
Хистологичната оценка беше извършена чрез лечение на препарати с хематоксилин и еозин, както е описано по-рано (Hnatyszyn et al. T полиморфизъм на гена NOD2/CARD15 с хроничен гастрит и предразположение към рак при пациенти, заразени с H. pylori. Exp Mol Pathol 88: 388–393 "href ="/article/10.1007/s00005-013-0245-y # ref-CR18 "> 2010). Всички проби са изследвани от същия хистопатолог без клинична информация. H. pylori инфекцията се оценява като положителна чрез серумен тест или хистологично изследване с оцветяване по Giemsa. Интензивността на възпаление на стомашната лигавица, атрофия на жлезите, чревна метаплазия и дисплазия бяха оценени във всеки раздел съгласно актуализираната класификация в Сидни (Misiewicz 1991; Dixon et al. 1996). Степента на възпаление на лигавицата, атрофия и чревна метаплазия се класифицира, като се използват четири степени, както следва: 0 - няма; 1 – лека; 2 – умерено; и 3 – тежки. Стомашният карцином е класифициран в чревен и дифузен тип според критериите на Lauren (Lauren 1965).
Откриване на H. pylori Инфекция
Наличието на H. pylori бактериите бяха открити с помощта на уреазен тест (Институт по храните и храненето, Варшава), който беше отчетен след 2 и 24 часа (съмнителни случаи). Освен това, наличието на H. pylori бактериите са потвърдени в стомашната лигавица чрез хистологични изследвания, използващи метода Warthin-Starry, модифициран от Giemsa според актуализираната система в Сидни (Misiewicz 1991; Dixon et al. 1996). За всички пациенти бяха проведени и двата теста. Най-съществените резултати са постигнати чрез хистопатологично изследване, като се има предвид по-ниска чувствителност и специфичност на бързия уреазен тест. Откриване на H. pylori бактериите в популационната група се извършва с помощта на имунологичен тест (HELICO Test, Ani Biotech Oy, Финландия). Този тест измерва нивото на IgG антитела срещу бактерията.
Анализ на полиморфизма в IL1A и IL1B Гени
Молекулярни изследвания за асоцииране на –889C/T полиморфизми на IL1A и + 3954C/T полиморфизъм на IL1B гени с хроничен гастрит и предразположение към рак в H. pylori-инфектирани пациенти са извършени при пациенти с клинична диагноза на различни стадии на хронично възпаление, потвърдена от гастроскопски и хистологични анализи. ДНК е изолирана в случай на пациенти и контролни групи от парафинови блокове на стомашни лигавични биопсии с помощта на Roche High Pure PCR шаблон за приготвяне на шаблон и от периферна кръв с помощта на гуанидин изотиоцианат (метод GTC).
Генотипизирането се извършва с помощта на PCR-RFLP анализ, последван от електрофореза в 6% полиакриламидни гелове (ALFExpress) или в 1,5% агарозни гелове. За да се усили 98 bp фрагмент, обхващащ –889C/T полиморфизъм на IL1A ген, PCR реакцията се провежда в 20 μl от реакционната смес, съдържаща 100 ng геномна ДНК, 15 pmol F и R праймери всеки, 0.125 mM dNTP, 1.0 U Taq полимераза. Последователностите на праймера бяха както следва: IL1A (–889C/T) F 5′-Cy5-GTTCTACCACCTGAACTAGGC-3 ′ и IL1A (–889C/T) R 5′-TTACATATGAGCCTTCC-ATG-3 ′. Фрагментът от 230 bp, обхващащ + 3954C/T полиморфизъм на IL1B генът се амплифицира, като се използват праймери: IL1B (+ 3954C/T) F 5′-Cy5-GACTTTGACCGTATATGCTCAG-3 'и IL1B (+ 3954C/T) R 5'-ATGGACCAGACATCACCAAGC-3'. Условия на реакцията: първоначална денатурация 95 ° С, 5 минути; 30 цикъла: денатурация 92 ° C, 30 s, отгряване на грунд 55 ° C, 45 s, синтез 72 ° C, 60 s и краен синтез 72 ° C, 5 минути. ДНК фрагменти, получени след хидролиза с рестрикционни ензими NcoI (37 ° С, 6 часа) и TaqI (65 ° C, 6 h) бяха със следните размери: алел NcoI (-) на IL1A ген 98 bp и алел NcoI (+) 82 и 16 bp, докато алел TaqI (-) на IL1B ген 230 bp, алел TaqI (+) 126 и 104 bp.
Статистически анализ
Ако не е посочено друго, за анализ е използван χ 2 тестът на Пиърсън. Анализът на съответствието с разпределението на Харди – Вайнберг за групата от населението, анализът χ 2 за тенденцията и изчисляването на НОР бяха проведени с помощния софтуер на сайта: http://ihg.gsf.de/cgi- bin/hw/hwa1.pl. Беше използван безусловен логистичен регресионен анализ за изчисляване на ИЛ и доверителен интервал (CI). Корекцията на Bonferroni за многократно тестване не беше използвана. Останалите анализи бяха проведени с помощта на програмата Statistica 10.0 (StatSoft Inc.).
Резултати
Демографските и клиничните характеристики на пациентите и контролите, обхванати от това проучване, са представени в Таблица 1. Анализ на асоциацията на IL1A и IL1B генни полиморфизми в H. pylori-инфектирани пациенти с хроничен гастрит се извършва отделно за всеки ген.
Пациенти с хроничен гастрит, хроничен гастрит с атрофия, хроничен гастрит с чревна метаплазия и хроничен гастрит с дисплазия са разпределени към една група пациенти с хроничен гастрит. Това даде четири групи за молекулярен анализ: популационна група, контролна група без лезии и без инфекция на H. pylori при стомашна лигавица, хроничен гастрит с H. pylori инфекции и рак на стомаха от чревен тип. Популационната група се състоеше от 100 здрави индивида (50 жени, 50 мъже), специално събрани за проучвания. Разпределението на възрастта между групата на населението е 21–30, в контролната група 16–57 и в групата пациенти 11–87 (Таблица 1).
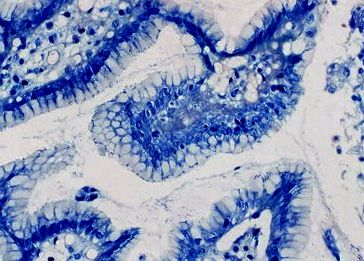
Хистологичните изследвания бяха извършени съгласно актуализираната система в Сидни, използвайки четири степени. Примери за биопсии на проби с различни стадии на гастрит и H. pylori инфекция са представени на Фиг. 1 и 2.
Helicobacter pylori от оцветяване на Гиемза-Романовски. H. pylori (среден стадий на инфекция), присъстващ в слой слуз, покриващ стомашния епител (увеличение × 400)
Оцветяване с хематоксилин и еозин на различни етапи на промени в лигавицата. а Умерена атрофия (степен 2) и жлези с признаци на чревна метаплазия (степен 2) при пилор (увеличение × 100). б Рак на стомаха (тубуларен аденокарцином G2-Kubo класификация; чревен тип: класификация Lauren). Твърди гнезда, ракови жлези на аденокарцином (горен) и доброкачествени жлези (долу вляво). Рак и възпалителна инфилтрация в стромата (увеличение × 400). ° С Една жлеза с признаци на тежка стадия на дисплазия (степен 3; дясно отдолу) и доброкачествени жлези (наляво и горен) (увеличение × 400). д Хроничен гастрит (степен 2). Стомашна лигавица с възпалителен инфилтрат, съставен от лимфоцитни клетки, плазмени клетки и неутрофилни (увеличение × 400)
The IL1A и IL1B разпределението на генотипа, честотите на алелите, общата номенклатура, методологичната номенклатура, използваните методи за генотипиране са обобщени в таблица 2. Използвана е методическа номенклатура, препоръчана от Обществото за вариация на човешкия геном (www.hgvs.org). The IL1A и IL1B разпределението на генотипа бяха в равновесие на Харди-Вайнберг.
В случай че IL1A генни полиморфизми няма значителни разлики в разпределението на генотипа и честотата на алелите между пациенти, заразени с H. pylori и хроничен гастрит, хроничен атрофичен гастрит, чревна метаплазия, дисплазия или рак на стомаха и контролът или популацията са наблюдавани, било в доминиращ или рецесивен модел на наследяване. Въпреки това, когато разпределението на генотипа на + 3954C> T полиморфизъм на IL1B ген е анализиран при същата група пациенти, контролна и популационна група, установени са значителни разлики в доминиращия модел на наследяване. Честота на алел Т от + 3954С> Т полиморфизъм на IL1B генът е по-висок при група пациенти с хроничен гастрит, атрофия, чревна метаплазия, дисплазия или чревен тип рак на стомаха (32,1%) в сравнение с популационната група (23%), χ 2 = 4,61 и стр = 0,03. Това съответства на OR: 1,58, 95% CI: 1,04–2,4. Разпределението на генотипа във всички изследвани групи е представено на фиг. 3.
Сравнение на честотите на генотипа от + 3954C> Т полиморфизъм на IL1B ген сред изследваните групи пациенти с популация и контролна група. Наблюдавано е значително различно разпределение в сравнение с пациенти с хроничен гастрит с популационна група. ИЛИ: 1.609; 95% CI: 1,05–2,47; х 2 = 4,72; стр = 0,03
Дискусия
Настоящото проучване изследва ролята на полиморфизмите IL1A и IL1B и съвместното съществуване на H. pylori инфекция в податливостта към развитие на хроничен гастрит при група пациенти от Западна Полша. За първи път анализирахме IL1A и IL1B генни полиморфизми като потенциални фактори, предразполагащи, заедно с H. pylori инфекция, до патологични промени, споделящи еднаква локализация в храносмилателния тракт.
Сред наличните мета-анализи много интересен е този, извършен от Wang et al. (2007), които са събрали данни от 39 проучвания, които включват 6 863 случая на рак на стомаха и 8 434 контроли. Обобщеното ИЛИ на риска от рак на стомаха, свързан с IL1B – 511T, 231C, 13954T и IL1RN * 2, е 1,26 (95% CI: 1,03–1,55), 1,00 (95% CI: 0,82–1,22), 1,37 (95% CI: 0,94 –2,00) и 1,20 (95% CI: 1,01–1,41), съответно. IL1B-511T се свързва с повишен риск от рак на стомаха (чревен тип) (OR: 1,76, 95% CI: 1,12-2,57). IL1RN * 2 също е свързан с повишен риск от рак на стомаха сред бялата раса (OR: 1.30, 95% CI: 1.09–1.54).
Друг мета-анализ, базиран на четиринадесет проучвания върху IL1B +3954 полиморфизъм, обхващащ данни от шест азиатски и осем неазиатски популации, показва липса на статистическа значимост между наличието на изследван полиморфизъм и риска от рак на стомаха. Като цяло всички резултати са сходни по големина, когато анализите са ограничени до H. pylori-положителни случаи и контроли (Persson et al. 2011). Резултатите показват важността на стратификацията по анатомично място, хистологичен тип, H. pylori инфекция и държава на произход. Съображенията за качеството на изследването, както лабораторни, така и епидемиологични, също могат да повлияят на резултатите и могат да обяснят променливостта на резултатите, публикувани до момента.
В други проучвания на IL1B +3954 полиморфизъм се предполага слаб доминиращ ефект на предполагаемо чувствителния Т алел. Не са открити значими асоциации по отношение на полиморфизмите IL1B +3954, свързани с рак на стомаха, но броят на допустимите проучвания върху полиморфизмите IL1B +3954 е доста ограничен и всички констатации също трябва да бъдат обяснени с изключително внимание. В този мета-анализ IL1B −511T алел и IL1RN * 2 променлив брой тандемни повторения (VNTR) са значително свързани с повишен риск от развитие на стомашен карцином и още по-значително с некардиален карцином на стомаха или с чревен тип стомашен карцином. И двете са значително свързани с повишен риск от развитие на стомашен карцином сред кавказците, но не и сред азиатците или испанците. Алел IL1B-31C или хомозиготен CC плюс TT, или алел IL1B + 3954T, обаче не са свързани с повишен риск от развитие на рак на стомаха, но IL1B-31 хомозиготен CC плюс TT е значително обратно свързан с риска от рак на стомаха от чревен тип (Xue et al. 2010).
Мета-анализ, извършен от Camargo et al. (2006) обхваща присъствието на IL1B-511T, IL1B-31C, IL1B +3954T, или IL1RN * 2 алелите и тяхната връзка с риска от рак на стомаха. За полиморфизмите IL1B + 3954T са цитирани осем проучвания: четири при кавказци, три при азиатци и едно при испанци. Хората, носещи алела Т, са имали незначително повишен риск от рак на стомаха в сравнение с генотипа C/C. Анализи на подгрупи по хистологичен подтип и местоположение не са правени в нито една от етническите групи поради недостатъчни данни за този SNP. Друг вид ограничение е малкият брой проучвания и следователно ограничената статистическа мощ. Тъй като ракът на стомаха е мултифакторно заболяване, повече изследвания трябва да се фокусират върху тестване на хаплотипове и взаимодействия ген-среда като H. pylori инфекция, тъй като това може допълнително да изясни генетиката на това сложно заболяване (Camargo et al. 2006).
От друга страна, нашите разследвания, проведени за полското население по отношение на анализа на асоциацията на IL1B ген + 3954С> Т полиморфизъм с възпалителни промени на стомашната лигавица и с чревен тип стомашен карцином при пациенти със съжителстващ H. pylori инфекция демонстрира такава връзка. Следователно появата на този полиморфизъм, подобно на полиморфизма IL1B – 31/–511, може да се третира като допълнителен рисков фактор за развитието на възпаление на стомашната лигавица и канцерогенеза. Освен това трябва да се вземе предвид съществуването на други синергично действащи полиморфизми. Тази предположение изглежда се потвърждава от доклади на корейски изследователи (Lee et al. 2004). Те демонстрираха, че при носители на IL1B – 1473G рискът от стомашен карцином на чревния тип се увеличава.
Ген IL1A притежава три полиморфизма: в –889 и 4845 позиции, както и при 46 bp VNTR в интрон 6 (Dinarello 1996). Според наскоро публикувани проучвания, проведени върху корейски пациенти, страдащи от стомашен карцином, не е доказана връзка на появата на полиморфизъм IL1A-889 с риска от развитие на стомашен карцином (Chang et al. 2005). В нашите проучвания ние оценихме връзката на полиморфизма IL1A в позиция –889 с риска от възникване на възпалителни промени на стомашната лигавица и стомашния карцином на чревния тип при пациенти, заразени H. pylori. Той показва само нарастваща тенденция на честотата на появата на C и T алели, както и на полиморфизмите генотип –889C> T на IL1A ген без статистическа значимост в изследваната група пациенти.
Резултатите от нашите изследвания потвърждават значителна роля на появата на ген IL1 полиморфизми в развитието на възпалението на стомашната лигавица, както и в развитието на стомашния карцином. Също така е необходимо да се вземе предвид значението на генните полиморфизми на други цитокини (напр. IL-6, IL-10, TNF-α), както и други генетични фактори, които могат да проявят синергично действие при развитието на тези промени. Определянето на нивото на риск от развитие на стомашен карцином трябва да вземе предвид много фактори на околната среда, като, наред с други, консумацията на сол или пушенето. Друг много важен фактор е мащабът на поява в дадена популация на H. pylori инфекция. Различията в появата на отделни фактори на околната среда могат да окажат значително влияние върху резултатите от изследванията, проведени в конкретна популация. Ето защо опитите за подобряване на точността на определяне на рисковете от стомашен карцином в дадена популация трябва да включват по-голям брой от изследваните полиморфизми и да вземат предвид широко разбраните фактори на околната среда, както и етническите и географските различия.
Препратки
Изследователската група EUROGAST (1993) Международна асоциация между инфекция с Helicobacter pylori и рак на стомаха. Проучвателната група EUROGAST. Lancet 341: 1359–1362
Bakwill F, Mantovani A (2001) Възпаление и рак: обратно към Virchow? Lancet 357: 539–545
- Инфекция с хеликобактер пилори, рефлуксен езофагит и атрофичен гастрит Неизследван триъгълник -
- Helicobacter pylori Предотвратява ли гастритът колит
- Реакции на антитела срещу Helicobacter pylori и риск от колоректален рак в проучване за контрол на случая през
- Инфекцията с хеликобактер пилори и ниското хранително промяна в поведението предизвикват желязодефицитна анемия,
- Инфекцията с хеликобактер пилори утежнява индуцирана от диетата инсулинова резистентност във връзка с червата