Субекти
Резюме
Въведение
Хиперурикемията се очертава като основна грижа за общественото здраве поради нарастващото й разпространение и значително въздействие върху различни клинични нарушения 1,2,3,4,5. Последните епидемиологични проучвания изчисляват, че разпространението на хиперурикемията е 8,4–25% сред общото китайско население 6, 25,8% в Япония 7 и 11,9–16,6% при западните популации 8,9,10. Също така се изчислява, че 21% от общото население на САЩ страда от хиперурикемия 11. Доказано е, че хиперурикемията е важен независим фактор, който увеличава рисковете от заболеваемост и смъртност, свързани с много заболявания, включително хипертония 3, захарен диабет 12, инсулт 13, 14, дислипидемия 15, хронично бъбречно заболяване 16, сърдечно-съдови събития и сърдечна недостатъчност 17, 18. Той също така играе важна роля за допринасяне за развитието на подагра, което може да влоши качеството на живот на пациентите 19, 20. Съответно ранната диагностика на пациенти с висок риск от хиперурикемия и превантивната интервенция са от особено значение в медицинската практика.
Затлъстяването е признато за основна причина за голям брой хронични заболявания, а също така е установен рисков фактор за развитие на хиперурикемия. Излишните телесни мазнини и/или затлъстяването могат да бъдат свързани с прекомерно производство на пикочен серум и лоша екскреция на пикочен серум, което води до нарушен метаболизъм на пикочната киселина (UA) или дори особено хиперурикемия Ишидзака и др. установи, че затлъстяването е тясно свързано с високото ниво на серумен UA, особено сред жените в постменопауза 22. Цушима и др. обобщи, че мастната тъкан може да увеличи секрецията на UA при затлъстели лица, което може да допринесе за свръхпроизводството на UA и да доведе до хиперурикемия като последица 23. Въпреки това, хората със затлъстяване могат да се различават в разпределението на телесните мазнини и риска от заболяване, например метаболитно здравословно затлъстяване (MHO), новият фенотип на затлъстяването, характеризиращ се с благоприятни кардиометаболитни профили, макар и да са със затлъстяване, е доброкачествено състояние, което не е свързано с повишен риск от сърдечно-съдови заболявания (ССЗ) заболеваемост и смъртност в сравнение с лица с нормално тегло 24, а някои дори съобщават за защитен ефект от затлъстяване за смъртност от всички причини, ако са придружени от здравословен метаболизъм 25 .
Към днешна дата, доколкото ни е известно, нито едно предишно проучване не е отчитало връзката между висцералната тъкан на затлъстяване, оценена по VAI, и хиперурикемията в китайската популация и дали степента на връзката варира в зависимост от различните метаболитни здравни и фенотипи на затлъстяването; поради това имахме за цел да проучим връзката между висцералното затлъстяване, оценено по VAI, и хиперурикемията сред MHO и други метаболитни фенотипи на затлъстяването в Китай и да сравним възможността за прогнозиране на риска за хиперурикемия между VAI и други индекси на затлъстяването, включително ИТМ, WC, WHtR и тялото индекс на затлъстяване (BAI).
Методи
Проучвайте популация
Сред 11929 участници във вълната на CHNS през 2009 г., настоящото проучване обхваща 3501 мъже и 4131 жени на възраст 18–85 години, за които са налични антропометрични мерки и информация за кръвна проба на гладно.
Антропометрични и биохимични измервания
Антропометрията е измерена по стандартизирани процедури от добре обучени проверяващи. Теглото и височината на тялото са взети с участници боси и в леки дрехи и са измерени с точност съответно до 0,1 кг и 0,1 см. WC се измерва с нееластична лента с точност до 0,1 cm в средната точка между дъното на гръдния кош и върха на гребена на илиаката, след издишване. Обиколката на бедрата беше измерена върху тънки дрехи в точката на максималната обиколка на задните части. И двете обиколки бяха измерени с точност до 0,1 cm. ИТМ се изчислява като тегло (kg), разделено на квадратен ръст (метри). WHtR се изчислява като WC (cm), разделен на височина (cm). BAI се изчислява по формулата 42: \ (> = (\ frac >>>> ^>) - 18 \). Систоличното и диастоличното кръвно налягане (SBP/DBP) се измерват в дясната ръка, като се използват живачни сфигмоманометри. Измерванията бяха събрани в три екземпляра с интервали от 10 минути почивка в седнало положение и техните средства бяха използвани при анализи.
След гладуване през нощта кръвта се събира чрез венепункция и се тества незабавно за глюкоза и хемоглобинA1c (HbA1c). След това пробите от плазма и серум бяха замразени и съхранявани при -86 градуса за по-късен лабораторен анализ. Всички кръвни проби бяха анализирани в национална централна лаборатория в Пекин със строг контрол на качеството. Серумните нива на плазмена глюкоза на гладно (FPG), общ холестерол (TC), HDL-C, TG и UA са измерени с биохимичен автоанализатор. Подробности за лабораторния анализ са докладвани в „CHNS, Ръководство за събиране и обработка на проби“ (http://www.cpc.unc.edu/projects/china/data/datasets/Blood%20Collection%20Protocol_English.pdf) и „Списък на биомаркери и методи, използвани за измерването им “(http://www.cpc.unc.edu/projects/china/data/datasets/Biomarker_Methods.pdf). Оценката на хомеостазния модел на инсулинова резистентност (HOMA-IR) се изчислява по формулата: HOMA-IR = инсулин на гладно (микро-международни единици на милилитър) × FPG (милимола на литър)/22,5. VAI се изчислява, като се използват следните формули, както е предложено от Amato и др. 33: Мъже: \ (> = \ frac >>>)> \ times (\ frac >>) \ times (\ frac> - >>) \); Жени: \ (> = \ frac >>>)> \ times (\ frac >>) \) \ (\ times (\ frac> - >>). \)
Определения за хиперурикемия и метаболитни фенотипи на здравето и затлъстяването
В настоящото ни проучване хиперурикемията се определя като серумен UA ≥420 μmol/L при мъжете и ≥360 μmol/L при жени 43. ИТМ се използва за определяне на затлъстяване и затлъстяване, като се използва гранична точка от 25 kg/m 2, и този праг на ИТМ се основава на дефиницията, препоръчана от Западнотихоокеанското регионално бюро на СЗО (WPRO) за затлъстяване при възрастни Азиатци 44, 45. Приехме два публикувани критерия за определяне на нездравословен метаболитен статус: (1) Дефиниция на панел за лечение на възрастни-III (ATP-III) на метаболитен синдром 46, който има повече от две от следните метаболитни аномалии: SBP/DBP ≥130/85 mmHg или използване на антихипертензивни лекарства, TG ≥1,7 mmol/l или използване на лекарства за понижаване на липидите, FPG ≥5,6 mmol/l или използване на лекарства за диабет, HDL-C ≥1,0 / 1,3 mmol/l за мъже/жени. Критерият WC не е използван поради неговата колинеарност с ИТМ. (2) HOMA индекс 47, където HOMA-IR е в горния квартил на HOMA индекса. Според кръстосаната класификация на категориите ИТМ и метаболитния здравен статус, участниците в проучването са категоризирани в 1 от четирите следните фенотипа: метаболитно здрави, без затлъстяване (MHNO); метаболитно нездравословно затлъстяване (MUNO); MHO; и нездравословно затлъстяване (MUO).
статистически анализи
Резултати
Характеристики на популацията от извадката
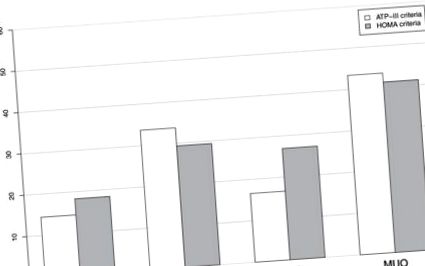
Характеристиките на изследваната популация съгласно фенотипите на метаболитно затлъстяване, основани на критерии ATP-III, са представени в Таблица 1. От 7632 субекта 3780 (49,5%), 1673 (21,9%), 892 (11,7%) и 1287 (16,9%) субекти бяха класифицирани съответно в групите MHNO, MUNO, MHO и MUO. В сравнение с фенотипа MHNO, субектите с MHO са по-склонни да бъдат жени, възрастни, непушачи и непиещи и да показват по-неблагоприятен рисков профил, като повишени нива на BP, FPG, TC и LDL-C. Друг набор от биомаркери, включително TG, BP, FPG, UA и HOMA-IR, са били по-ниски при MHO, отколкото при MUO субекти. В допълнение, в сравнение с индивидите с MUNO, хората с MHO са по-малко склонни да бъдат настоящи пушачи и пиещи, имат по-малко устойчиви на инсулин профили, характеризиращи се с по-ниски нива на BP, TG, FBG и HOMA-IR и по-високи нива на HDL-C, въпреки че има по-висок ИТМ, WC и BAI (Таблица 1).
Разпространение на хиперурикемия в зависимост от метаболитното здраве и състоянието на затлъстяването (фенотипи на метаболитно затлъстяване). Метаболитният здравен статус се дефинира съответно по критерии ATP-III и HOMA; състоянието на затлъстяване се определя от индекса на телесна маса. Съкращения: ATP-III, Панел за лечение на възрастни-III; HOMA, оценка на модела на хомеостазата на инсулинова резистентност; MHNO, метаболитно здрави, без затлъстяване; MUNO, метаболитно нездравословно, без затлъстяване; MHO, метаболитно здравословно затлъстяване; и MUO, метаболитно нездравословно затлъстяване.
ROC анализ
Асоциации между хиперурикемия, VAI и фенотипи на метаболитно здравословно затлъстяване (съгласно два различни критерия)
VAI е значително свързан с хиперурикемия, независимо от критериите, използвани за определяне на метаболитни фенотипове на здравословното затлъстяване (Таблица 4). Коригираните спрямо възрастта и пола OR (95% CI) за хиперурикемия са 1,41 (95% CI 1,16–1,73) за втората, 2,29 (95% CI 1,90–2,76) за третата и 6,93 (95% CI 5,79– 8.29) за четвъртия VAI квартил в сравнение с първия VAI квартил (модел 1), който демонстрира силна връзка между хиперурикемия и VAI. Когато фенотипите на метаболитно затлъстяване бяха включени в модела (модел 2), тази връзка беше отслабена, но все още силно значима (P Таблица 4 Коригирани коефициенти на шансове (OR) и 95% доверителни интервали (CI) за наличие на хиперурикемия, свързана с индекса на висцерална затлъстяване, заедно с фенотипите на метаболитно здраве и затлъстяване, определени съответно от критериите ATP-III и HOMA, съответно.
Освен това, когато се включи коремното затлъстяване в дефиницията на ATP-III (анализ на чувствителността), беше открит много сходен модел: силата на връзката между VAI, фенотипите на затлъстяването и хиперурикемията беше почти идентична при изключване на критерия WC от условията на метаболитни аномалии (Допълнителна таблица 2 ).
Асоциация между VAI и хиперурикемия във всеки слой от фенотипи на метаболитно затлъстяване
ORs за риск от хиперурикемия като функция на VAI в анализ, стратифициран от метаболитно здраве и фенотипове на затлъстяването са представени на фигури 2 и 3. Значителната връзка между VAI и риска от хиперурикемия е била последователно очевидна при всички, с изключение на критериите ATP-III - базиран на MUO фенотип, който отново показва, че съществува значителна връзка, независимо от фенотипа метаболитно здраве-затлъстяване. В сравнение с най-ниския квартил на VAI, OR на риска от хиперурикемия в най-високия квартил е 5,24 (95% CI 3,42–8,02), 5,62 (95% CI 3,31–9,54) и 2,5 (95% CI 1,13–5,55) в MHNO, MUNO и MHO фенотипове, съответно когато са използвани критерии ATP-III. По подобен начин коригираните ORs, свързани с най-високия VAI квартил за хиперурикемия, използвайки критериите HOMA, са били постоянно значими, с 9,96- и 3,85 пъти увеличени рискове във фенотипите MUNO и MUO. Отново, това предполага наличието на значима връзка, която не зависи от фенотипа на метаболитно здраве и затлъстяване. Също така беше забележително, че в сравнение с фенотипите на метаболитно затлъстяване, основани на критерии ATP-III, субектите в 4-ия квартил на VAI постоянно демонстрират по-високи OR за хиперурикемия, когато се дефинират от критерии HOMA.
Коригирани коефициенти на шансове (OR) и 95% доверителни интервали (CI) за риск от хиперурикемия, свързан с индекса на висцерално затлъстяване във всеки фенотип на метаболитно затлъстяване, дефиниран от критериите ATP-III. Вертикалните ленти са 95% CI. Коригираното ИЛ е получено от Модел 3: коригирано за възраст, пол, градско/селско население, статус на пушене, алкохолен статус, бели кръвни клетки, общ холестерол, кръвно налягане, глюкоза и hs-CRP. Съкращения: ATP-III, Панел за лечение на възрастни-III; MHNO, метаболитно здрави, без затлъстяване; MUNO, метаболитно нездравословно, без затлъстяване; MHO, метаболитно здравословно затлъстяване; и MUO, метаболитно нездравословно затлъстяване.
Коригирани коефициенти на шансове (OR) и 95% доверителни интервали (CI) за риск от хиперурикемия, свързан с индекса на висцерално затлъстяване в рамките на всеки фенотип на метаболитно затлъстяване, определен от критериите на HOMA. Вертикалните ленти са 95% CI. Коригираното ИЛ е получено от Модел 3: коригирано за възраст, пол, градско/селско население, статус на пушене, алкохолен статус, бели кръвни клетки, общ холестерол, кръвно налягане, глюкоза и hs-CRP. Съкращения: HOMA, оценка на модела на хомеостазата на инсулинова резистентност; MHNO, метаболитно здрави, без затлъстяване; MUNO, метаболитно нездравословно, без затлъстяване; MHO, метаболитно здравословно затлъстяване; и MUO, метаболитно нездравословно затлъстяване.
След това се опитахме да проучим съответния ефект на състоянието на затлъстяване и въз основа на VAI критерии за метаболитно здравословно състояние и техния съвместен ефект върху OR за риск от хиперурикемия (допълнителна таблица 4). В сравнение с участниците със здравословен ИТМ, участниците със затлъстяване (OR = 1,7, 95% CI: 1,5–1,94) са имали повишен риск от хиперурикемия. Що се отнася до нездравословните метаболитни индивиди, те са изложени на по-висок риск от развитие на хиперурикемия (OR = 2,92, 95% CI: 2,56–3,32) в сравнение с техните метаболитно здрави аналози. По отношение на различните фенотипове на затлъстяването, субектите с MUNO и MHO имат съответно близо 3,2- и 1,6 пъти повишен риск от хиперурикемия, отколкото техните връстници с MHNO. След допълнителни корекции, направени за кръвното налягане и други биомаркери, асоциацията за хиперурикемия все още беше значителна, като съответните ORs от 2,77 (95% CI: 2,38–3,22) и 1,42 (95% CI: 1,09–1,85) за субекти с MUNO и MHO, съответно.
Дискусия
Въпреки тези ограничения обаче, трябва да се подчертаят забележителните силни страни и принос на това проучване. На първо място, въпреки че напречното сечение на нашето проучване не беше оптимален дизайн, успяхме да покажем, че VAI е подходящ предиктор за риск от хиперурикемия. Този убедителен резултат потвърждава тясна връзка на VAI с риска от хиперурикемия, който не зависи от различните фенотипове на затлъстяването. Следователно, надлъжната връзка между VAI и честотата на хиперурикемия изисква разследване. Второ, с големия си размер на извадката, настоящото проучване има разумна статистическа сила, която вероятно отразява реалните асоциации. В допълнение, извадката от изследването е получена от национално представително проучване, което трябва да сведе до минимум възможността за пристрастие при подбора на извадката. Трето, антропометрични измервания и серумен анализ са получени от обучен изследователски персонал, следвайки стандартен протокол, който трябва да изключи ефекта от отклонението на измерването. И накрая, за да сведем до минимум възможността за объркване, коригирахме нашите модели за няколко ковариации, включително възраст, пол, консумация на алкохол, тютюнопушене и други измервания на серума.
В заключение, използвайки национална, базирана на населението китайска кохорта, нашето проучване предоставя убедителни доказателства, че VAI е прост предиктор за хиперурикемия, който е по-добър от измерванията на ИТМ, WC или WHtR. Свързването на VAI с хиперурикемията е значително, особено ако метаболитните фенотипове на здравето и затлъстяването са налице едновременно и не зависи от техните дефиниции. В мащабни проучвания VAI може да се използва като удобен сурогат за измерване на висцерална затлъстяване, което позволява ефективна оценка на различни рискове за здравето сред китайското население.
Препратки
И така, A. & Thorens, B. Транспорт на пикочна киселина и болести. J. Clin. Инвестирам. 120, 1791–1799 (2010).
- Ролята на нивата на индекса на висцерална адипозност при предсказване на наличието на метаболитен синдром и
- Висцерално затлъстяване и риск от метаболитен синдром в индекса на телесната маса Изследването MESA JACC
- Индексът на висцерална затлъстяване е полезен за оценка на ефекта на затлъстяването върху еректилната дисфункция - Akdemir
- Висцерален индекс на затлъстяване Прост инструмент за оценка на кардиометаболитен риск при жени с поликистоза
- Висцерален индекс на затлъстяване Индикатор за дисфункция на мастната тъкан