Резюме
интегрираните ендокринни отговори на поглъщането на храна зависят както от размера, така и от състава на храната и включват освобождаването след интратиновите хормони на глюкагон-подобен пептид-1 (GLP-1) и глюкозозависимия инсулинотропен полипептид (GIP) и островни хормони инсулин и глюкагон (3, 5, 21, 32). Повечето проучвания са фокусирани върху отговорите на орален тест за толерантност към глюкоза, след което нивата на GIP, GLP-1 и инсулин се повишават, докато нивата на глюкагон се потискат (4, 18, 20, 24). Известно е също, че поглъщането на мазнини и протеини стимулира секрецията на GLP-1 и GIP (10, 14, 20, 27). По-малко обаче е известно по отношение на връзките между инкретиновите реакции и промените в нивата на инсулин и глюкагон след хранене или поглъщане на невъглехидратни макроелементи.
GLP-1 и GIP се разграждат бързо от дипептидил пептидаза-4 (DPP-4), която разцепва двете NH2-крайни аминокиселини на пептидите, което ги прави до голяма степен неактивни (9). Точната оценка на връзката между секрецията на инкретиновия хормон и островните хормони изисква измерване както на общата, така и на активната непокътната форма на двата инкретина. Не е известно как това е свързано с приема на макронутриенти. Всъщност наскоро показахме при мишки, че поглъщането на протеини повишава нивата на непокътнати инкретинови хормони в сравнение с поглъщането на въглехидрати и това е свързано с намалена чревна активност на DPP-4 (17).
Целта на това проучване е да се изследва дали инкретиновите хормони допринасят за промени в секрецията на хормони на островчета след поглъщане на невъглехидратни макроелементи при хора. За тази цел изследвахме връзката между инкретините (както активната, така и общата концентрация на двата инкретинови хормона) и хормоните на островчетата през 5-часов период след поглъщане на чиста мазнина или чист протеин като невъглехидратни макронутриенти.
Субекти.
Дванадесет здрави мъже на възраст 20-25 години [средна възраст 22.0 ± 1.8 (SD) години] бяха включени в проучването. Всички те не са били [индекс на телесна маса (ИТМ) 20–25 kg/m 2, среден BMI 22,3 ± 1,2 kg/m 2] с нормална глюкоза на гладно (4,6 ± 0,2 mmol/l), без лична или фамилна анамнеза за диабет или стомашно-чревни заболявания и те не приемаха никакви лекарства. Те бяха вербувани чрез обяви в Лунд, Швеция. Всички субекти са били подложени на орален тест за толерантност към глюкоза (2 g/kg глюкоза), за да се изключи непоносимостта към глюкоза (глюкозата на гладно е била 4,6 ± 0,2 mmol/l, диапазон 3,7–5,4 mmol/l; двучасовата стойност на глюкозата е 5,2 ± 0,2 mmol/l; обхват 4.1–6.6 mmol/l). Изследването е одобрено от комисията по етика на университета в Лунд, Швеция, и всички субекти са дали писмено информирано съгласие преди влизане в проучването.
Протокол за изследване.
На три пъти, разделени от най-малко четири и най-много осем седмици на гладно субекти през нощта, беше осигурен антекубитален венозен катетър. След две изходни проби на -5 и -2 минути, перорално изокалорично (560 kcal), изоволемично (400 ml) натоварване 1) олеинова киселина (0,88 g/kg телесно тегло; вода е погълната след маслото, за да достигне обема от 400 ml; Casa Oilio Sperlonga, Priverna, Италия); 2) протеин, разтворен във вода [Promax protein 85 R (Global, Rødovre, Дания); 2 g/kg телесно тегло, състоящо се от мляко и яйчен протеин; 4,4% въглехидрати и 2% мазнини] или; 3) чиста вода (400 ml) се поглъща в рамките на 5 минути. На 30 минути преди всички тестове, парацетамол (1 g; GlaxoSmithKline, Mölndal, Швеция) се прилага за индиректно определяне на изпразването на стомаха; този метод е показал добра корелация, когато е валидиран спрямо техниките за проследяване (22). Тестовете са извършени по случаен принцип. Взети са кръвни проби през период на изследване от 300 минути.
Анализи.
Статистика.
Показани са средства ± SE, освен ако не е посочено друго. Площите под криви (AUC) са изчислени по правилото на трапеца за надбазалните отговори на инсулин, глюкагон, непокътнат и общ GLP-1 и GIP за ранния (0–30 минути) и късния (30–300 минути) период от време, като има предвид, че AUC за парацетамол е изчислена за периода от 0 до 120 минути. ANOVA с post hoc тест на Tukey се използва за тестове за значимост между променливите, получени по време на поглъщане на мазнини, протеини и вода. Коефициентите на корелация на продукт-момент на Пиърсън са получени за оценка на линейна или квадратична корелация. Извършена е корелация на Spearman между ранния глюкагон и ранните непокътнати GIP отговори и между ранния инсулин и ранните непокътнати GIP отговори.
Глюкоза, инсулин и глюкагон реагират на мазнини, протеини и вода предизвикателство.
Нивата на глюкоза на гладно са били 4,6 ± 0,2 mmol/l и нивата на глюкоза не са се променили значително по време на нито един от тестовете. Нивата на инсулин на гладно бяха 55 ± 3 pmol/l. Нивата на инсулин са непроменени след поглъщане на вода, докато те се увеличават след поглъщане на мазнини и протеини. Повишените плазмени концентрации на инсулин се наблюдават между 30 и 240 минути след поглъщане на мазнини (P = 0,031 спрямо вода) и между 15 и 240 минути след поглъщане на протеин (P = 0,018 спрямо вода). В сравнение с поглъщането на вода, приемането на мазнини и протеини значително увеличава ранните и късните инсулинови реакции (Таблица 1). Тези отговори са по-изразени след приема на протеини, отколкото след поглъщане на мазнини (P 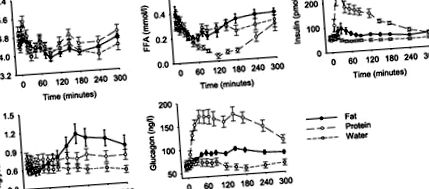
Фиг. 1.Плазмени нива на глюкоза, инсулин, глюкагон, свободна мастна киселина (FFA) и триглицериди преди и по време на 300 минути след поглъщане на мазнини, протеини или вода при здрави мъже доброволци (н = 12). Показани са средства ± SE.
маса 1. Ранен (0–30 минути) и късен (40–300 минути) инсулин, непокътнат глюкагон и общ GLP-1 и непокътнати и общи GIP отговори на поглъщане на вода, мазнини или протеини при здрави доброволци
Стойностите са средни стойности ± SE; н = 12 мъже във всяка група. GLP-1, глюкагон като пептид-1; GIP, глюкозозависим инсулинотропен полипептид.
* P † P ‡ P § Незначителен, P = 0,66.
FFA и триглицеридни отговори на предизвикателство за мазнини, протеини и вода.
Нивата на FFA на гладно са 0,34 ± 0,04 mmol/l. Поглъщането на вода или мазнини не променя нивата на FFA в плазмата, докато те са значително намалени от поглъщането на протеини от минута 60 и нататък (P -1-120 минути -1 след поглъщане на вода. Не е повлиян значително от поглъщането на протеини (11,4 ± 1,1 mmol·l -1-120 min -1), но по-нисък след поглъщане на мазнини (8,6 ± 0,8 mmol·l -1-120 min -1; P = 0,010).
GLP-1 и GIP отговори на предизвикателство за мазнини, протеини и вода.
Нивата на гладно за непокътнат и общ GLP-1 са съответно 3,9 ± 1,4 и 14,8 ± 1,4 pmol/l, а нивата на непокътнатия и общия GIP на гладно са съответно 15,1 ± 1,1 и 16,6 ± 4,3 pmol/l. Поглъщането на вода не променя тези нива, докато непокътнатите и общите нива на GLP-1 и GIP са пропорционално увеличени след поглъщане на мазнини и протеини (P
Фиг. 2.Плазмени нива на непокътнат и общ глюкагоноподобен пептид-1 (GLP-1) и непокътнат и общ глюкозозависим инсулинотропен полипептид (GIP) преди и по време на 300 минути след поглъщане на мазнини, протеини или вода при здрави доброволци от мъжки пол (н = 12). Показани са средства ± SE.
DPP-4 дейност.
Плазмената активност на DPP-4 на гладно е 555 ± 33 mmol · min -1 mg mg протеин -1. Плазмената активност на DPP-4 не се променя значително след поглъщане на вода, мазнини и протеини през целия 5-часов период на изследване (Фиг. 2).
Корелация между реакциите на инкретин и островни хормони.
Ранните инсулинови отговори на поглъщането на протеин корелират с ранния непокътнат GIP отговор (Фиг. 3). Връзката между ранните GIP и инсулиновите отговори беше квадратична регресия (r 2 = 0,86; P 2 = 0,32) (данните не са показани). Не са наблюдавани такива корелации за отговорите на GLP-1 и отговорите на инсулин или глюкагон.
Фиг. 3.Квадратична регресия между ранно (30 минути) увеличение на непокътнатия GIP спрямо увеличаване на инсулина след поглъщане на протеин при здрави мъже доброволци (н = 12).
Терминът "инкретин" се отнася до чревен хормон, който се освобождава от оралната глюкоза и който усилва глюкозо-стимулираната секреция на инсулин (6). Терминът обаче може да бъде по-общ и да се прилага за чревен фактор, стимулиращ ендокринната панкреаса, дори при липса на първична стимулация от глюкоза. Такова стимулиране може да разшири концепцията за регулиране чрез инкретини на функцията на островчетата. Целта на изследването беше да се изследва връзката между инкретин и островни хормони след поглъщане на невъглехидратни макронутриенти.
В това проучване са използвани няколко методологични предпазни мерки в опит да се изясни интерпретацията на възникващи данни. Първо, поглъщането на вода служи като контрол за промени, дължащи се само на стомашно разтягане и на зависими от времето промени по време на периода на изследване. Второ, гликемията не се променя след поглъщане на мазнини или протеини, което позволява оценка на глюкозо-независимите действия на оста инкретин-островче, въпреки че ограничение на настоящото проучване беше, че ние определяхме само нивата на венозна глюкоза. Следователно не можем да изключим промяна в артериалната гликемия. Трето, вземането на кръвни проби беше продължено в продължение на 5 часа за сравнение на дългосрочните ефекти, т.е. много по-дълго, отколкото в по-ранни проучвания (14, 27). За повечето от измерените параметри използването на този 5-часов период на наблюдение ни позволи да наблюдаваме целия ендокринен отговор на поглъщането на макронутриенти. Четвърто, бяха определени както непокътнати, така и общите нива на GIP и GLP-1. Това е важно, като се има предвид, че общите нива на инкретините отразяват секрецията на хормоните, докато непокътнатите нива отразяват активната форма на GLP-1 и GIP (8).
Също така определихме плазмената активност на DPP-4, тъй като този ензим е от значение за физиологията на инкретиновите хормони (10). Следователно забележително наблюдение от това проучване е, че активността на плазмения DPP-4 не се е променила по време на 5-часовите проучвания след предизвикателство с вода, протеини или мазнини. Фактът, че плазмената активност на DPP-4 е стабилна за дълъг период от време при хората, е важна констатация, като се има предвид значението на DPP-4 като регулатор на физиологията на инкретина, функцията на островчетата и толерантността към глюкозата и неговата централна роля в разработването на нови терапевтични средства за диабет (7). В предишно проучване при мишки демонстрирахме различия в отговора на GLP-1 след поглъщане на протеин спрямо мазнини, при което поглъщането на протеин е свързано с намалена активност на чревния DPP-4 и увеличени отговори на активен GLP-1, докато плазменият DPP -4 активност е непроменена (17). Предстои да се проучи дали съществуват подобни разлики при хората, тъй като в това проучване ние определихме плазмената, а не чревната DPP-4 активност.
Секрецията на глюкагон се увеличава при поглъщане на мазнини. Това ново откритие предполага, че липидите стимулират секрецията на глюкагон. Всъщност нивата на глюкагон след поглъщане на мазнини остават повишени за по-дълъг период от време, отколкото нивата на инсулин. Това би подкрепило ролята на инкретините за поддържане на евгликемия в присъствието на освободено от въглехидрати освобождаване на инсулин. Голямото увеличение на GIP през по-късния момент може да бъде свързано с този ефект, тъй като е доказано, че GIP стимулира секрецията на глюкагон (23). GLP-1 може да участва като модулиращ фактор, тъй като GLP-1 инхибира секрецията на глюкагон (23).
Секрецията на инсулин и глюкагон се увеличава от протеините във връзка с дълбокото намаляване на плазмените нива на FFA, което отразява антилиполитичното действие на инсулина. Нивата на GIP и GLP-1 също се повишават от протеините, което предполага, че инкретините могат да допринесат за реакцията на островчетата към поглъщане на мазнини и протеини. Това се потвърждава от тясната връзка между ранното нарастване на непокътнатите нива на GIP и ранното повишаване на инсулина. Тази връзка обаче, макар и да представлява интерес, не установява случайни отношения и изисква допълнително изследване. Изводът, че повишеният GIP може да допринесе за повишения инсулин след поглъщане на протеин, се подкрепя от in vitro проучвания, показващи, че GIP увеличава аминокиселинно стимулираната секреция на инсулин (16). Въпреки че се съобщава, че GIP допринася за отговора на глюкагона към орален протеин (23), в настоящото проучване не се наблюдава такава корелация между тези два процеса. Отново, модулаторните ефекти на GLP-1 върху секрецията на глюкагон са ограничени до инхибиращи ефекти, ако наистина съществуват при нормогликемия (13). Въпреки това, може да съществува отрицателна обратна връзка, при която повишеният глюкагон стимулира секрецията на GLP-1; такава хипотеза трябва да бъде проучена по-подробно.
В обобщение, това проучване на връзките между отговорите на GIP и GLP-1 и тези на инсулина и глюкагона след поглъщане на мазнини и протеини при хора показа, че 1) поглъщането на мазнини и протеини стимулира секрецията на инсулин, глюкагон, GIP и GLP-1, независимо от промените в глюкозата или липидите, 2) ранният GIP отговор на поглъщането на протеини е по-изразен от ранния GIP отговор на поглъщането на мазнини, докато отговорите на GLP-1 са сходни след поглъщането на мазнини и протеини, 3) освобождаването на GIP, но не и на GLP-1, корелира с освобождаването на инсулин и глюкагон след поглъщане на протеин (но не и след мазнини) и 4) плазмената активност на DPP-4 е непроменена след поглъщане на мазнини или протеини. Въз основа на тези констатации заключаваме, че връзката между плазмените нива на GIP, GLP-1 и секрецията на островния хормон е сложна след поглъщане на макроелементи и следователно основната роля на GLP-1 и GIP като медиатори на освобождаването на инсулин е под въпрос след поглъщане на чисти мазнини и протеини.
Проучването е подкрепено от безвъзмездни средства от Novo Nordisk, Шведския съвет за научни изследвания (грант № 6834), регион Skåne и Медицинския факултет на университета в Лунд.
СТЪПКИ
Разходите за публикуване на тази статия бяха покрити отчасти чрез плащането на такси за страница. Следователно статията трябва да бъде маркирана с „реклама”В съответствие с 18 U.S.C. Раздел 1734 единствено, за да посочи този факт.
Благодарни сме на медицинската сестра Густав Дал и на лаборантите Кристина Андерсон, Лилиан Бенгтсон, Лена Квист и Софи Пилгаард за експертна помощ. Благодарим на д-р Дебора Уилямс-Херман за полезни коментари към ръкописа.
Настоящ адрес за R. D. Carr: Merck, Sharp and Dohme, DK-2600 Glostrup, Дания.
- Колко можете да спечелите на седмица, ако пиете протеинови шейкове здравословно хранене SF Gate
- Колко протеини в пилето; Кнедли здравословно хранене SF порта
- Здравословно ли е да се яде протеиново блокче за лека закуска всеки ден
- Здравословно ли е да се пият протеинови шейкове, вместо да се яде през цялото време здравословно хранене SF Gate
- Здравословен или нездравословен е кленовият сироп Протеинът действа
