Резюме
Въведение
Инсултът е водещата причина за дългосрочна инвалидност във Великобритания, главно поради опустошителните ефекти на исхемичното мозъчно увреждане върху сензорно-двигателната система. Пациентите обаче развиват и други усложнения, които имат отрицателно въздействие върху възстановяването и намаляват качеството им на живот. В дните, седмиците и месеците след инсулт, пациентите са изложени на повишен риск от инфекции и развиват усложнения като промени в телесното тегло и апетит, депресия, умора, тревожност и/или когнитивно увреждане [1,2,3,4]. Пациентите с инсулт също са изложени на повишен риск от бъдещи съдови събития [5, 6]. Много малко се знае за основните механизми, свързани с усложненията след инсулт, но дълготрайните промени в метаболизма и енергийния баланс вероятно са ключови [7].
Условия, които влияят върху метаболизма, например затлъстяване и диабет, повишават риска от инсулт и по този начин са често срещани съпътстващи заболявания при пациенти с инсулт [21,22,23,24]. Тези състояния могат също да повлияят на възстановяването след инсулт, например затлъстяването влошава резултата от остър експериментален инсулт [25,26,27,28]. За разлика от клиничните проучвания, които наблюдават възстановяването на пациента в продължение на няколко месеца, повечето от тези проучвания при коморбидни животни са фокусирани върху остри времеви точки (напр. 24–72 часа). В действителност, някои клинични проучвания предполагат, че затлъстяването всъщност може да бъде от полза за възстановяване след инсулт, така нареченият парадокс на затлъстяването, който води до намалена смъртност при пациенти със затлъстяване [14, 29]. Едно предложено биологично обяснение за тези епидемиологични наблюдения е, че излишните запаси от енергия при затлъстяване предпазват от загуба на тегло след инсулт [30], като по този начин предотвратяват вредните ефекти от недохранването върху възстановяването след инсулт. Дали обаче затлъстяването влияе върху загубата на тегло, освобождаването на липиди и адипокин, а неврологичното възстановяване и поведение след експериментален инсулт в дългосрочен план е слабо разбрано.
Целите на това проучване бяха (i) да установят ефекта от експерименталния инсулт върху депресивно и тревожно поведение; дългосрочни вторични усложнения, които често се съобщават при пациенти с инсулт, и (ii) оценяват дали предизвиканите от инсулт продължителни промени в загубата на тегло и адипокин и липиден статус. Освен това определихме въздействието на затлъстяването върху тези резултати.
Методи
Животни
За всички проучвания са използвани мъжки мишки C57BL/6J (Envigo, UK). Всички животни бяха настанени в индивидуално проветриви клетки в стандартни условия на отглеждане (температура 21 ± 2 ° C; влажност 55% ± 5%; 12-часов светлинен/12-часов тъмен цикъл), с достъп до храна и вода ad libitum. На 8-седмична възраст клетки с мишки бяха разпределени на случаен принцип (използвайки функцията „rand ()“ на Microsoft Excel) или към диета с високо съдържание на мазнини (наречена затлъстяла; 60% енергия от мазнини, 58G9, Test Diets®, предоставена от IPS Product Supplies Ltd., UK) или диета с ниско съдържание на мазнини (наречена контрола; 12% енергия от мазнини, 58G7, Test Diets®, IPS Product Supplies Ltd., UK) за 26 седмици преди операцията [25]. Всички експерименти са проведени в съответствие с Закона за животните в Обединеното кралство (Научни процедури) от 1986 г. и одобрени от местния съвет за хуманно отношение към животните и етичен преглед, Университет в Манчестър, Великобритания. Всички отчети за експерименти с животни отговарят на насоките ARRIVE (Animal Research: Reporting in In Vivo Experiments) [31].
Преходна оклузия на средната церебрална артерия
Поради животни, достигнали хуманни крайни точки за страдание на животни [34], няколко животни бяха евтаназирани в рамките на 14 дни след операцията, някои от които бяха евтаназирани преди извършване на ядрено-магнитен резонанс (ЯМР): 8 контрол (от които 3 не са имали ядрено-магнитен резонанс) ден 2), 5 затлъстели мишки (20 минути MCAO) и 4 затлъстели мишки (30 минути MCAO). По едно животно от контролните 30 минути и затлъстелите 20 минути групи бяха изключени поради липса на инсулт. Няма смъртни случаи или усложнения при фалшиви оперирани животни. Крайните числа бяха контролни фиктивни н = 10, контрол MCAO/ход н = 10, затлъстяване н = 10 и затлъстяване MCAO/инсулт (20 минути) н = 4 и са подробно описани в легендите на фигурите.
Количествено определяне на инфарктния обем/оток/мозъчна атрофия
Обемът на инфаркта и отокът се определят количествено на 48 h след MCAO, а мозъчната атрофия на 50-ия ден след операцията чрез MRI. Под анестезия на изофлуран, MRI сканиранията бяха направени със 7T магнит с хоризонтален отвор (Agilent Technologies, UK), свързан към конзола BrukerAvance III (Bruker Biospin, UK), използвайки повърхностна намотка за предаване и приемане. Коронални пилотни изображения бяха получени, за да се определи правилната геометрия и да се локализира мозъкът (използвайки многоетажна градиентна ехопоследователност). T2-претеглените изображения с висока разделителна способност TurboRARE са направени при следните параметри: матрица = 256 × 256, дебелина на среза = 1 mm, разстояние между слоевете = 1 mm, резолюция = 0,0156 cm/пиксел, време за получаване = 5 минути 51 s. Инфарктният обем за 48 часа се изчислява чрез измерване на инфарктната площ върху 8 филийки в ImageJ (NIH, САЩ). Отокът се изчислява като процентна разлика между обемите на ипсилатералното и контралатералното полукълбо. На 50-ия ден атрофията се изчислява като процентно намаление на обема на ипсилатералното полукълбо в сравнение с контралатералното. Анализите на атрофия, обем на инфаркта и оток бяха извършени заслепени за експериментални групи чрез рандомизиране на имена на файлове.
Поведенчески фенотип
Депресивно поведение беше оценено при всички мишки, използвайки тестове за ровене и изграждане на гнезда. За всички тестове беше направено измерване на изходното ниво (ден 0) преди операцията. Локомоторната активност и измерванията за тревожност бяха оценени с помощта на теста на открито. По време на тестовете се играеше бял шум, за да се минимизират слуховите сигнали и всички тестове (с изключение на изграждането на гнездо) бяха проведени по време на светлинната фаза.
Ровене
Способността за изкопаване се оценява при всички мишки в дни 0, 3, 14 и 30, както е адаптирано от Deacon et al. [35]. Накратко, дупки са направени от 20 см парче пластмасова тръба с диаметър 68 мм с единия край, запечатани, 2,5 см машинни винтове са вкарани в другия край, за да се издигне дупката на 3 см от пода на клетката. Мишките бяха привикнали до заравящата арена (празна клетка) в продължение на 30 минути, преди да бъдат въведени тръби, съдържащи 700 g чакъл и оставени за 1 h. След 1 час дупките бяха премахнати и останалият чакъл беше претеглен, за да се изчисли процентът на ровене.
Гнездо сграда
Способността за изграждане на гнездо беше оценена при всички мишки в дни 0, 3, 7, 14 и 30. Мишките бяха настанени поотделно със 140 g дървени стърготини и 20 g строителен материал за гнездо, равномерно разпределени в клетката, и претеглена храна. Мишките бяха оставени за една нощ и бяха направени изображения на гнездата отгоре и отстрани, за да се определи дълбочината и всички мишки се върнаха в домашните клетки. Гнездата бяха оценявани въз основа на стандартизираната скала на Deacon [36], от 0 до 5. Всички изображения бяха заслепени и отбелязани от два независими маркера, средният резултат беше изчислен и допълнително анализиран. Изчислено е и количеството консумирана храна (kCal) през тъмната фаза.
Открито поле
На 37-ия ден мишките се поставят индивидуално в центъра на квадратна непрозрачна кутия от перспекс (45 cm × 30 cm × 45 cm) и тяхното поведение се записва в продължение на 5 минути. Апаратът се почиства със 70% етанол между мишките. Видеозаписите бяха анализирани със софтуера Stoelting ANY-maze v4.9 и за оценка на движението/активността бяха измерени общото разстояние (m), средната скорост (m/s), продължителността (sec) на мобилните епизоди. За оценка на тревожността се измерва времето (сек), прекарано отстрани на арената, и се изчислява% време, прекарано в страните.
Анализ на телесния състав
Съставът на тялото (мастна тъкан и чиста маса) се оценява чрез ядрено-магнитен резонанс (EchoMRI, Echo Medical systems, USA) в дни 0, 1, 3, 5, 7, 10, 14, 21, 42 и 49. Общо телесно тегло животни е взето преди сканирането. Нетната загуба (g) в общото телесно тегло и мастната и слаба маса се изчислява от ден 0 (преди инсулт) и площ под кривата (g × дни) за всички точки от времето.
Подготовка на тъкани и хистология
Анализ на адипокин
Мастната тъкан (от замразена епидидимална мазнина) се хомогенизира в буфер (50 mM Tris-HCl, 150 mM NaCl, 5 mM CaCl2 и 0,02% NaN3), съдържащ 1% Triton-X и протеазен инхибитор коктейл 1 (Calbiochem, UK). Пет милилитра бяха добавени на милиграм тъканна проба (използвани бяха около 100 mg тъкан). След това пробите се хомогенизират с помощта на T-10 Basic ULTRA-TURRAX хомогенизатор (IKA, САЩ), кратко обработени с ултразвук върху лед с ръчен сондажен соникатор (IKA) и оставени на лед за 30 минути. Пробите се центрофугират при 14 000ж за 30 минути (4 ° С). Супернатантът се декантира и съхранява при - 20 ° C. Резистин, адипонектин и лептин в супернатанта на мастната тъкан и плазмата се анализират чрез ензимно-свързан имуносорбентен анализ (ELISA; R&D Systems, UK) съгласно инструкциите на производителя. Концентрациите на адипокин се определят по отношение на съответните стандартни криви. За мастната тъкан концентрацията на протеин се оценява чрез бицинхонинов протеинов анализ (BCA; Pierce Biotechnology, САЩ) и резултатите се изразяват като pg или ng/mg протеин. За плазмата данните са изразени като μg или ng/ml/g тегло на мазнини.
Липиден анализ и анализ на ALT
Плазмените нива на свободни мастни киселини (FFAs; Zen-Bio Inc., САЩ) и триглицериди (BioVision Inc., САЩ) бяха измервани (в mmol/l), като се използват относителните анализи съгласно инструкциите на производителя. Нивата на аланин аминотрансфераза (ALT) бяха измерени в плазмата с помощта на набор за колориметричен анализ на активността (Cayman Chemical, САЩ).
Данни и статистически анализи
Резултати
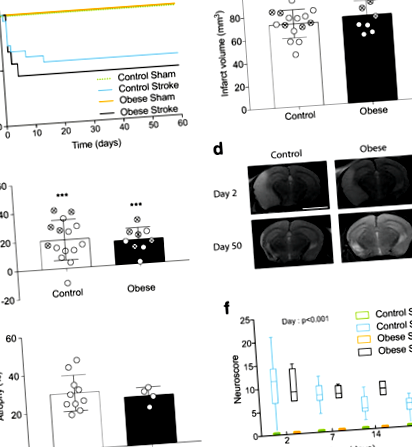
Затлъстелите мишки със същия инфарктен обем не показват разлика в острия резултат
Въпреки че затлъстяването е добре установен рисков фактор за исхемичен инсулт, по-противоречиво е дали затлъстяването влошава резултата при пациентите. По-рано показахме, че с време на оклузия 30 минути, затлъстяването (предизвикано от хранене с високо съдържание на мазнини) увеличава исхемичното увреждане след експериментален инсулт при мишки [25] и тук 30-минутно запушване на MCA също води до тежки исхемични увреждания и всички мишки (н = 4) трябваше да бъде отстранен на ден 2. За да се моделира по-добре клиничната ситуация и да се избегне смущаващият ефект от разликите в обемите на инфаркта между групите, MCA беше запушен за 20 минути при затлъстели мишки, в сравнение с 30 минути при контролни мишки. Няма ефект от фалшивата операция върху оцеляването и в двете групи на диета. Няма значителна разлика в преживяемостта между контролните мишки, подложени на 30-минутна оклузия, и затлъстелите мишки, подложени на 20-минутна оклузия (Фиг. 1а). Също така няма значителна разлика в обема на инфаркта или индуцирания от инсулт оток между групите, измерен чрез ЯМР на 2-ия ден, нито при всички мишки, включително умрелите, нито само при оцелелите (Фиг. 1б, в).
Ядрено-магнитен резонанс на ден 2 (фиг. 1г) показва големи инфаркти, налични както в стриатума, така и в кората, а в някои случаи се простират в хипокампуса и таламуса. На 50-ия ден областите на свръхинтензивност при ЯМР присъстваха предимно във външните кортикални области. При хистологично изследване тези региони бяха пълни с мозъчно-гръбначна течност (CSF) кухини, лишени от мозъчна тъкан. Вентрикуларно разширяване и ипсилатерална хемисферна атрофия също са наблюдавани както при контролни, така и при затлъстели инсулти, без значителна разлика в атрофията между групите (Фиг. 1д).
Сензомоторната функция се оценява надлъжно с помощта на невроскор. Дефицити и в двете групи се наблюдават до 51 дни след инсулт в сравнение с привидни животни (фиг. 1е). Значителен ефект от деня (стр \ (_1 ^ 2 \) = 7.076, стр \ (_1 ^ 2 \) = 5,094, стр \ (_1 ^ 2 \) = 4,563, стр \ (_1 ^ 2 \) = 5.011, стр \ (_3 ^ 2 \) = 13,284, стр Фиг. 2
За да се определи дали има някакви промени в движението или подобно на тревожност поведение, анализ на открито поле е извършен на ден 37. Не е открит ефект от диета или инсулт върху общото изминато разстояние, средната скорост или мобилното време (Фиг. 3а – в) . Наблюдаван е значителен основен ефект от диетата и инсулта върху измерванията на тревожност (време, прекарано в стените на арената), като инсултът увеличава тревожното поведение (Фиг. 3d) Не е наблюдаван ефект на взаимодействие между диета и инсулт по нито един от оценените параметри. За да се оцени работната памет, тестът Y-лабиринт е извършен на 14-ия и 45-ия ден. Не се наблюдава увреждане на паметта след инсулт нито при контролни, нито при затлъстели мишки в сравнение с бутафорни (фиг. S1).
По-голяма и продължителна загуба на мастна тъкан при затлъстели мишки след инсулт
Преди операция (MCAO или фалшива), мишките, хранени с диета с високо съдържание на мазнини, са имали повишено телесно тегло и по-висок процент телесни мазнини, но намалена чиста маса (Таблица 1) в сравнение с мишки, хранени с контролна диета. След експериментален инсулт както контролните, така и затлъстелите мишки показаха продължителна загуба на телесно тегло в сравнение с мишки, подложени на фалшива експлоатация (Фиг. 4а, d, Таблица 1). Загубата на телесно тегло обаче е значително по-голяма при затлъстели мишки. И в двете групи загубата на тегло след инсулт се дължи главно на намаляване на масата на мастната тъкан, като затлъстелите мишки губят значително повече мастна тъкан (фиг. 4б, д). За сравнение, чистата маса намалява само преходно и в двете групи инсулт, а степента на загубата е сходна между контролните и затлъстелите мишки (фиг. 4в, е). И в нито една група обемът на инфаркта не корелира със загуба на тегло (фиг. 4g). На 14-ия ден, когато загубата на тегло достигна най-ниска стойност след инсулт, приемът на храна през нощта беше значително по-голям в сравнение с изходното ниво (ден 0) и при мишки, подложени на контролно хранене и при инсулт, но не се забелязва разлика между ден 0 и 14 при затлъстели мишки ( Фиг. 4h).
Инсултът предизвиква продължителна промяна в производството на адипокин
При мишки, хранени с контролна диета, инсултът индуцира значителни промени в производството на адипокин в рамките на 60 дни след инсулт (Фиг. 5). Концентрациите на резистин са значително увеличени след инсулт в мастната тъкан (фиг. 5а) и плазмата (фиг. 5б), а концентрациите на адипонектин са увеличени в плазмата (фиг. 5в). Концентрациите на лептин не се влияят от инсулт (фиг. 5в, е). Отговорът на адипокин към инсулт е подобен при затлъстели мишки, въпреки че се наблюдават някои диференциални ефекти. Например инсултът не индуцира значително увеличение на резистин в мастната тъкан при затлъстели мишки. Няма значима корелация между степента на загуба на тегло и плазмените нива на адипокин след инсулт при контролни или затлъстели мишки (адипонектин; контрол r 2 = 0,09, затлъстяване r 2 = 0,32: резистин; контрол r 2 = 0,19, затлъстяване r 2 = 0,29: лептин; контрол r 2 = 0,0002, затлъстяване r 2 = 0,35). Самото затлъстяване (при липса на инсулт) също е повлияло на производството на адипокин. Демонстрираните със затлъстяване мишки са намалили концентрациите на резистин и адипонектин в мастната тъкан и плазмата и са увеличили концентрациите на лептин в мастната тъкан.
Инсултът предизвиква продължителна промяна в плазмените липиди и чернодробната функция
При мишки, хранени с контролна диета, на 60 дни след инсулт се наблюдава значително увеличение на плазмените свободни мастни киселини и триглицериди (Фиг. 6а, б). Този ефект не се наблюдава при затлъстели мишки, въпреки че затлъстелите мишки, които са били оперирани, имат по-високи плазмени концентрации на триглицериди. В отговор на инсулт нито при контролни, нито при затлъстели мишки няма значителна корелация между загуба на тегло и свободни мастни киселини в плазмата (контрола r 2 = 0,00002, затлъстяване r 2 = 0,26) или триглицериди (контрол r 2 = 0,05, затлъстяване r 2 = 0,19).
По-рано се съобщава за повишаване на чернодробните триглицериди 24 часа след инсулт при мишки [18]. Следователно черният дроб е взет на 60-ия ден и е оценен хистологично. Чернодробна стеатоза се наблюдава при фалшиво оперирани затлъстели мишки, въпреки че този ефект е загубен при затлъстели мишки, подложени на експериментален инсулт (Фиг. 6в, д). Инсултът няма ефект върху чернодробната стеатоза при контролно хранени мишки. Нараняването на хепатоцитите също беше измерено с помощта на система за точкуване, като увредените хепатоцити бяха идентифицирани чрез тяхната частична или пълна загуба на цитоплазма и кондензирани или подути ядра (фиг. 6г, д). Инсулт, предизвикан от значителни увреждания на хепатоцитите при мишки, хранени с контролна диета, въпреки че значително увреждане на хепатоцитите вече се наблюдава при фалшиво оперирани затлъстели мишки, така че инсултът не увеличава допълнително увреждането на хепатоцитите при затлъстели мишки. ALT беше измерен като индикатор за чернодробната функция и беше по-нисък както при контролните, така и при затлъстелите мишки след инсулт в сравнение с фалшивите групи (фиг. 6е).
Дискусия
Тук наблюдавахме дългосрочните метаболитни и поведенчески ефекти от инсулт и въздействието на затлъстяването при съпътстваща заболеваемост и демонстрирахме в контрола на мъжки мишки дълготрайни промени, които биха могли да посочат риск за бъдещо съдово здраве.
В обобщение, пациентите с инсулт често развиват вторични усложнения през седмиците и месеците след инсулт, които влияят негативно на тяхното възстановяване и качеството на живот. Тези усложнения обаче не са добре проучени предклинично и механизмите им са слабо разбрани. Тук идентифицирахме нови поведенчески инструменти за оценка на вторични усложнения на инсулт като депресия. Също така бяхме първите, които наблюдавахме дългосрочните ефекти на инсулта върху метаболитните маркери. По-конкретно, нашите данни показват, че както при затлъстелите, така и при контролните мишки, чистата маса е временно намалена само след инсулт, докато ние наблюдаваме дългосрочен ефект върху мастната маса. Това намаляване на мастната маса при контролните мишки е придружено от промени в адипокините и липидите и потенциални промени в чернодробната функция. Бъдещата работа трябва да определи дали тези находки при мъжки мишки се наблюдават и при жени и как те се превеждат при пациенти с инсулт. Тези данни обаче предполагат, че инсултът причинява траен ефект върху метаболизма, който може да допринесе за повишения риск от повтарящи се съдови събития, наблюдавани при пациенти с инсулт.
Препратки
Nakling AE, Aarsland D, Næss H, Wollschlaeger D, Fladby T, Hofstad H, et al. Когнитивни дефицити при пациенти с хроничен инсулт: невропсихологична оценка, депресия и самоотчети. Dement Geriatr Cogn Dis Extra. 2017; 7: 283–96.
Shi K, Wood K, Shi F-D, Wang X, Liu Q. Инсулт-индуцирана имуносупресия и инфекция след инсулт. Инсулт Vasc Neurol. 2018; 3: 34–41.
- Ново проучване предполага, че хроничната употреба на кокаин причинява дълбоки метаболитни промени, намалявайки телесните s
- След бременността как тялото ви се променя, след като спрете да кърмите
- Ефектът на кофеина и албутерола върху телесния състав и скоростта на метаболизма
- Разход на енергия в покой, състав на тялото и наднормено тегло при затлъстелите - ScienceDirect
- Ефектите от Рамаданското гладуване върху състава на тялото Shiraz E-Medical Journal Пълен текст