Субекти
Резюме
Използвахме мулти-омически профилиращ подход за изследване на потискащите ефекти на обогатени с 2% Wolfberry (WOL) диети върху индуциран от декстран натриев сулфат (DSS) колит при мишки. Забелязано е, че при мишки, хранени с диета WOL, индексът на активност на заболяването, съкращаване на дебелото черво, плазмените концентрации на матричната металопротеиназа-3 и относителното тегло на мезентериалните мазнини са значително подобрени в сравнение с DSS групата. Резултати от профили на транскриптом на дебелото черво и протеоми показват, че добавянето на WOL значително подобрява експресията на гени и протеини, свързани с целостта на лигавичната стена на дебелото черво и възпалението на дебелото черво. Въз основа на данните за чернодробния транскриптом, протеоми и метаболоми, гените, участващи в метаболизма на мастните киселини, протеините, участващи в възпалението и метаболитите, свързани с гликолизата, са били понижени при WOL мишки, което е довело до понижено възпаление и промените в тези молекули може да са довели до подобряване на телесното тегло загуба. По този начин интегрираният нутригеномичен подход разкри молекулярните механизми, лежащи в основата на мелиоративния ефект от консумацията на цели WOL плодове върху възпалително заболяване на червата.
Въведение
Възпалително заболяване на червата (IBD) е група инвалидизиращи възпалителни заболявания, които засягат стомашно-чревния тракт. IBD включва болестта на Crohn (CD) и улцерозен колит (UC). Засегнатите пациенти изпитват различни симптоми, свързани с възпаление на червата, вариращи от коремна болка и диария до ректално кървене и загуба на тегло. Лекарите обикновено препоръчват използването на противовъзпалителни стероиди или имуносупресори за намаляване на възпалението 1. Диетични интервенции 2 с използване на нутрицевтици 3, пробиотици, пребиотици 2; интервенции в начина на живот и напоследък трансплантацията на фекална микробиота 4 често се използва като алтернатива на медицинската терапия при лечение на IBD 5,6,7 .
Въпреки че има много доклади за съставките на WOL, всъщност има много малко изследвания, използващи цяла WOL, въпреки че често се консумира цяла в кухня, десерт или влива в гореща вода. В това проучване използвахме многоизмерен подход, основан на нутригеномика, който се използва за определяне на ефектите на диетичните сигнали за цялостна хранителна интервенция на WOL върху състоянието на гените, протеините и метаболитите. Опитахме се да идентифицираме диетичния подпис на взаимодействията с WOL при миши гостоприемници и да изясним потенциалните молекулни механизми в DSS-индуциран колит миши модел чрез изчерпателни оценки на транскриптома, протеома и метаболома не само с помощта на дебелото черво, но и чернодробните тъкани, което е важно метаболитна електроцентрала в гостоприемника.
Резултати
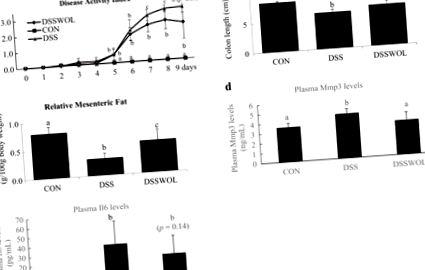
Основни характеристики
Не са наблюдавани значителни разлики в приема на храна преди DSS (CON: 27,0 ± 2,3; DSS: 27,7 ± 4,7; DSSWOL: 24,8 ± 2,3 g) или след приложение на DSS (CON: 40,6 ± 9,9; DSS: 37,1 ± 7,9; DSSWOL: 32,3 ± 2,3 g). Приемът на вода през периода на администриране на DSS е както следва: CON: 26,5 ± 0,6; DSS: 24,2 ± 1,5; DSSWOL: 24,8 ± 1,2 ml. По този начин приемането на DSS от мишките DSS и DSSWOL не се различава значително. Мишките, които бяха предизвикани с DSS, се представиха със значителни патологични промени, включително тежка загуба на телесно тегло, наличие на фекална окултна кръв и диария, което доведе до значително увеличение на DAI в сравнение с групата CON (Фиг. 1а).
Добавянето на WOL потиска тези патологични състояния на IBD, което води до намаляване на стойностите на DAI от ден 7 до ден 9 (Фиг. 1а). Мишките от групата DSS имат значително по-къси дължини на дебелото черво (фиг. 1b) и по-ниско тегло на мезентериалната мазнина (фиг. 1в) в сравнение с контролната група и WOL значително подобрява тези намаления. Плазмените нива на Mmp3 (фиг. 1г) са значително увеличени чрез администриране на DSS и интервенцията WOL значително смекчава тези повишения. Концентрациите на Il6 в плазмата (фиг. 1д) обикновено се подобряват чрез добавяне на WOL.
Анализ на микрочипове на дебелото черво
Messenger РНК за 2189 гена са диференцирано експресирани в DSS мишки в сравнение с контролите. Сред тези гени 271 гена бяха регулирани в DSSWOL и 207 гена бяха понижени в сравнение с DSS (допълнителна таблица 1). WOL намалява нивата на генна експресия на тъканния инхибитор на металопротеиназа 1 (Timp1) и хемокини, принадлежащи към хемокиновия (C-C мотив) лиганд (Ccl): Ccl1 и Ccl5. В допълнение, по-ниско ниво на експресия на възпалителния цитокин на интерлевкин 1 рецептор тип 1 (Il1r1) бе наблюдаван. Други регулирани надолу гени включват секретиран фосфопротеин 1 (Spp1), хаптоглобин (Hp) и простагландин-ендопероксид синтаза 2 (Ptgs2). Някои от регулираните надолу гени са свързани с разграждането на извънклетъчния матрикс и ремоделиращата матрица металопротеиназа (MMP), т.е., Mmp3, Mmp13 и Mmp10; клъстер на диференциация (Cd163) и Il6, бяха избрани за валидиране чрез RT-PCR в реално време. DSS значително регулира изразите на Mmp10, Hp, Il6, Mmp3, и Timp1. Добавянето на WOL значително отслабва тези увеличения в Hp, Timp1, и Mmp10 и има тенденция да подобрява тези регулации в Il6, Cd163, и Mmp3 (Фиг. 2).
Анализ на чернодробните микрочипове
В черния дроб 12 838 гена са диференцирано експресирани в DSS в сравнение с контролите. В групата на DSSWOL 1630 гена са регулирани с повишено регулиране и 1793 гена са намалени в сравнение с мишките DSS (допълнителна таблица 2). Добавянето на WOL намалява експресията на гени за молекули на ракови маркери като серумен амилоид А1 (Saa1), c-юни (Юни) и S100 калций-свързващ протеин A8 (S100a8). В допълнение, гени, участващи в синтеза на мастни киселини, т.е. стеароил-КоА десатураза-1 (Scd1), Член на семейство ELOVL 6, удължаване на дълговерижни мастни киселини (Еловл6), синтаза на мастни киселини (Фас) и NADP-зависим ябълчен ензим (Аз1) бяха свръхрегулирани. Нивото на генна експресия на метионин аденозилтрансфераза II, алфа (Mat2a), който участва в пътя за рециклиране на метионин, е намален. Въз основа на резултатите от валидирането на генната експресия чрез RT-PCR в реално време (фиг. 3), DSS значително регулира експресията на Еловл6, Фас, Юни, Подложка2, Аз1, Saa1, Scd1, и S100A8, и добавките с WOL значително повлияват експресията на тези гени - с изключение на Юни и Saa1, върху които WOL има тенденция да има потискащ ефект.
Сравнителен анализ на протеомиката на черния дроб и дебелото черво от iTRAQ
Определихме глобалната протеинова експресия в трите групи, използвайки iTRAQ маркираща количествена протеомна технология. Включихме 1,2- или 0,8-кратно ограничение от уникални протеини, количествено определени на ниво на доверие> 95%, когато класифицирахме протеините като силно нагоре или надолу регулирани.
В черния дроб идентифицирахме 222 протеина, от които 58 протеини бяха понижени и 75 протеини бяха регулирани в DSSWOL в сравнение с групата DSS (допълнителна таблица 3). Добавянето на WOL намалява нивата на протеини, за които е известно, че често се регулират при пациенти с IBD: калретикулин (Calr) 33, серотрансферин (Trfe) 34, анексин A5 (Anxa5) 35, бета-енолаза (Enob) 36, транстиретин (Tthy) 37, селен-свързващ протеин 1 (Sbp1) 38 и протеин-глутамин гама-глутамилтрансфераза 2 (Tgm2) 39; протеини, участващи във фиброзата: фибриноген бета верига (Fibb) и фибриноген гама верига (Fibg) 40; и свързани с възпалението протеини: хистон H4 (H4), супероксиддисмутаза [Cu-Zn] (Sodc) 41, цистатин-B (Cytb) 42, протеин от 10 kDa топлинен шок, митохондрии (Ch10) 43, тиоредоксин (Thio) 44 и алфа-енолаза (Enoa) 45 .
В дебелото черво открихме общо 2111 протеина, от които 271 бяха регулирани нагоре и 217 бяха понижени в групата DSSWOL в сравнение с групата DSS (допълнителна таблица 4). Добавянето на WOL повишава нивата на няколко протеина, включително трилистник фактор 3 (Tff3), протеин, участващ в интегритета на плътно свързване на червата и защита на слуз 46; преден градиентен протеин 2 хомолог (Agr2) 47; свързаният с възпалението протеин карбоксипептидаза Е (Cbpe) 48; и протеин, свързан с възстановяването на ДНК, 40S рибозомен протеин S3 (Rs3) 49,50 .
В сравнение с DSS групата, надолу регулираните протеини в DSSWOL групата са: отрицателен модулатор на левкоцитни възпалителни отговори, тирозин-протеинова фосфатаза, не-рецепторен тип субстрат 1 (Shps1) 51; белтък-маркер при пациенти с IBD, изоформа S-gicerin на гликопротеин на клетъчна повърхност MUC18 (Muc18) 52; протеин на IBD рисков фактор, аполипопротеин Е (Apoe) 53; молекула за адхезия на нервни клетки L1 (L1cam) 54; протеин, свързан с възпаление и устойчивост на нараняване на тъканите, церулоплазмин (Ceru) 55; два протеина, участващи в прогресията на тумора, анексин а3 (Anxa3) 56,57 и комплемент C3 (Co3) 58; и асоцииран с неутрофилна желатиназа липокалин (Ngal) 59 .
Оценка на плазмата и чернодробния метаболом
За да оценим метаболитните промени чрез консумация на WOL, направихме чернодробни и плазмени метаболомни анализи на групите CON, DSS и DSSWOL въз основа на техните m/z стойности и времена на миграция. Броят на метаболитите, открити в чернодробната тъкан и плазмата, са съответно 131 и 117. Нормализирани метаболомични данни бяха използвани за йерархично клъстериране за представяне на топлинна карта и допълнително анализирани чрез анализ на главните компоненти (PCA), използвайки MeV софтуер.
Въпреки че не са наблюдавани очевидни вариации между групите в топлинната карта (фиг. 4а, б), се образуват отделни клъстери между групите CON, DSS и DSSWOL (фиг. 4в, г). Десет метаболита в черния дроб (допълнителна таблица 5а) и четири метаболита (допълнителна таблица 5б) в плазмата са значително регулирани от прилагането на DSS и впоследствие подобрени чрез добавяне на WOL. Тези метаболити включват чернодробни метаболити, участващи в пентозофосфатния път, т.е., глюкозо-6-фосфат дехидрогеназа (G6P) и фруктоза 6-фосфат (F6P); и в пуриновия метаболизъм, т.е. аденозин монофосфат (AMP), инозин монофосфат (IMP) и гуанозин монофосфат (GMP). Другите метаболити са две молекули, свързани с пътя за рециклиране на метионин, глутатион и S-лактоилглутатион и продукт на разграждане на колагена, т.е. хидроксипролин. Повишеното регулиране на 2-хидроксиизобутират, додеканоат и аргинин се наблюдава в профилите на плазмените метаболоми.
Не се наблюдава отчетлива разлика между трите групи в топлинната карта (а, б), но при CONA, DSS и DSSWOL при анализа на данните от PCA са формирани различни клъстери (° С, д) както на плазмените, така и на чернодробните метаболити.
Дискусия
Ние изследвахме изчерпателно въздействието на добавките с WOL върху възпалените транскриптоми и протеоми на дебелото черво и черния дроб, както и плазмените и чернодробните метаболомни профили. Нашите резултати разкриха, че хранителните добавки WOL могат да подобрят причиненото от DSS нараняване и възпаление на дебелото черво и да подобрят защитата на чревната бариера чрез поддържане на целостта на лигавицата, както е описано по-долу. Нашите открития разкриват също така модулирани метаболитни пътища и потенциални ключови центрове за регулиране на гени/протеини, които могат да регулират тези процеси. Нашият експериментален подход за хранене с WOL преди предизвикателството на DSS може да се счита за подобен на моделите на консумация на различни хранителни продукти от пациенти с IBD по време на променлива активност на болестта 60. Доколкото ни е известно, това е безпрецедентен доклад за използването на чист цял WOL при IBD, използващ цялостен нутригеномичен подход, особено в UC.
Нашите данни за експресията на гена на дебелото черво разкриват, че WOL интервенцията потиска възпалението на дебелото черво. Възпалителните реакции при IBD обикновено започват с инфилтрация на неутрофили и макрофаги 61, а след това смес от възпалителни цитокини, включително IL6, IL1 и TNF 62, се секретира. Това води до производството на протеази, свободни радикали и металопротеинази, които са отговорни за съкращаването на дебелото черво, разграждането на тъканите и развитието на лезиите 63. В настоящото проучване глобалната експресия на гена на дебелото черво и валидирането на RT-PCR разкриха тенденция към понижаване на регулацията на Il6, и неговите фактори надолу по веригата, Mmp10 и Hp, бяха значително намалени чрез намеса на WOL. Изразът на Hp е свързано с възпаление също е значително намалено при възпалителни състояния 64. Намаляването на регулацията на протеините, свързани с възпаление и увреждане на тъканите (Ceru и Shps1) и гените Hp, Mmp10, Timp1 в нашата група DSSWOL предполага, че интервенцията WOL е намалила степента на възпаление в дебелото черво, индуцирано от DSS.
Приемът на WOL запазва целостта на лигавичната бариера, която е важен компонент на здравословното черво, тъй като представлява първата защитна линия между луминалното съдържание и тъканите на гостоприемника. Повредената лигавична бариера позволява микробни взаимодействия с лигавицата на дебелото черво, което може да стимулира вродените и възпалителни имунни реакции на гостоприемника. Намаляване на регулацията на свързаните с фиброза протеини, т.е. Fibb и Fibg 65, и гени на металопротеинази се наблюдава при DSSWOL мишки в сравнение с DSS. Значително намаленото ниво на изразяване на Mmp10 и плазмен Mmp3 чрез WOL намеса могат да помогнат за предотвратяване на разграждането на широк спектър от извънклетъчни компоненти, включително протеогликани, тип II, тип IV, тип IX и тип XI колагени, ламинин и фибронектин 63, като по този начин инхибира деградацията на лигавичната стена, която е проявява се при пациенти с IBD 66 .
Въпреки относително краткия период на администриране на DSS, WOL интервенцията подобри нивата на експресия на свързаните с рака протеини в дебелото черво (Anxa3 и Co3), както и онкогенните чернодробни гени (Saa1, Юни и S100a8), както се наблюдава при мишките DSSWOL в сравнение с групата DSSWOL. Съобщава се, че 2% от случаите на IBD прогресират до колоректален рак (CRC) и представляват 15% от смъртните случаи, свързани с CRC. Axelrad et al. и Pedersen et al. също така съобщава, че при пациенти с IBD дългосрочното излагане на хронично възпаление е основният рисков фактор за развитие на CRC, както и при други видове рак 72,73. Чрез намаляване на експресията на тези маркери и протеини, свързани с рак, често експресирани при пациенти с IBD (Muc18, Apoe, L1cam), WOL интервенцията може да забави появата на CRD, свързана с IBD.
Приемът на WOL също подобрява метаболитните пътища, участващи в гликолизата. По време на възпаление многобройни имунни клетки се активират и мигрират към възпалителни лезии. Фагоцитозата, унищожаването на бактерии и стимулираната клетъчна пролиферация имат високи енергийни нужди 74. Неутрофилите, макрофагите и дендритните клетки използват предимно гликолитични пътища за получаване на енергия, докато В и Т клетките използват предимно аминокиселини, глюкоза и липиди за генериране на енергия по време на окислително фосфорилиране. Храненето и кислородът бързо се ограничават или изчерпват в тъканите с високи възпалителни лезии и предизвикани имунни дейности 75. Чернодробните метаболити, участващи в гликолизата, т.е. G6P и F6P, са значително регулирани чрез добавяне на WOL, което показва, че WOL играе активна роля в гликолитичното възстановяване. Значителна регулация на гените, участващи в метаболизма на мастните киселини (Фас, Аз1, Scd1, и Еловл6) чрез добавяне на WOL, както и метаболитните промени в гликолизата, биха могли да допринесат за подобрената загуба на телесно тегло при мишките DSSWOL, предизвикана от прилагането на DSS. Това наблюдение е в съгласие с намалената експресия на възпалителни протеини в черния дроб, като H4, Sodc и Cytb.
Както беше демонстрирано по-горе, ние използвахме нутригеномичен подход, за да получим основани на доказателства прозрения за ефекта на цялостното добавяне на WOL върху IBD (фиг. 5). Интегрираните профили на транскриптома на дебелото черво и протеома също показват, че добавянето на 2% WOL при мишки, предизвикани от DSS, значително подобрява възпалението в дебелото черво, което поддържа целостта на лигавичната стена на дебелото черво и може да е предотвратило рисковите фактори, водещи до патогенезата към CRC. Данните за чернодробния транскриптом, протеоми и метаболоми показват, че при мишки, хранени с WOL, гените, участващи в метаболизма на мастните киселини, протеините, участващи в възпалението, и метаболитите, свързани с гликолизата, са подобрени, което води до понижено възпаление и може да допринесе за подобренията в тялото тегло. Взети заедно, нашите открития предоставят интегрирана информация за нутригеномиката относно ефекта на WOL, традиционен китайски плод, върху колитичен модел. Нашите резултати могат да се очакват въздействащи, тъй като ежедневното включване на WOL в диета може да бъде диетична стратегия за поддържане на здравето на червата и намаляване на тежестта на заболяването при патологии, свързани с увреждане на лигавицата.
Схематично обобщение на интегрираното омическо профилиране на WOL интервенция в DSS-колитичния модел на мишката.
- Безопасен ли е натриевият бензоат за ядене
- ЛЕВОТИРОКСИН НАТРИЙ Странични ефекти, Отзиви от пациенти
- Високо натриев; Задържане на вода Здравословно хранене SF Gate
- HITACHI 2SB656 TO-3 Силициеви PNP силови транзистори Други интегрални схеми Бизнес и индустрия
- Начало - Gillian McKeith Здравословно хранене, отслабване, профилиране на здравето