Винченцо Милячо
1 Катедра по химия и биология „Adolfo Zambelli“, Университет в Салерно, 84084 Fisciano (Sa), Италия; ti.asinu@oiccailgimv (V.M.); ti.asinu@ittenoill (L.L.)
Лила Лионети
1 Катедра по химия и биология „Adolfo Zambelli“, Университет в Салерно, 84084 Fisciano (Sa), Италия; ti.asinu@oiccailgimv (V.M.); ti.asinu@ittenoill (L.L.)
Розалба Пути
2 Катедра по биология, Университет Федерико II, 80126 Наполи, Италия; [email protected]
Росария Скудиеро
2 Катедра по биология, Университет Федерико II, 80126 Наполи, Италия; [email protected]
Резюме
1. Мултифункционални роли на металотиоини
От откриването им в кората на конете през 1956 г. [1], металотиоините (MTs) са известни особено със своите детоксикиращи свойства срещу токсични тежки метали [2]. Всъщност те принадлежат към многогенетично семейство протеини, способни да образуват метало-тиолатни връзки благодарение на големия брой цистеини, присъстващи в тяхната аминокиселинна верига (около 30% от общите аминокиселини) [3]. Цитозолните протеини се разпространяват повсеместно в почти всички видове животински клетки [4,5]; при физиологични условия те се свързват с основни метали, като цинк (Zn) и мед (Cu), като по този начин образуват резерв от тези микроелементи, налични веднага в клетките; те също така проявяват висок афинитет към токсични тежки метали без никаква биологична функция, като живак (Hg), олово (Pb) и кадмий (Cd) [6]. Основният отличителен белег за осъществяването на тази детоксикираща функция е способността на МТ да бъдат индуцирани от множество видове тежки метали на ниво транскрипция, благодарение на наличието на множество копия на метално-реагиращи елементи (MRE) в горната част на МТ-кодиращите гени [7,8].
2. Металотионеини и DDT метаболити
DDT [1,1 ′ - (2,2,2-трихлоретан-1,1-диил) бис (4-хлоробензен)], известен също като дихлордифенилтрихлоретан, е синтетичен хлорорганичен евтин пестицид, широко използван в миналото срещу малария [34,35]. Въпреки че е забранено в богатите индустриализирани страни от 70-те години на миналия век, замърсяването с ДДТ на почвите е особено широко разпространено поради своята устойчивост [36]. Освен това той все още се използва в развиващите се страни, където маларията и други болести, предавани от насекоми, са ендемични [37]; ефектът на скакалец допринася за дисперсията на DDT на всички континенти [38].
Веднъж попаднал в почвата, той частично се метаболизира до дихлордифенилдихлороетилен (DDE) и дихлордифенилетан (DDD) [39]; трите различни формулировки могат да влязат в хранителната верига, достигайки върха и причинявайки клетъчни заболявания при много животински видове [40]. Като липофилен, DDT и неговите производни се натрупват в мастните тъкани [41]; в резултат на това хората, обитаващи по-богатите индустриализирани страни, които са забранили ДДТ, са равномерно изложени, тъй като те обикновено следват висококалорични, богати на месо диети [42].
Доказано е, че присъствието на ДДТ и неговите метаболити в животински тъкани причинява оксидативен стрес и увреждане на митохондриите [43,44,45,46,47,48], докато има малко данни, често противоречиви, за ефектите на тези вещества върху експресията и синтеза на МТ. Изследване, проведено от Ben Miled и колеги [49], показва увеличение на съдържанието на МТ в хепатоцитите на плъхове, получаващи еднократна интраперитонеална инжекция от 100 mg DDT/kg телесно тегло (телесно тегло). В бъбреците и тестисите на плъхове, получаващи една и съща доза DDT в продължение на десет дни, съдържанието на МТ значително намалява [45,46].
Настоящият преглед се фокусира върху резултатите, получени от проучванията, които имат за цел да изяснят възможното участие на МТ в клетъчните отговори, предизвикани от DDE, основния метаболит на DDT, когато се прилага перорално. Индуцираните от DDE промени в експресията и синтеза на МТ се оценяват в три органа на плъхове: в черния дроб и бъбреците, основните органи, участващи в детоксикацията и екскрецията на токсични вещества, за които е известно, че са богати на МТ [50], и в тестисите, кладенец -изучена цел на токсичното действие на DDT и DDE [45,51,52]. Знаейки ефекта от интраперитонеално прилагания DDT върху синтеза на МТ в бъбреците и тестисите на плъхове [45,46], ефектът върху клетъчната локализация на MTs, експресията на гените и синтеза на протеини беше определен след 4-седмично перорално приложение на DDE (10 mg/kg телесно тегло), добавена към нормалнокалорична диета (10,6% мазнини J/J, 15,47 KJ/g) или към висококалорична диета (45% мазнини J/J, 19,88 KJ/g), богата на наситени мастни киселини и способна за насърчаване на натрупването на DDE в клетките.
Пероралното приложение на DDE в тази доза в продължение на 4 или 6 седмици не влияе върху физическото развитие, половото съзряване и серумните метаболитни параметри на мъжки плъхове [53].
3. Ефект на DDE върху експресията, синтеза и локализацията на МТ в тъкани на плъхове
3.1. Черен дроб
Конститутивното количество MT mRNAs в тъкани на мъжки плъхове Wistar на възраст 2 месеца се определя чрез PCR анализ в реално време [54,55,56]. Използваните МТ праймери позволяват да се усилват и количествено определят едновременно както МТ1, така и МТ2 изоформите [55,56]. Както се очаква, MT транскриптите присъстват във всичките три изследвани тъкани, като редът на изобилие от транскрипти е както следва: черен дроб> тестиси> бъбреци. По-специално, относителните количества МТ транскрипти са почти сравними между черния дроб и тестисите; в бъбреците нивото на иРНК на MT е около 5 пъти по-ниско. Подобен сценарий беше открит и за MT протеини, чието относително количество в трите различни органа беше оценено при извършване на Western blot анализ [56].
След 4-седмично перорално приложение на DDE се наблюдават значителни промени в съдържанието на МТ транскрипт в тъканите на плъхове, също в зависимост от диетата.
При черния дроб само хиперлипидемичната диета води до драстично намаляване на МТ транскриптите до по-малко от 1/3 от количеството, определено при плъхове, хранени със стандартна диета (плъхове Ctr); в последния, DDE администрацията също успя да предизвика понижаване на регулацията на МТ гените в хепатоцитите (Ctr + DDE плъхове). Еквивалентно количество MT транскрипти е открито в черния дроб на плъховете, хранени с високомаслена диета (HF плъхове) и при плъховете с високомаслена диета плюс перорално приложение на DDE (HF + DDE плъхове).
Western blot анализът открива подобен сценарий за съдържание на МТ протеин в чернодробния хомогенат, като най-високото ниво на МТ се наблюдава при плъхове, хранени с нормокалорична диета (група Ctr); най-ниското съдържание на MT протеин е открито в черния дроб на плъховете, принадлежащи към групата HF + DDE (Таблица 1).
маса 1
Експресия на ген на металлотионеин и нива на протеин в тъкани на плъхове, лекувани с р, р-дихлородифенилдихлороетилен (р, р-ДДЕ) или р, р-дихлородифенилтрихлоретан (р, р-ДДТ), самостоятелно или в комбинация с диета с високо съдържание на мазнини ).
NTD: нетоксична доза (10 mg/kg телесно тегло, прилагана през устата); HD: високи дози (50–100 mg/kg телесно тегло, интраперитонеално инжектиране).
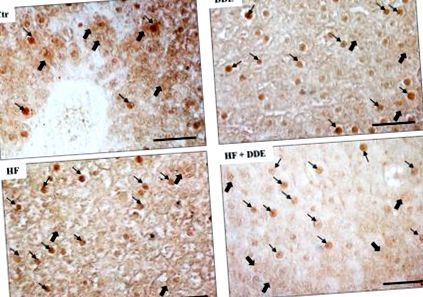
Забележително е, че увеличаването на приема на наситени мастни киселини и прилагането на DDE променят вътреклетъчната локализация на MT протеини в хепатоцитите, както е показано чрез имуноцитохимичен анализ (Фигура 1). При контролните плъхове позитивността към МТ е локализирана най-вече в цитозола и е по-малко очевидна в ядрата; при третирани с HF и DDE плъхове оцветяването е с ниско съдържание на цитозол и високо съдържание на ядра на хепатоцити. Тези резултати бяха потвърдени чрез Western blot анализ на цитозолни и ядрени екстракти.
Локализация на металотионеин (MT) в черния дроб на плъхове. При контролни животни (Ctr) имуноцитохимичният сигнал (кафяви области) се открива в клетъчната цитоплазма (дебели стрелки) и в някои ядра (тънки стрелки). При всички лекувани животни имунореактивният сигнал се открива в по-голям брой ядра, докато цитозолната локализация на МТ е по-малко разпространена. СН, диета с високо съдържание на мазнини. Лента = 50 µm. Адаптирано от Migliaccio et al., 2019 [56].
Ядрената транслокация на МТ протеини е настъпила в хепатоцитите на всички лекувани плъхове, като забележимо увеличение е получено при плъхове, получаващи само орално приложение на DDE (Фигура 2).
Както в случая с черния дроб, имуноцитохимичните (Фигура 3) и Western blot анализите (Фигура 4) на бъбреците също показват, че прилагането на DDE води до промяна в клетъчното разпределение на МТ: протеинът, предимно цитозолен при нормални условия, изглежда се намира главно в ядрото.
Локализация на металотионеин в бъбреците на плъхове. При контролните животни имуноцитохимичният сигнал се открива в цитоплазмата (дебели стрелки) и в редки ядра (тънки стрелки). При бъбреците на плъховете, хранени с високомаслена диета (HF), имунооцветяването е по-слабо, но няколко ядра са очевидно положителни. При лекуваните с DDE животни, независимо от диетата, се забелязва подчертана положителност в цитозола и в много ядра. Ядрата бяха оцветени с хематоксилин. Лента = 50 µm. Адаптирано от Migliaccio et al., 2019 [56].
Имунолокализацията на MT протеини в тестисите потвърждава резултатите, получени с Western blot анализ. В тестисите на контролните плъхове имунооцветяването е локализирано по цялата повърхност на семенния епител; обаче базалното отделение, направено от сперматогония, сперматоцити и клетки на Сертоли, е по-интензивно оцветено, както и сперматозоидите, образуващи адлуминалния ръб (Фигура 5). В тестисите на лекуваните плъхове локализацията на МТ не се променя, но имунореактивността изглежда изглежда намалена (Фигура 5).
Локализация на металотионеин в тестисите на плъхове. При контролни животни имунохистохимичният сигнал (кафяви зони) е открит в цитоплазмата на всички клетки, образуващи семенния епител: соматични клетки на Сертоли (SER), сперматогонии (SG), сперматоцити (SC), кръгли сперматиди (rSP) и сперматозои глави (SZ). При всички лекувани животни имунореактивният МТ сигнал е слаб, най-вече локализиран върху клетки на Сертоли, сперматогонии и сперматозоиди. Не се наблюдава сигнал в секциите за отрицателна контрола (NC), инкубирани без анти-MT антитялото. Ядрата бяха оцветени с хематоксилин. Лента = 50 µm.
Тестисът на плъх съдържа високо ниво на конститутивни МТ транскрипти, сравнимо с това в черния дроб. Фактът, че MT гените в тестикуларните клетки реагират на DDE и/или HF администриране, както в хепатоцитите, намалявайки тяхната експресия, подсилва хипотезата, според която MT гените са силно експресирани в черния дроб и тестисите и следователно са по-малко чувствителни към стреса фактори, различни от металите. За разлика от черния дроб и бъбреците, при тестисите не са наблюдавани промени в вътреклетъчното разпределение на МТ след прилагане на DDE и/или HF диета, като оцветяването е предимно цитоплазматично (Фигура 5).
4. Заключителни бележки
Спадът в нивата на МТ, регистриран в черния дроб и тестисите, може да се дължи и на намаляване на свободните цинкови и медни йони, които вече няма да могат да предизвикат синтеза на МТ чрез метални активирани транскрипционни фактори. Дисбалансът на реактивните кислородни видове и клетъчният оксидативен стрес, произведен както от мастни киселини, така и от липофилен пестицид DDE, предизвикват каскада от събития, започващи с пероксидацията на мембранните липиди, което води до рязко повишаване на активността на металоензимите. Микрометалните елементи, по-специално цинкът, могат да бъдат отделени от тези металоензими, като SOD. Трябва също да се подчертае, че може да има различна наличност на метал, започвайки от постъпването му в клетките. Всъщност е доказана отрицателна корелация в серумните нива на следи от метали и продукти на липидния метаболизъм (холестерол, триглицериди, липопротеини) [62].
Събраните данни обаче предполагат, че в черния дроб и бъбреците на животните от DDE, HF и HF + DDE групи, MT протеините поддържат цитопротективна функция, по-специално защита на ДНК. В действителност, при плъховете, хранени с високомаслена диета, и при плъховете, прилагани с DDE, се наблюдава значително увеличение на съдържанието на МТ в ядрата както на чернодробните, така и на бъбречните клетки, със съпътстващ спад на нивото на цитоплазмения протеин. Наличието на МТ в ядра, възникващи чрез ядрена транслокация на протеини, се счита за клетъчен механизъм, ангажиран да предпазва ДНК от атаки на хидроксилни радикали [22,57]. Благодарение на способността на тези протеини да даряват цинк на няколко ензима, високото ниво на ядрени МТ също е свързано с повишената нужда от цинк за металоензими и транскрипционни фактори по време на бърз клетъчен метаболизъм и растеж [63,64,65,66].
Взети заедно, данните показват различно участие на МТ в защитата на тъканите от HF-индуциран и индуциран от DDE оксидативен стрес, което предполага, че различните видове клетки използват различни стратегии срещу прооксидантните видове (Таблица 1). MTs могат да бъдат в изобилие в клетките и да намаляват след стрес, предизвикан от неметали (черен дроб и тестиси), или да се увеличават при оксидативен стрес (бъбреци); накрая, те могат да бъдат главно цитоплазмени, но могат да се преместят и в ядрото.
Данните също така показват, че няма адитивен или синергичен ефект между замърсяването с DDE и високочестотната диета; напротив, високият прием на наситени мастни киселини подобрява индуцираното от DDE увреждане, когато се прилага заедно. Този резултат ни позволява да предположим, че липофилният DDE е частично секвестиран в мастните натрупвания, които се появяват в тъканите на плъхове, хранени с високомаслена диета, като по този начин намалява клетъчната наличност на пестицида. Необходими са допълнителни проучвания, за да се потвърди нашата хипотеза и да се провери появата на повече щети след освобождаването на DDE от мастните натрупвания, които могат да бъдат предизвикани от период на калорично ограничение. В същото време са необходими допълнителни проучвания, за да се хвърли повече светлина върху ролята, която играят металите, по-специално относно връзките между метаболизма на липофилните вещества (токсични или не) и липидите, от една страна, и усвояването и хомеостазата на металните микроелементи от другата.
Принос на автора
Концептуализация, L.L., R.P. и R.S .; разследване, L.L., V.M. и R.S .; куриране на данни, L.L., V.M. и R.S .; писане - изготвяне на оригинален проект, R.S .; писане - преглед и редакция, R.S. и L.L. Всички автори са прочели и са съгласни с публикуваната версия на ръкописа.
Финансиране
Това изследване не получи външно финансиране.
- Диетично излагане на канадците на перфлуорирани карбоксилати и перфлуороктан сулфонат чрез
- Яжте риба - особено ако пиете високо ниво на алкохол - ScienceDaily
- Нива на C-пептиден тест, цел, процедура и резултати
- Жаждата за кебап, пица или мазен бургер след кръчмата е до нива на захар в кръвта
- Пограничен състав на тялото и промени в телесното тегло на различни нива на надморска височина Систематичен преглед