Нариаки Фуджимото
1 Изследователски институт по лъчева биология и медицина, Университет Хирошима, Хирошима 7340037, Япония
Гаухар Амантаева
Найля Чайжунусова
Дария Шабдарбаева
Жаслан Абишев
Бахют Русланова
Йерсин Жунусов
Алмас Ажимханов
3 Национален ядрен център на Република Казахстан, Курчатов 071100, Казахстан; zk.cnn@vonahmiza
Касим Жумадилов
4 L.N. Евразийски национален университет „Гумильов“, Нур-Султан 010000, Казахстан; moc.liamg@kvolidamuhz
Алексей Петухов
5 A. Tsyb Medical Radiological Research Center - Национален медицински център за радиология, Министерство на здравеопазването на Руската федерация, 249031 Обнинск, Русия; moc.liamg@8656namxela (AP); moc.oohay@sfirelav (V.S.)
Валерий Степаненко
5 A. Tsyb Medical Radiological Research Center - Национален медицински център за радиология, Министерство на здравеопазването на Руската федерация, 249031 Обнинск, Русия; moc.liamg@8656namxela (AP); moc.oohay@sfirelav (V.S.)
Масахару Хоши
6 Центърът за мир, Университет Хирошима, Хирошима 7300053, Япония; pj.ca.u-amihsorih@ihsohm
Резюме
1. Въведение
Независимо от въздействието на първоначалната радиация от атомните бомбардировки в Хирошима и Нагасаки, има опасения относно потенциално значимото влияние на остатъчния радиоактивен прах върху здравето на изложените. Хората, които се преместиха в тези градове кратко време след детонацията, бяха изложени само на остатъчна радиация, вероятно чрез вдишване на радиоактивен прах, и се съобщава, че страдат от остри радиационни синдроми [1]. Основен източник на остатъчна радиация е 56 Mn, радиоизотоп, произведен в почвата от неутронния лъч от експлозия на атомна бомба [2]. Изследвахме биологичните ефекти на активирания с неутрон 56 MnO2 прах при плъхове Wistar, за да получим по-добро разбиране за значението на остатъчната радиация [3,4,5]. Нашите данни за дозиметрия показват, че най-високите абсорбирани дози от вътрешната радиация са открити в стомашно-чревния тракт, кожата и белите дробове, докато най-високата доза за цялото тяло е 100 mGy. Интересното е, че при тези ниски дози на облъчване вътрешното излагане на 56 MnO2 значително повишава нивото на серумна аланин аминотрансфераза (ALT) [3]. Хистопатологични промени са отбелязани и в тънките черва и белите дробове [4].
2. Резултати
2.1. Приблизителни дози вътрешно облъчване
Очакваните натрупани дози вътрешно облъчване от 56 MnO2 във всеки орган са описани по-рано [3]. Дозите на цялото тяло за вътрешно облъчване са съответно 41 ± 8, 91 ± 3 и 100 ± 10 mGy в групи Mn56 × 1, Mn56 × 2 и Mn56 × 3. По-високите абсорбирани дози са открити в дебелото черво (90 ± 61, 520 ± 110 и 760 ± 170 mGy) и кожата (71 ± 23, 110 ± 2.3 и 140 ± 170 mGy) за Mn56 × 1, Mn56 × 2, и Mn56 × 3 групи, съответно. Изчислените абсорбирани дози за тестисите и простатата са по-малко от 0,3 mGy (група Mn56 × 1), 0,6 mGy (група Mn56 × 2) и 1,0 mGy (група Mn56 × 3).
2.2. Тегло на тялото и тестисите и серумно ниво на тестостерон
Телесното тегло и относителното тегло на тестисите в дни 3 и 61 след излагане са обобщени в таблица 1. Няма значителни разлики в теглото на тестисите нито през деня. Нивата на серумен тестостерон намаляват значително в групите Mn56 × 2 и Co-60 на ден 61 след експозиция.
маса 1
Тегло на тялото и тестисите и серумен тестостерон при плъхове, изложени на 56 MnO2, 60 Co-лъчи и студен MnO2.
| Ден 3 | Контрол | 248 ± 16 | 10,5 ± 1,1 | 1,2 ± 0,30 |
| Студено Мн | 235 ± 14 | 11,4 ± 0,7 | 0,94 ± 0,13 | |
| Mn56 × 1 | 235 ± 11 | 11,7 ± 0,6 | 0,7 ± 0,24 | |
| Mn56 × 2 | 245 ± 16 | 11,3 ± 0,6 | 0,8 ± 0,17 | |
| Mn56 × 3 | 237 ± 12 | 12,2 ± 0,6 | неопределен | |
| Ко-60 | 234 ± 14 | 11,5 ± 0,8 | 1,15 ± 0,33 | |
| Ден 61 | Контрол | 330 ± 17 | 9,3 ± 0,7 | 1,45 ± 0,35 |
| Студено Мн | 337 ± 19 | 9,8 ± 0,4 | 1,3 ± 0,14 | |
| Mn56 × 1 | 371 ± 21 | 9,2 ± 0,6 | 1,42 ± 0,14 | |
| Mn56 × 2 | 337 ± 17 | 9,1 ± 0,5 | 0,68 ± 0,26 * | |
| Mn56 × 3 | 353 ± 17 | 9,1 ± 0,5 | 0,75 ± 0,23 | |
| Ко-60 | 328 ± 23 | 9,4 ± 0,5 | 0,59 ± 0,11 * |
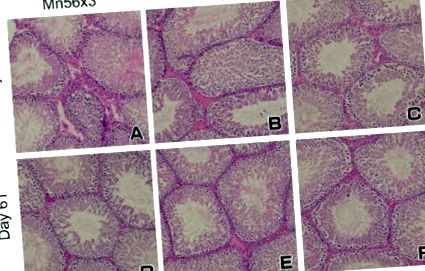
Тестисите на плъхове на Ден 3 (A-° С) и ден 61 (д-F) след 56 MnO2 на прах или 60 Co-γ експозиция. Нямаше значителни хистологични редувания в тестисите сред групите: Mn56 × 3 (A,д); Co-60 (Б.,Е.); и контрола (° С,F). HE оцветяване, оригинално увеличение 20 ×.
2.4. Ефекти върху нивата на експресия на иРНК на гени, свързани със стероидогенезата, специфични за Leydig
Относителни експресии на иРНК на гени, свързани със стероидогенезата, Cyp11a1, Cyp17a, Hsd3b1 и StAR във всяка група, са представени на фигура 2. На ден след експозиция, експресиите на mРНК на Cyp17a и Hsd3b1 значително намаляват в групите Mn56. На ден 61 след експозиция, нивото на иРНК Cyp11a1 стана значително ниско в групата Mn56 × 3, докато нивото на иРНК на StAR намаля в групата Co-60. Нито едно от тези нива на иРНК не е значително променено в студената група Mn.
Относителни нива на експресия на иРНК на гени Cld11, Clu, Spag4 и Zpbp в тестисите на плъховете на Ден 3 (Горна част) и ден 61 (отдолу) след излагане на 56 MnO2 на прах (Mn56 × 1, Mn56 × 2 и Mn56 × 3), студен MnO2 на прах (Cold Mn) или 60 Co-γ експозиция (Co-60). * p Таблица 2). Експресията на ген, кодиращ PSP94, дорзолатерален простатен секреторен протеин, също беше определена. Нивата на KS3 mRNA намаляват в Co-60, Mn56 × 2 и Mn56 × 3, докато нивата на CPR1 mRNA намаляват в Co-60 и Mn56 × 2. Експресията на гена PSP94 значително спадна наполовина от контролната стойност само в групата Mn56 × 3.
Таблица 2
нива на иРНК на секреторни протеинови гени в простатата.
| Контрол | 651 ± 45 | 158 ± 22 | 20 ± 2,6 | 103 ± 7,3 |
| Студено Мн | 566 ± 38 | 168 ± 26 | 13,5 ± 2,2 | 83 ± 11,2 |
| Mn56 × 1 | 716 ± 82 | 206 ± 34 | 18,3 ± 2,9 | 86 ± 33,8 |
| Mn56 × 2 | 611 ± 103 | 77 ± 14 * | 8,3 ± 1,6 ** | 75 ± 9,0 |
| Mn56 × 3 | 453 ± 24 | 91 ± 10 | 9,8 ± 2,8 * | 49 ± 10,7 * |
| Ко-60 | 557 ± 79 | 79 ± 19 * | 11,8 ± 2,6 * | 71 ± 9,4 |
Проби от простатна тъкан бяха събрани и изследвани само на ден 61 след експозиция. Всяка стойност показва средна стойност ± SEM (n = 6 или 7, всяка група). * p 56 MnO2 на прах и установи, че вътрешното излагане на този радиоактивен прах има по-високи биологични въздействия от външното облъчване [3,4]. В настоящото проучване ефектите от вътрешното излагане на прах от 56 MnO2 върху репродуктивната функция на мъжете бяха изследвани чрез определяне на промените в генната експресия в тестисите, както и в простатата. Въпреки че дозите на радиация на тестисите са по-малко от 110 mGy, нивата на иРНК в няколко гена, свързани със стероидогенезата, са били засегнати в дни 3 и 61 след експозицията, тъй като експресиите на гени на простатния протеин също са били регулирани надолу на ден 61 след експозицията. Нашите резултати показват, че излагането на 56 MnO2 на прах значително е повлияло на репродуктивната функция на мъжете, свързано с намалена експресия на гени в тестисите и простатата, въпреки ниските дози на облъчване.
За по-нататъшно оценяване на ефекта от 56 MnO2 върху репродуктивната функция на мъжете, ние изследвахме простатни дейности. Простатата на гризачите се състои от морфологично разделени вентрални, дорзолатерални и предни (коагулиращи жлези) части, всяка от които отделя различни протеини, представляващи развитието и активността на простатата [20]. Определихме нивата на иРНК на вентрално простатно секретирани протеини, prstC3, CRP1 и KS3, и дорзолатерален простатен протеин, PSP94. Тези експресии на mRNA значително намаляват в групата Mn56 × 3 в деня 61 след експозиция, което предполага, че експозицията от 56 MnO2 представлява простатната функция, вероятно чрез намаляване на серумните нива на тестостерон.
Генната експресия се променя значително в тестисите и простатата в групите Mn56, въпреки ниските им вътрешни дози на облъчване (по-малко от 1 mGy). В това отношение трябва да се отбележи, че оценките на вътрешното облъчване на всеки орган се основават на измерената радиоактивност на органите. Въпреки това, в случай на тестиси, които са били анатомично разположени извън тялото и не са били прибрани вътре, тъй като животните са били заспали по време на периода на експозиция, те са били допълнително подложени на облъчване от съседна кожа директно в контакт с прах 56 MnO2 Като се има предвид максималната енергия от 2,85 MeV на β лъчи от 56 Mn с обхват от приблизително 4 mm в тъканта, допълнителната тестикуларна доза би трябвало да бъде 110 mGy в групата Mn56 × 3 съгласно метода на изчисление, който докладвахме по-рано [21] . Това обаче не беше така при простатата, вътрешен орган. Намаляването на нивата на иРНК на простатните протеини вероятно е резултат от намалените серумни нива на тестостерон.
Разпределението в тялото на някои радионуклиди след вътрешна експозиция зависи от тяхната специфична химическа природа [22,23] Когато плъховете са изложени на стабилни и неразтворими молекули като MnO2, тези молекули се доставят в стомашно-чревния тракт, кожата и белите дробове. Смята се, че облъчването от радиоактивни частици може да бъде по-малко опасно от гледна точка на канцерогенезата, отколкото една и съща активност, разпределена равномерно [24]. Радиоактивните частици обаче могат да предизвикат по-силно биологично въздействие върху „прицелните органи“, тъй като по-рано открихме хистологични промени в белия дроб и тънките черва при плъхове, изложени вътрешно на прах 56 MnO2 [24]. Настоящото проучване отново показва високо биологично въздействие върху определени целеви органи от радиоактивните частици. Ефектите върху експресията на тестисите на гена от 56 MnO2 очевидно са по-високи от ефектите, причинени от 2 Gy външно γ облъчване.
4. Материали и методи
4.1. Животни
4.2. Облъчване и дозиметрия
4.3. Измерване на нивата на иРНК чрез количествена RT-PCR
Общата РНК се приготвя, като се използва Isogen II (Nippon Gene Co., Токио, Япония) от участъци на тестисите и простатната тъкан, съхранявани в разтвор RNA Save. СДНК от първа верига се синтезира чрез инкубиране на 3 µg обща РНК със 100 U ReverTra Ace обратна транскриптаза (Toyobo Co., Осака, Япония) със смес от 20 pmol произволни хексамери pdN6 и 5 pmol oligo-dT (15) праймери (Takara Bio Inc., Kusatsu, Япония). Количествен PCR инструмент, StepOnePlus (Applied Biosystems/Life Technologies Co., Carlsbad, CA, USA), беше използван за измерване на cDNA с KAPA SYBR Fast qPCR Kit (Kapa Biosystems, Inc., Woburn, MA, USA). Преди количествен анализ, PCR продуктите се приготвят отделно и се пречистват чрез гел електрофореза. ДНК последователностите са потвърдени от Fasmac Co., Ltd. (Atsugi, Япония). Извлечените фрагменти са използвани като стандарти за количествено определяне. PCR условията са 30 s първоначална денатурация, последвана от 40 цикъла от 5 s при 95 ° C и 35 s при 60 ° C. Измерените нива на иРНК са нормализирани по отношение на нивата на р-актин иРНК. Специфични набори праймери за тестикуларни гени са изброени в Таблица 3. Q-PCR праймерите за секретиращи протеини на простатата са описани по-рано [30].
- Как да сваля 10 килограма - 11 малки промени за голямо отслабване
- Как да отслабнете 15 килограма - малки промени за отслабване
- Как да загубя 5 кг 4 промени, които трябва да направите за отслабване мъже; s Здравно списание Австралия
- Как кърмещата майка може безопасно да отслабне Протеин на прах за кърмене от млечен прах
- Повишените нива на холин, L-карнитин и TMAO са свързани с промени в затлъстяването