Резюме
Заден план
Лечението с кратка кетогенна диета (KD) може да предотврати пристъпите на мигрена и да коригира прекомерния корен отговор. Тук се стремим да докажем дали свързаните с KD промени в кортикалната възбудимост се дължат предимно на активността на мозъчната кора или са модулирани от мозъчния ствол.
Методи
Чрез стимулация на дясното супраорбитално разделение на тригеминалния нерв, ние едновременно междувременно записвахме ноцицептивния мигащ рефлекс (nBR) и свързаните с болката предизвикани потенциали (PREP) при 18 пациенти с мигрена без аура преди и след 1 месец на KD, докато при метаболитна кетоза. nBR и PREP отразяват различни активиране на мозъчните структури: съответно мозъчния ствол и мозъчната кора. Изчислихме площта на nBR R2 под кривата, както и привикване на амплитудата PREP като наклон от линейната регресия между 1-ви и 2-ри блок от 5 усреднени отговора.
Резултати
След 1 месец на KD, средният брой пристъпи и продължителността на главоболието намаляват значително. Нещо повече, KD значително нормализира междинното привикване PREP (преди: + 1,8, след: - 9,1, стр = 0,012), докато дефицитът на привикване в nBR не се променя.
Заключения
Положителните клинични ефекти, които наблюдавахме при популация от мигренари чрез едномесечно лечение с KD, съществуват едновременно с нормализиране на кортикалното ниво, а не в мозъчния ствол, на типичния междупристъпен дефицит на привикване. Тези открития предполагат, че мозъчната кора може да бъде основното място на модулация, свързана с KD.
Пробна регистрация
ClinicalTrials.gov NCT03775252 (регистриран със задна дата, 09 декември 2018 г.).
Заден план
Следователно целта на това проучване е да изследва функцията на тригеминалната система на мозъчния ствол и кората едновременно при група мигренари преди и по време на KD, проспективно. За целта едновременно регистрирахме ноцицептивен мигащ рефлекс (nBR) и свързаните с кората болка предизвикани потенциали (PREP), предизвикани от същите супраорбитални болезнени стимули [21,22,23] преди и по време на метаболитна кетоза, индуцирана от KD, в група от пациенти с епизодична мигрена без аура, между пристъпите.
Методи
Субекти
Кетогенна диета
Събиране на данни
Едновременно записване на ноцицептивен мигащ рефлекс (nBR) и свързани с болката предизвикани потенциали (PREP)
Едновременното записване на ноцицептивен мигащ рефлекс (nBR) и свързаните с болката предизвикани потенциали (PREP) се извършва при всички участници, включени в съответствие с методи, описани другаде [22].
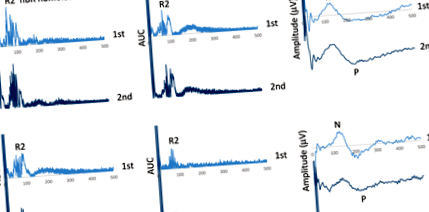
Обяснителни блокови записи на ноцицептивен мигащ рефлекс (nBR) предизвикват хомолатерално и контралатерално към стимулираната страна и свързани с болката предизвикани потенциали (PREP) при пациент с мигрена, регистриран преди [горния панел] и след 1-месечна кетогенна диета, по време на метаболизма кетоза [долен панел]
Процедура
Записите на nBR и PREP бяха записани едновременно по време на една сесия, включително изходно ниво (време 0) и 1 месец след, по време на метаболитна кетоза (> 0,5 mmol/l), както е потвърдено чрез тестване на кетон в урината (тест на Ketur), в същия ден на сесията за запис. Всички записи бяха извършени следобед (между 14:00 и 18:00 ч.) От същите следователи (Мартина Бракалия и Давиде Ди Ленола), които бяха заслепени дали записите са получени преди или след лечението и дали субектите са мигренари или здрави доброволци. Тези разследващи също не са се срещнали с участниците преди изпита. Всички записи бяха номерирани анонимно и анализирани офлайн от един изследовател (Джанлука Копола), който беше заслепен за самоличността на субектите, но не заслепен за реда на блоковете.
Статистически анализ
Данните бяха анализирани по заслепен начин от един изследовател (Винченцо Паризи), използвайки Statistica за Windows (StatSoft Inc., Tulsa, USA) версия 8.0 софтуер. Въз основа на предишното ни проучване за влиянието на KD върху зрителните и соматосензорно извиканите потенциали [19], ние определихме размера на извадката на осемнадесет субекта, които адекватно засилиха проучването, за да покажат статистически различни резултати между контролите и участниците в мигрена, ако има такива. И двата компонента nBR и PREP показват нормално разпределение при теста на Колмогоров-Смирнов. Използвахме подход на общ линеен модел, за да анализираме ефекта от взаимодействието „между фактор” × „вътре-фактори”. Факторът между субектите беше „група“ (HV срещу MO) или „време“ (преди или след KD), а факторът в рамките на субекта беше „блокове“. Бяха проведени три отделни модела на повторна мярка ANOVA (rm-ANOVA), два за nBR (хомолатерална и контралатерална към стимулираната страна) и един за PREP. Използван е регресионен анализ за разкриване на линейни тенденции в nBR R2 AUC и N-P амплитуда през двата блока (наклон) във всяка група. За наклон използвахме ANOVA с групов фактор „група“ (HV срещу MO) и сдвоени t-тестове с групов фактор „време“ (преди срещу след KD).
Използвани са двойни проби t тестове за сравняване на клиничните данни преди и след KD. P стойности по-малки от 0,05 се считат за статистическа значимост.
Тестът за корелация на Пиърсън е използван за търсене на корелации между наклоните на nBR и PREP и клиничните променливи (продължителност на анамнезата за мигрена [години], честота на атаката [n/месец], продължителност на атаката [h/месец], интензивност на мигренозното главоболие [0–10 ] и тежестта на мигрената [0–3]).
Резултати
Клинични характеристики
Клиничните характеристики на пациентите с мигрена преди и след 1-месечен KD са показани в Таблица 1. Наблюдавахме значително намаляване на честотата на атаките (т = 5,27, стр 0,05). В сравнение с контролите, AUC на 1-ви R2 компонент е значително по-нисък при мигрена и при двата хомолатерални (F1,34 = 18,682, стр = 0,0001) и контралатерални страни (F1,34 = 7,792, стр = 0,008), докато първият амплитуден блок на N-P PREP не се различава между групите (F1,34 = 2,194, стр = 0,148).
Липсата на реакция привикване към повтарящи се вредни супраорбитални стимулации характеризира мигрена група преди KD интервенция. Това беше потвърдено за nBR R2 компонент хомолатерално спрямо стимулираната страна и за N-P върхов комплекс на PREP, но не и за nBR R2 компонент, записан контралатерално към стимулираната страна. В действителност, в rm-ANOVA модела с nBR R2 AUC (хомолатерален) или N-P амплитуди на пик-пик като зависима променлива, многовариантният тест е важен за ефекта на взаимодействие „група“ × „блокове“ (F1,34 = 11,973, стр = 0,001 за nBR R2 хомолатерално; F1,34 = 9.420, стр = 0,004 за PREP), но това не е случаят в модела с nBR R2 AUC контралатерално спрямо стимулираната страна (F1,34 = 3,4456, стр = 0,07). Тези данни бяха потвърдени от линейния наклон на регресия, който се различаваше значително между двете групи за nBR R2 AUC хомолатерално и N-P PREP амплитуда през 2-те блока (F1,34 = 12,081, стр = 0,001 за nBR R2 хомолатерално; F1,34 = 6.613, стр = 0,015 за PREP), но не и за nBR R2 AUC контралатерал (F1,34 = 3,467, стр = 0,07).
Преди намесата на KD, амплитудният наклон на N-P корелира положително с интензивността на болката по време на мигренозно главоболие, оценено от VAS (r = 0,471, стр = 0,048) и с продължителността на анамнезата за мигрена (r = 0,538, стр = 0,021). На свой ред VAS корелира положително с продължителността на мигрената (r = 0,472, стр = 0,048) и с увреждане, свързано с мигрена (r = 0,513, стр = 0,029). Няма други значими корелации между неврофизиологичните и клиничните данни.
Кетогенни диетични ефекти
Основните неврофизиологични параметри (ST, PT, R2 nBR начало, N и P PREP латентности, виж Таблица 2) не се различават значително преди и след KD при мигренари (P > 0,05).
В модела rm-ANOVA с nBR R2 AUC хомолатерален или контралатерален спрямо стимулираната страна като зависима променлива, многовариантният тест не е достигнал нивото на значимост за ефекта на взаимодействие „време“ × „блок“ (F1,34 = 0,0001, стр = 0,991 за хомолатерала; F1,34 = 0,226, стр = 0,637, за контралатерал, фиг. 2).
Привикване на ноцицептивния мигащ рефлекс (nBR) R2 компонент площ под кривата (AUC) [а хомолатерален; б контралатерално спрямо стимулираната страна] и свързани с болката предизвикани потенциали (PREP) N-P амплитуда [° С] наклони при здрави контроли и пациенти с мигрена преди и след 1-месечна кетогенна диета, по време на метаболитна кетоза, в два блока от пет усреднени отговора, изразени като процент от първия блок
Докато в модела rm-ANOVA, използващ PREP N-P амплитуда на пик-пик като зависима променлива, мултивариантният тест е бил важен за ефекта на взаимодействие „време“ × „блок“ (F1,34 = 7.234, стр = 0,011). Линейната регресия N-P наклон на PREP амплитудите по всички блокове се различаваше значително преди в сравнение с по време на KD (т = 2.817, стр = 0,012, фиг. 2). Rm-ANOVA post-hoc анализ показа, че първият амплитуден блок на N-P PREP не се променя след 1-месечен KD.
Дискусия
Можем да обобщим най-поразителните резултати от нашето изследване, както следва: (а) HV проявява физиологично привикване в амплитуден наклон на N-P на PREP, както в хомолатерален, така и в контралатерален nBR; в противен случай мигренерите са показали междинен дефицит на привикване за nBR, както се очаква [24], и за PREP; (б) липсата на привикване, наблюдавана преди диетата, все още е налице по време на кетоза за nBR, но е нормализирана за PREP. Доколкото ни е известно, това е първото проучване, в което има едновременно записване на nBR и PREP, за да се оцени връзката между привикването на предизвиканите отговори и клиничните характеристики на главоболието.
Освен това е добре известно, че мозъкът на мигренерите показва нарушение на окислителния метаболизъм, функционирането на митохондриите и енергийното производство [46,47,48]. Тъй като възбудимостта на невроните зависи от енергийния метаболизъм, друго възможно обяснение за нормализирането на кортикалната възбудимост, свързано с KD, е укрепването на митохондриалната биогенеза, енергийния метаболизъм [49] и производството на енергия, чрез увеличаване на ефективността на окислителния дихателен комплекс [50]. Това води до по-ефективно синаптично предаване и невронална пластичност [51, 52].
Модификацията на кортикалния отговор на тригеминалните ноцицептивни стимули успоредно с подобряването на клиничните характеристики на мигрена и е в съответствие с нашите предишни констатации, наблюдавани при регистриране на други ЕК на кората [19]. По този начин ние допълнително потвърждаваме, че нормализирането на привикването по време на KD е неспецифичен отговор на повтарящи се стимули на корите на мигренерите поради кетогенеза, независимо от начина на стимулация.
Свързани с електрофизиологичните методологии, 5 на блок усреднени стимули могат да бъдат недостатъчни за измерване на стабилни съответни PREP компоненти, въпреки че предишни статии надеждно оценяват PREP амплитудата и привикването чрез усредняване на блокове, съставени от 3 пътеки [69]. И накрая, трябва да подчертаем, че има известни противоречия относно надеждността на PREP, предизвикана от електрически дразнители, спрямо тази, предизвикана от лазерни стимули за тестване на ноцицепция [70]. Според многоканально проучване на скалпа, както лазерно-извиканите (LEP), така и електрически-концентричните тригеминални потенциали са сходни по амплитуда, морфология и топографски кортикални изображения, но различни в латентността, така че Авторите заключават, че кортикалните потенциали, предизвикани от електрическа стимулация, са замърсени от А-бета неноцицептивна коактивация на влакна [70]. Необходимо е по-нататъшно проучване с използване на LEP, за да се оцени по-селективно обработването на болката при мигрени, лекувани с KD, за да се потвърдят настоящите ни данни.
Заключения
В обобщение, нашето проучване потвърждава, че при мигренерите на кетогенна диета типичният междупристъпен дефицит на привикване на предизвикани отговори на повтарящи се електрически болезнени тригеминални стимули може да се нормализира, но само на кортикални нива (както се измерва чрез записване на PREP), а не в мозъчен ствол (изследван чрез nBR анализ). Тези открития предполагат, че мозъчната кора може да бъде основното място на модулация, свързана с KD.
- 8 най-добри кетогенни диетични книги, които да ви помогнат да започнете; Целуни моя кето блог
- Дишането на ацетон предсказва плазмени кетонни тела при деца с епилепсия на кетогенна диета - PubMed
- 35% отстъпка ИСТИНАТА ЗА КЕТОГЕННИТЕ ДИЕТОВИ КУПОНОВЕ, Промо; Кодове за отстъпки 2020
- 8 причини за кето подуване; Как да го коригирате Кетогенни диетични отзиви
- 47-дневно предизвикателство за кетогенна диета (9-то издание)