От Института по молекулярна медицина (C.A.H., E.B., M.F., P.A.D.) и Центъра за човешка генетика (E.B.), Център за здравни науки на Университета в Тексас, Хюстън.
От Института по молекулярна медицина (C.A.H., E.B., M.F., P.A.D.) и Центъра за човешка генетика (E.B.), Център за здравни науки на Университета в Тексас, Хюстън.
От Института по молекулярна медицина (C.A.H., E.B., M.F., P.A.D.) и Центъра за човешка генетика (E.B.), Център за здравни науки на Университета в Тексас, Хюстън.
От Института по молекулярна медицина (C.A.H., E.B., M.F., P.A.D.) и Центъра за човешка генетика (E.B.), Център за здравни науки на Университета в Тексас, Хюстън.
Преглеждате най-новата версия на тази статия. Предишни версии:
Резюме
Наследствените вариации в генната експресия са ключова еволюционна сила, с която видовете се различават. 1–4 В рамките на видовете също има обширни доказателства за наследствени алелни ефекти върху генната експресия. 5,6 Всъщност екстраполацията в целия човешки геном на честотите на известната кодираща последователност и полиморфизмите на регулаторната последователност предполага, че регулаторните полиморфизми допринасят повече за междуиндивидуалната вариация, отколкото полиморфизмите на кодиращата последователност. 3 В допълнение към създаването на Менделеви черти, такива наследствени генетични регулаторни ефекти могат да допринесат значително за създаването на фенотипи на полигенни заболявания, включително хипертония. Например, доказателства, засягащи гена на ангиотензиногена при химунната хипертония, подчертават ролята на генните хаплотипове, включително функционални полиморфизми в промоторната област на гена, за които е доказано, че влияят на транскрипцията на ангиотензиногенния ген и се свързват с плазмените нива на ангиотензиноген. 7,8
Позиционният (картографиране на връзките) и асоциативните подходи за разрешаване на наследствената основа на податливост на полигенни болести се сблъскват със значителни пречки пред идентифицирането на локуси и генни варианти, които постоянно се свързват с чувствителността към болести. 9,10 Въпреки усилията от десетилетие, разрешаването на генетичната основа на чувствителност към есенциална хипертония на нивото на отделни гени е ограничено и констатациите често са непоследователни. Същите условия характеризират проучвания върху животински модели на наследствена хипертония, въпреки че те предлагат по-благоприятни възможности за разследване от безпородните човешки популации, като намалена генетична хетерогенност, контролирано размножаване и по-голям обхват за интервенционно проучване. Като се има предвид важната роля на наследствените ефекти върху генната експресия при създаването на вътревидови фенотипове и наличието на цялостни инструменти за оценка на генната експресия, генетиката на експресията може да е узряла достатъчно, за да се комбинира конструктивно с позиционната генетика, за да допринесе за разрешаването на алелната основа на наследствената хипертония.
Методи
Животни и измервания
Проведени са проучвания върху 4-, 8-, 12- и 18-седмични мъжки животни. Използвахме плъхове WKY и SHR-A3 от подложките на Хайделберг, които се поддържат в нашето съоръжение от 8 години. Запасите от SHR-B2 и SHR-C бяха предоставени щедро на нашата лаборатория през 2002 г. от професор T. Suzuki (Kinki University School of Medicine, Kinki, Япония) и произлизат от оригиналните субстрати, съобщени от Okamoto. 11 Всички животни, използвани в проучванията, са произведени в нашата развъдна програма и са настанени при контролирани условия в одобрена от Асоциация за оценка и акредитация на лаборатория за животни лаборатория. Животните получиха стандартна диета с гризачи и питейна вода ad libitum.
За събиране на тъкани животните се упояват чрез вдишване на изофлуран и бъбреците бързо се дисектират чрез вентрална лапаротомия. Анализът на експресията на бъбречни гени беше извършен с използване на препарати от обща РНК от аксиални бъбречни сегменти, включително кора и медула. Уретеричен таз и основни съдови структури на бъбречния синус бяха отстранени от пробата. Три или 4 животни от всеки щам бяха използвани във всяка времева точка, за да позволят статистически да се анализират всички измервания на генната експресия. Всяка проба от всяко животно се третира като независима проба и не се извършва обединяване.
Профилиране на стенограми
Изобилието на транскрипти беше определено, както беше съобщено по-рано от нас 14, като се използва масивът RG-U34A на плъх Affymetrix, съдържащ комплекти сонди за 5288 гени на плъхове и 3452 етикети на експресирани плъхове (EST), следвайки препоръчаните от производителя протоколи. Повечето гени от този масив се разпитват от комплекти сонди, съдържащи 16 уникални 25-мерни олигонуклеотиди. Корекция за неспецифична флуоресценция се извършва, като се използват данни за хибридизация от 16 допълнителни олигонуклеотида на набор от сонди, които са идентични, с изключение на единичен остатък от основата в средата на олигонуклеотида. Нивата на изразяване се отчитат като средно ± SEM. Номинално P стойност от 0,05 се счита за статистически значима за целите на сравнението между щамовете (тест на Mann-Whitney). Този набор от данни е депозиран в NCBI Gene Expression Omnibus (база данни GEO) със сериен номер за присъединяване GSE2104 (дата на издаване 1 април 2005 г.).
Резултати
За да оценим общите промени в генната експресия във времето и между щамовете, направихме регресионни анализи, за да изследваме връзките между наборите от данни. Таблица 1 показва стойностите на R-квадрата на регресиите, изследващи всеки щам през конкретни моменти от време. По време на първоначалните 3 времеви точки, общата експресия на WKY и SHR-A3 е по-тясно свързана, отколкото експресията в WKY, или с SHR-B2, или с SHR-C субстрати. На 18-седмична възраст обаче се наблюдава драстично намаляване на връзката между експресията на бъбречните гени в SHR-A3 и WKY, така че моделите на експресия в SHR-B2 и SHR-C са по-сходни с WKY в този момент. Интересното е, че има и значителен спад в отношенията на възраст 18 седмици между експресията на гени в SHR-A3 и SHR-B2, както и между SHR-A3 и SHR-C. Стойностите на R-квадрата във времето показват тясна връзка между експресията на бъбречния ген в щамове SHR-B2 и SHR-C.
ТАБЛИЦА 1. Регресионен анализ на съотношенията за сравнение на генната експресия в отделни гени и EST в щамове на плъхове във всяка от изследваните 4 възрасти
Таблица 2 предоставя допълнителна представа за връзката в рамките на щамовете на модела на генна експресия. Тук отново най-забележителната забелязана характеристика е, че експресията на гена SHR-A3 на 18 седмици е съществено различна от експресията на ген в SHR-A3 през друго време. За разлика от това, почти няма промяна в връзката между генната експресия на 18 седмици и експресията в други моменти от време в SHR-B2 и SHR-C. Заедно таблици 1 и 2 предполагат големи промени в генната експресия в SHR-A3, настъпили на 18 седмици, които отличават този щам от двата други SHR субстрата, както и от WKY.
ТАБЛИЦА 2. Регресионен анализ на сравнителни връзки на генната експресия при експресия на отделни гени и EST през времето в щамове на плъхове
Таблица 3 показва отделни гени и ESTs, представени в масива, които показват постоянни разлики във времето, когато всички SHR субстрати са в контраст с WKY животни. Основната обосновка на това проучване е, че генеалогичните взаимоотношения между SHR субстрати създават, всъщност, множество вродени субстрати, в които разрешителните и причинителни алели за хипертония се споделят между субстратите и са разпръснати между фоновите геномни вариации, произтичащи от техните общи предци и несвързани с хипертонията. По този начин гени, участващи в генезиса на хипертония, които действат чрез наследствени промени в генната експресия, могат да бъдат идентифицирани сред тези, които споделят постоянни разлики в експресията между WKY и всички SHR субстрати.
ТАБЛИЦА 3. Гени и EST, постоянно различаващи се между щамовете SHR в сравнение с WKY
Тъй като нашата хипотеза позволява също така, че някои фонови гени, несвързани с хипертонията, също ще бъдат споделени между хипертоничните субстрати, ние се опитахме да усъвършенстваме списъка с диференциално експресирани гени, като идентифицирахме тези сред тях, които се намират в хромозомни области, замесени от проучвания, целящи да определят количественото АН локуси на черта (QTL) в SHR. Идентифицирахме 14 гена и EST, представляващи 8 хромозоми и 11 SHR BP QTL. Фигура 1 показва хромозомите, съдържащи тези гени и EST и тяхното положение върху хромозомите. Тези гени и EST имат средни нива на експресия в SHR подложките, които варират от 5,4 пъти до -3,9 пъти, различни от WKY. 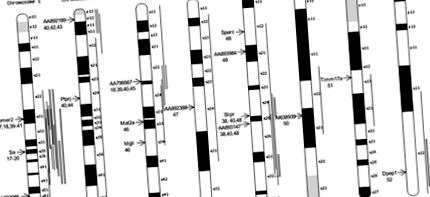
Фигура 1. Последователно диференцирано експресирани гени и EST, които се свързват с SHR BP QTLs. Позицията на хромозомата на гена или EST се обозначава със стрелка вляво от хромозомата; генът или EST е обозначен до тази стрелка и цитатите, показващи локализация на SHR BP гени в тази хромозома/регион, са посочени под идентификацията на гена/EST. Тънките вертикални линии представляват степента на QTL на BP, наблюдавани при свободно разделящи се кръстове. Широките, засенчени линии представляват вродени сегменти 27,28,33–38, които са изолирани в или от SHR и е показано, че влияят на BP.
Дискусия
Фигура 2. Генеалогични връзки между SHR подложки, използвани в настоящото проучване (модифицирано от Okamoto et al 11).
Анализът на връзката между моделите на генна експресия във времето в щамове и между щамове по различно време дава сериозни доказателства за наследствено влияние върху генната експресия (Таблици 1 и 2). Въз основа на генеалогията щамовете, за които се очаква да имат най-близко генетично отношение, SHR-B2 и SHR-C, показват забележително тясна връзка в своите модели на генна експресия. Публикуваните генеалогични записи не позволяват точно определяне на последното поколение, в което SHR-A3 споделя общи родители с SHR-B2 и SHR-C. 11 Генеалогичната информация, обобщена на фигура 2, обаче показва, че това се е случило в някакъв момент между поколенията F1 и F8, когато коефициентите на инбридинг бързо се покачват от първоначалните нива. Тъй като SHR-B2 и SHR-C имат общи предци в поколенията на инбридинг F11 и F14, те са по-тясно свързани и тази тясна генетична връзка е вероятната сила, определяща голямото сходство в моделите на генна експресия в тези щамове (Таблица 1 ). Общата степен на взаимовръзка в генната експресия между WKY и 3 SHR субстрата е доста сходна, но се характеризира със значително намаляване на 18 седмици. Това е най-доброто за SHR-A3 и може да отразява повишената чувствителност на този щам към хипертонично увреждане на крайния орган.
Първоначално генът Sa е идентифициран като ген, силно диференцирано изобилно експресиран в бъбреците. 16 Нашият анализ установява, че тази разлика се запазва в изследваните 3 SHR подпласти. Този ген е добре проучен поради диференциалната си експресия, позицията си в добре обосновано SHR BP QTL, 17–21 доказателства за полиморфизъм в локуса на Са между SHR и WKY, 22,23 и доказателства от изследвания върху хора, предполагащи участие в BP решителност. 24-26 Последните вродени проучвания на плъхове не са намерили подкрепа за участието на Sa в регулацията на BP. 27,28 По подобен начин усилията за изследване на функционалната връзка на гена Sa с BP, използвайки модел на нокаут на мишка, не бяха плодотворни, 29 макар че аблацията на гена не е силна аналогия на увеличената алелна експресия на Sa гена в SHR.
Допълнителна, продължаваща фаза на изследванията, докладвани тук, включва характеризиране на вариацията на последователността между диференциално експресирани гени. В допълнение към описанието на Ephx2, описано по-горе, сега завършихме анализ на полиморфизма и генотипиране на родителски щам за 4 от гените, идентифицирани в Таблица 3. Във всеки случай при кодирането бяха идентифицирани между 1 и 4 еднонуклеотидни полиморфизми, проксимални 5 ′ Регулаторна или флангова интронна последователност (данните не са показани). Във всеки случай всички тествани SHR подложки споделят същия генотип, но се различават от WKY. Същият генотип е идентифициран и в търговския SHR субстрат SHR/N Criv. Този последователен модел в генотип: фенотипната връзка на тези гени-кандидати за експресия засилва обосновката за допълнително изследване на алелната основа на диференциалната генна експресия в SHR и участието на тези алели в хипертония.
Продължават усилията за анализ на алелната структура на тези гени и осигуряват средства за напредък на този подход до следващото ниво: оценка дали варирането на кодиращата последователност се случва заедно с регулаторната вариация, оценка на последиците от генната вариация върху функцията, потвърждение на алелния характер на разликите в експресията на гени в F2 потомство на кръст SHR × WKY и оценка на връзката на алелна вариация с BP в потомството F2.
Перспектива
- Съвременни хранителни подходи при управление на разстройството от аутистичния спектър Преглед Хранителен
- Намаляване на експресията на тумор некрозис фактор чрез пентоксифилин при пациенти с рак Пилот
- Празнуваме нашите майки, постигнали загуба на тегло, които са свалили над 130 кг заедно
- Химическо картографиране на РНК взаимодействията с полипиримидиновия тракт, свързващ протеин
- Химическо картографиране на РНК взаимодействията с полипиримидиновия тракт, свързващ протеин Nucleic
