Кореспонденция на: д-р Нимер Аси, отдел за черния дроб, Медицински център Ziv, Safed 13100, Израел. [email protected]
Резюме
ВЪВЕДЕНИЕ
Безалкохолно мастно чернодробно заболяване (NAFLD) и неалкохолен стеатохепатит (NASH) се срещат при 10% -24% от общата популация [1]. Потенциалът да прогресира до фиброза (20% -40%), цироза (30%) и хепатоцелуларен карцином [1–3] прави тези състояния клинично важни. Затлъстяването, диабетът, хиперлипидемията и приемът на безалкохолни напитки са рискови фактори, често свързани с NAFLD [4,5].
Патогенезата на NASH включва инсулинова резистентност, повишено възпаление, фактор на туморна некроза (TNF) -α, интерлевкин (IL) -6 и повишен оксидативен стрес [6]. Етиологичният механизъм на NAFLD включва повишен приток на свободни мастни киселини (FFA) към черния дроб от диетични триглицериди (TG) и от FFA, които се освобождават от адипоцитите по време на гладуване, намалена FFA β-окисление, намалена чернодробна секреция на богата на TG много ниска липопротеин с плътност (VLDL) и повишена липидна пероксидация [6]. Наскоро се съобщава за нарушен постпрандиален TG отговор при пациенти с NASH и може да играе патофизиологична роля, като благоприятства натрупването на TG в черния дроб [7].
Диетата и храненето, по-специално количеството и видът на приема на мазнини, са свързани с инсулинова резистентност, повишен риск от развитие на диабет тип 2 и нарушен постпрандиален метаболизъм на липидите [8,9]. В допълнение, животински модели и проучвания при хора предполагат, че хранителните фактори могат да повлияят на мастната инфилтрация и липидната пероксидация при различни видове чернодробни заболявания, включително NAFLD [10,11]. Съвсем наскоро беше установено, че увеличеното поглъщане на безалкохолни напитки е свързано с NAFLD [5]. Въпреки че са проведени малко проучвания на ефектите от различни диети върху NAFLD при хора, средиземноморска диета е предложена за профилактика на метаболитен синдром, хипертония и сърдечно-съдови заболявания [12]. Основната част от неговия полезен ефект е високото количество енергия, идваща от мононенаситени мастни киселини (MUFA), главно от зехтин. Основните естери на мастните киселини, присъстващи в нормалния черен дроб, са палмитат (16: 0) и олеат (18: 1 n-9). При пациенти с алкохолен мастен черен дроб делът на линолеат (C18: 2 n-6) и линоленова киселина (C18: 3 n-3) намалява и делът на олеат (C18: 1 n-9) се увеличава в сравнение с диабетици с мастни заболявания черен дроб и контролни субекти, подложени на чернодробна биопсия [13].
В този преглед описваме хранителните навици и тяхната връзка с инсулиновата резистентност и нивата на глюкоза и TG след хранене в NASH, механизма, чрез който зехтинът подобрява затлъстяването на черния дроб, експериментални и клинични проучвания на зехтин и NAFLD и бъдещи перспективи.
СЪСТАВ НА МАСЛИНО
Всеки 100 g зехтин съдържа следните мастни киселини: MUFA 73,7 g (n-9 олеинова киселина 18: 1); наситени мастни киселини (SFA) 13,5 g (16: 0 палмитинова киселина); полиненаситени мастни киселини (PUFA) 7,9 g (n-6 линолова киселина 18: 2 и n-3 алфа-линолова киселина 18: 3) [14].
MUFA включват палмитинова (C16: 1), олеинова (C18: 1), елаидова (C18: 1) и вацентна киселини (C18: 1). Най-разпространената MUFA в диетата е олеиновата киселина (C18: 1 n-9) [15]. В средиземноморските страни основният източник на MUFA е зехтинът (74 g/100 g). Други източници на масло от MUFA са рапица (59 g/100 g), фъстъци (46 g/100 g), слънчоглед (32 g/100 g), царевица (29 g/100 g), соя (24 g/100 g) и шафранови масла (14 g/100 g) [16]. Освен това са разработени нови варианти на масло, богати на олеинова киселина, включително слънчогледово масло с висока олеинова киселина (84 g/100 g) и шафраново масло с висока олеинова киселина (74 g/100 g) [17]. В допълнение към високото съдържание на MUFA, необработеният (нерафиниран) зехтин съдържа значително количество антиоксиданти и α-токоферол и фитохимикали. Въпреки това, когато се рафинира или загрява, зехтинът губи тези естествени съединения [18].
Зехтинът се степенува според киселинността му. Екстра върджин зехтинът, първото пресовано масло с максимална свободна киселинност, съдържа изобилие от сквален и фенолни антиоксиданти, включително прости феноли (хидрокситирозол, тирозол), алдехидни секоиридоиди, флавоноиди и лигнани (ацетоксипинорезнол, пинорезинол). Интересното е, че съдържа значително по-високи концентрации на фенолни антиоксиданти и сквален, отколкото рафинираните необработени и семенни масла. Освен това семенните масла, които съдържат много ниски количества сквален, нямат нито един от фенолните антиоксиданти, които присъстват в необработените и рафинирани маслинови масла [19]. Точният състав на зехтина зависи не само от условията на растеж през годината, предхождаща реколтата, но и от степента на зрялост на плодовете и техническата обработка (студено пресоване, рафиниране) [20].
ПАТОФИЗИОЛОГИЯ НА NAFLD, ДИЕТНИ МАСТНИ И ХЕПАТИЧНИ ЛИПИДИ
Мастната обмяна в мастния черен дроб
Прекомерният неподходящ хранителен прием на мазнини, съчетан с периферна инсулинова резистентност, продължителна хидролиза на TG чрез липопротеин липаза и други генетични промени в ключовите метаболитни пътища на липидите води до повишена концентрация на FFA в кръвта [21], което води до прекомерно натрупване на мускулна мазнина и повишена чернодробна концентрация на TG и естери на холестерола . Високата концентрация на TG в кръвта под формата на VLDL има тенденция да съпътства това състояние и предизвиква протеинова активност на трансфер на холестеролов естер, което води до повишен трансфер на TG от VLDL към липопротеин с висока плътност (HDL) и последващо увеличаване на HDL клирънса и намалена концентрация на HDL [ 21].
Инсулинова резистентност в мастния черен дроб
Периферната инсулинова резистентност засяга метаболизма на въглехидратите и мазнините, причинявайки натрупване на TG в черния дроб. Устойчивостта на инсулинова стимулация на усвояването на глюкоза чрез глюкозен транспортер-4 от скелетни мускули и мастна тъкан, заедно с инхибирането на липолизата в мастната тъкан от инсулин, отклонява глюкозата към черния дроб, където инсулинът продължава да стимулира de novo липогенезата и да увеличава потока на мастни киселини от мастна тъкан до черния дроб [6,22]. В резултат на това концентрацията на TG в черния дроб се увеличава. Не е ясно как нарушението на износа на липиди чрез VLDL секреция, β-окислението на FFA или други метаболитни пътища води до невъзможност за поддържане на баланса на мазнините, което води до развитие на мастен черен дроб [22].
Мазнините предизвикват чернодробна инсулинова резистентност
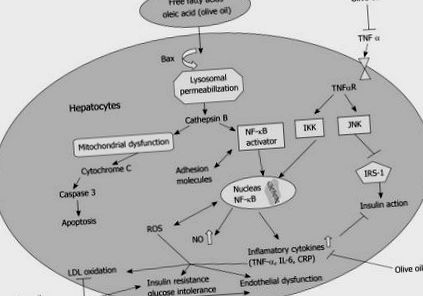
Механизмът, лежащ в основата на индуцирана от мазнини чернодробна инсулинова резистентност, не е разбран. Последни доказателства сочат към натрупване на мастни метаболити (IL-6, TNF-α), които активират различни пътища на трансдукция на сигнала, като серин/треонин кинази, т.е. протеин киназа-C (PKC), c-JUN NH2-терминална киназа-1, (JNK) и инхибитор на каппа В киназа, като ключово събитие по пътя на индуцирана от мазнини чернодробна инсулинова резистентност. Ефектите надолу по веригата включват: ядрен фактор-kappaB (NF-κB) и транслокация на активатор протеин-1 в ядрото, което води до повишено производство на възпалителни цитокини, които инхибират инсулиновото действие [6,23] (Фигура (Фигура 1). 1). В условия на инсулинова резистентност, излишните липидни метаболити като диацилглицерол могат да причинят инсулинова резистентност чрез активиране на ПКК, която се свързва с инсулиновия рецептор и инхибира неговата тирозин киназна активност. Активирането на PKC може също да повлияе на способността на инсулина да фосфорилира инсулиновия рецепторен субстрат-2 [24].
Молекулярен механизъм на ползата от олеиновата киселина при NAFLD. Повишените нива на TNF-α водят до активиране на свързаните със стреса протеинкинази (IKKβ, JNK), които индуцират NF-kB транслокация в ядрото, което води до повишено производство на възпалителни цитокини и намалена инсулинова чувствителност. Инсулиновата чувствителност допълнително се нарушава от JNK-медиирано фосфорилиране на IRS-1. В обстановката след хранене или след прекомерен неподходящ хранителен прием, свободните мастни киселини се доставят в черния дроб, поглъщат се и се натрупват в хепатоцитите. Това води до вътреклетъчната транслокация на Bax към лизозомите, което води до повишен катепсин В. Това води до NF-κB транслокация в ядрото с повишено производство и освобождаване на TNF-α и повишена инсулинова резистентност. Катепсин В също причинява митохондриална дисфункция, водеща до апоптоза на хепатоцитите и прогресия към NASH. Илюстрирана е ролята на зехтина в намаляването на NF-κB активирането, намаляването на LDL окисляването и в подобряването на инсулиновата резистентност.
Връзки между хранителни навици, инсулинова резистентност, постпрандиална липемия и затлъстяване на черния дроб
В условията на прекомерен прием на хранителни мазнини, високи нива на FFAs се доставят в черния дроб. Стимулирането на хепатоцитите от FFAs води до вътреклетъчната транслокация на Bax към лизозомата. Лизозомната пропускливост е повишена, което води до освобождаване на катепсин В. Наличието на каптепсин В в цитозола причинява NF-κB транслокация в ядрото с повишено производство и освобождаване на TNF-α, което инхибира инсулиновото действие. Катепсин В също индуцира митохондриална дисфункция, водеща до апоптоза на хепатоцитите и прогресия от затлъстяване на черния дроб до стеатохепатит (Фигура (Фигура1 1) [25].
Съобщава се за нарушен постпрандиален TG отговор при пациенти с NASH. Това може да насърчи проникването на мазнини в черния дроб чрез увеличаване на приема на TG в периода след хранене [26]. Подобрената липогенеза се появява като видна аномалия на чернодробния мастен метаболизъм при пациенти с NASH; приносът на чернодробната липогенеза към секрецията на TG е 3 пъти по-висок при пациенти с NAFLD в сравнение със здравите контроли [27]. Пациентите с NASH са имали значително по-високи през нощта глюкоза на гладно или FFA в сравнение с контролите, както и по-високи наситени и мононенаситени нива и в двете изследвани липидни фракции, главно поради увеличаване на палмитат, палмитолеат и олеинови киселини [28]. Пациентите с NASH показват изчерпване на PUFA (n-3 и n-6) в чернодробните триглицероли. Това е резултат от дефектна десатурация на PUFA или от по-висока липидна пероксидация [28]. Диетата на пациенти с NAFLD, които са били свободни от хиперлипидемия, диабет и затлъстяване, е била по-богата на наситени мазнини и по-бедна на PUFAs [29]. И накрая, богата на MUFA диета подобрява отговорите на глюкоза, липиди и глип-1 след хранене при субекти, устойчиви на инсулин. Поглъщането на закуска на основата на зехтин намалява нивата на глюкоза и инсулин след хранене [30].
ДИЕТЕТНИ МУФИ И NAFLD: ЧОВЕШКИ ИЗСЛЕДВАНИЯ
NAFLD, хипертония и хипертриглицеридемия са основните компоненти на метаболитния синдром. Четири клинични проучвания са документирали благоприятния ефект на MUFAs при понижаване на кръвното налягане [40–43]. Освен това, други 6 диетични проучвания, оценяващи ефекта от приема на MUFA върху кръвното налягане, показаха благоприятни ефекти [44]. Въпреки че има някои противоречия в тези проучвания, MUFA от зехтин в контекста на средиземноморската диета играе роля в първичната профилактика на NAFLD.
ДИЕТОВИ МУФИ И NAFLD: ИЗСЛЕДВАНИЯ НА ЖИВОТНИТЕ
маса 1
Ефект на зехтина върху процента мастни киселини в черния дроб на плъх
- Безалкохолни мастни чернодробни заболявания (NAFLD) Симптоми, причини; Лечение
- Безалкохолна мастна чернодробна болест (NAFLD) за предотвратяване на средиземноморската диета и физическата активност
- Безалкохолна мастна чернодробна болест и диабет тип 2; докоснетеENDOCRINOLOGY
- Безалкохолна мастна чернодробна болест MedlinePlus Genetics
- Безалкохолна мастна чернодробна болест при деца