B. J. Chacko *, S. Palanisamy 1, N. L. Gowrishankar, J. Honeypriya 2 и A. Sumathy
Катедра по фармация, Първи колеж по фармация, Palakkad-678 551, Индия
1 Училище по фармация, Международен медицински университет, Куала Лумпур-57000, Малайзия
2 Научен сътрудник, Катедра по химическо инженерство, Индийски технологичен институт-Бомбай (IIT-B), Мумбай-400 076, Индия
| Дата на подаване | 06 юли 2016 |
| Дата на ревизия | 07 април 2017 |
| Дата на приемане | 03 януари 2018 г. |
| Indian J Pharm Sci 2018; 80 (2): 215-222 |
Това е статия с отворен достъп, разпространявана при условията на лиценза Creative Commons Attribution-NonCommercial-ShareAlike 3.0, която позволява на другите да ремиксират, ощипват и надграждат върху произведението с нетърговска цел, стига авторът да бъде кредитиран и новите творения са лицензирани при еднакви условия
DOI: 10.4172/фармацевтични науки.1000348
Резюме
Насочването на лекарствата към мозъка е един от най-трудните въпроси за фармацевтичните изследвания, тъй като кръвно-мозъчната бариера действа като непреодолима пречка за преминаването на системно доставени терапевтични средства и атрибутите на извънклетъчната матрица на мозъка за лошото разпространение на местно доставени лекарства. Сред различните инвазивни или неинвазивни методи за гарантиране на кръвно-мозъчна бариера, наночастиците са един от обещаващите начини за прилагане на лекарства за централната нервна система. Концепцията за насочване на лекарства, базирани на наночастици, постига огромен напредък и гигантска ера за преодоляване на горните ограничения с подобрена ефикасност на лекарствата и намалена лекарствена токсичност. През последните години в авангарда на медицинската наука се появиха нови стратегии за повърхностноактивно покритие на биоразградими полимерни наночастици, които се различават от конвенционалните методологии за насочване на мозъка. Нейоногенното повърхностно активно вещество, полисорбат 80 като покривен материал, обещава несравнима възможност за подобряване на мозъчното насочване на колоидни частици. Целта на този преглед е да се оцени потенциалното приложение на наночастици, покрити с повърхностноактивно вещество като система за носене на лекарства за различни заболявания на централната нервна система.
Ключови думи
Кръвно-мозъчна бариера, полисорбат 80, насочване на мозъка, наночастици, сърфактант, полимери
Ендотелните клетки на ВВВ се характеризират с отсъствието на фенестрации, по-обширни стегнати непрекъснати периферни кръстовища, липса на лимфен дренаж и липса на основни антигени на хистосъвместимост [26] и експресия на различни транспортери, включително GLUT1, LAT1, ефлуксни транспортери като р-гликопротеин (P-gp) [27] и протеини, свързани с мултирезистентност [28,29]. Поради уникалните свойства на BBB, парацелуларният транспорт на хидрофилните лекарства практически отсъства, а трансцелуларният транспорт чрез пасивна дифузия е достъпен само за молекули, които отговарят на определени критерии като: 1) молекулното тегло е по-малко от 500 Da; 2) съединенията са обединени; 3) log P стойността на лекарството е близка до 2; 4) кумулативният брой водородни връзки е не повече от 10 [30]. BBB инхибира транспорта на 98% от всички лекарства с малки молекули и 100% от лекарства с големи молекули в мозъка [31,32]. Освен това, дори след успешна ендотелна клетъчна абсорбция, активните ефлуксни механизми (ATP-свързващ касетен транспортер) могат да изпомпват тези молекули обратно в кръвния поток [33]. Така че терапевтичните стратегии за различни активни лекарства на централната нервна система (ЦНС) са ограничени.
Различни стратегии за насочване на лекарства към мозъка
Молекулярните троянски коне са генетично конструирани протеини или пептид, втори пептид или пептидомиметично моноклонално антитяло, което се свързва със специфичен рецептор на BBB и преминава през BBB чрез ендогенни транспортни процеси, медиирани от ендогенни рецептори. Молекулярните троянски коне осигуряват неинвазивно доставяне на терапевтични средства с големи молекули до човешкия мозък. Троянският кон позволява медиирана от рецептора доставка на слетия протеин през BBB, така че протеиновото лекарство да влезе в мозъка и да упражни желания фармакологичен ефект [48,49].
В наши дни широко се използват транспортери на разтворени носители (SLC), които се състоят от група от над 300 протеини, свързани с мембраната. Тези протеини улесняват транспорта на широк спектър от субстрати през различни биологични мембрани, които имат важна роля във физиологичните процеси. Улеснява клетъчното усвояване на хранителни вещества и усвояването на лекарства и други ксенобиотици [50]. Голям брой SLC транспортери демонстрират обогатена експресия в човешкия BBB, а лекарствените транспортери с императивни роли при бъбречно и чернодробно разположение на наркотици са изразени на подобни или по-високи нива в BBB. SLC транспортерите в BBB играят жизненоважна роля за поддържане на хомеостазата на ЦНС на невротрансмитери, аминокиселини, витамини и различни други основни хранителни вещества. Тези транспортери могат да бъдат насочени към постигане на доставка на ЦНС на лекарства за лечение на невродегенеративни и други заболявания на ЦНС [51].
През последните няколко десетилетия значителни изследователски усилия показаха, че колоидните носители, особено наночастици и липозоми, поставят интересно подобрение за ефективно системно и локално доставяне на терапевтични средства в ЦНС [52,53]. От тези резултати от лечението биоразградимите, биосъвместими полимерни наночастици постигнаха огромен напредък поради тяхната ниска токсичност, повишена бионаличност, контролирано освобождаване, огромна специфична повърхност и саморегулиране на освобождаването на лекарството [54-56]. Наночастиците всъщност са твърди колоидни частици с размери от 10 до 1000 nm. Те се състоят от макромолекулни материали, в които активният компонент (лекарство или биологично активен материал) е разтворен, заклещен, капсулиран и/или към който активният компонент е адсорбиран или ковалентно свързан, сега са намерили достъп до съответните специализирани енциклопедии [23,57 ]. Основните ползи от използването на наночастици като носители на лекарства включват повишаване на разтворимостта и намаляване на разграждането на терапевтичния агент и удължаване на времето на престой чрез увеличаване на времето за контакт между лекарството и целта [58]. Поради преференциалното натрупване на целевото място, терапевтичният агент може също да покаже намалена токсичност и подобряване на ефикасността [59,60].
Вълнуващо развитие на универсалната система за доставяне на лекарства до мозъка на базата на „магически куршум“ до мозъка [61], основните цели, които трябва да се имат предвид, са размерът на частиците [62], повърхностните свойства, както и изхвърлянето на лекарства [63] или активната съставка за постигане на най-висока ефикасност [64]. Размерите на наночастиците варират от 10-100 nm за предпочитане за целенасочено доставяне в мозъка, но размерите на наночастици под 230 nm с полидисперсност от 0,10 също са използвани за доставка на мозъка [65]. Както е показано от редица проучвания, повърхностната модификация на наночастиците позволява тяхното навлизане в мозъка след интравенозно приложение чрез избягване на BBB и защитен механизъм [66-68]. Друго важно предимство на тази технология е, че тя не изисква никаква модификация на лекарствената молекула за доставяне на мозъка, което се постига чрез маскиране на неблагоприятните физикохимични характеристики на вградената молекула [44].
Подход, основан на повърхностноактивно вещество, за удължаване на задържането в мозъка на полимерни наночастици
Benvegnu и сътр. Проучването прави очевидно, че натоварените с халоперидол полимербатни поли (-капролактон) нанокапсули намаляват неговите неблагоприятни двигателни странични ефекти, както и окислителните увреждания в екстрапирамидния мозъчен регион по отношение на свободния халоперидол при плъхове модел на псевдопсихоза [56]. По подобен начин P80 (поли (оксиетилен) -сорбитан-20-моноолеат) може да се използва за забавяне на опсонизацията. Нанокапсулите Lipidcore, стабилизирани с P80, показват ефективно доставяне на лекарства в мозъка [60].
Изследването, докладвано от Sun et al. потвърди, че дори частичното покритие на покритието P80 играе решаваща роля за взаимодействието между наночастиците и ендотелните клетки на мозъчните микросъдове и влизането в ЦНС при насочване на наночастици към мозъка [79]. По-нататък през 2008 г. Wilson et al. демонстрира, че мозъчната концентрация на интравенозно инжектирани такрин и ривастигмин може да се повиши над 4,07 и 3,82 пъти чрез свързване с PBCA наночастици, покрити с 1% нейонен сърфактант P80, като същевременно намалява натрупването на лекарства в черния дроб и далака [80].
Друго проучване отчита антитуморните ефекти на покритите с P80 наночастици гемцитабин PBCA in vitro и фармакодинамичните ефекти in vivo върху C6 глиомни клетки на модел на мозъчен тумор. Различни препарати (физиологичен разтвор, самостоятелно гемцитабин или 1% покрити с P80 наночастици гемцитабин PBCA) се инжектират в модела на мозъчния тумор, който е получен след инокулиране на клетки C6 глиома в плъхове Sprague Dawley за 14 дни, беше показано, че 1% покрито с P80 покритие наночастиците на гемцитабин PBCA могат значително да удължат времето за оцеляване в сравнение с контрола на физиологичния разтвор [81].
Изследване сравнява концентрацията на мозъчната тъкан и постига след интравенозно доставяне на чист разтвор на бакозид-А и покрити с P80 наночастици PLGA. Те демонстрираха, че при изследване на плъхове Wistar in vivo в сравнение с чист лекарствен разтвор (2,56 ± 1,23 μg/g тъкан), по-висока мозъчна концентрация на бакозид-А (23,94 ± 1,74 μg/g тъкан), което предполага значителна роля на наночастиците с повърхностно покритие за насочване на мозъка [82].
Gelperina et al. [78] проучване оценява острата токсичност на DOX, свързана с покрити с P80 наночастици при здрави плъхове и за установяване на терапевтичен диапазон на дозата за тази формулировка при плъхове с интракраниално имплантиран 101/8 глиобластом. Наличието на P80 във формулировките не е свързано с промени в токсичността в сравнение със свободно или наночастично лекарство. Резултатите при плъхове, носещи тумор, са подобни на тези при здрави плъхове.
Тези резултати показват, че токсичността на DOX, свързан с наночастици, е сходна или дори по-ниска от тази на свободния DOX. Установено е, че критичната концентрация на P80 покритие върху наночастици за максимална транслокация на кръв към мозъка в повечето изследвания е (1% w/w) [78]. В някои проучвания е доказано, че до (2% w/w) концентрация на P80 е ефективна или мозъчно насочване на наночастици [83,84]. В повечето проучвания за покритие 1% w/v P80 се добавя към суспензии от наночастици и се инкубира в продължение на 30 минути при постоянно разбъркване и накрая се лиофилизира [85,86].
Насочените полимерни наночастици притежават адекватна стабилност при съхранение. За системно доставяне, наночастиците, покрити с P80 или PEG свързани наночастици за насочване, също трябва: 1) да са стабилни в кръвта, 2) да избягват RES и 3) да имат удължено време на циркулация [87]. За да обобщим тези обширни експериментални открития, наночастиците, покрити с нейоногенни повърхностноактивни вещества (особено P80), са в състояние да транспортират натоварените лекарства през BBB след приложение, което доставя инструменти, доставящи лекарства до мозъка.
Механизъм на медииран от наночастици медииран транспорт, транспортиран до мозъка
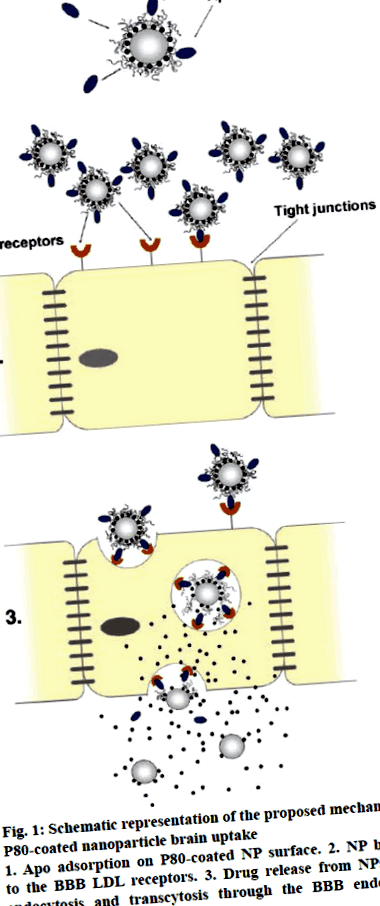
Фигура 1: Схематично представяне на предложения механизъм на поглъщане на мозъка от наночастици с покритие P80
1. Апо адсорбция на покрита с P80 NP повърхност. 2. NP свързване с BBB LDL рецепторите. 3. Освобождаване на лекарството от НП при ендоцитоза и трансцитоза през ендотелните клетки на ВВВ [35]
- 10 най-добри храни за възстановяване на мозъчни наранявания (въз основа на клинични доказателства)
- Промени в телесното тегло след дълбока мозъчна стимулация за обсесивно-компулсивно разстройство или депресия
- Препоръка за книга Гладният мозък Скот Й Йънг
- Наночастици от алуминиев оксид за пожарогасене и противопожарна защита Приложни наноматериали ACS
- Добавка за усилване на мозъка Ноотропни витамини за добра памет за добра памет (60 броя) Groupon