Свързани термини:
- Ейкозаноиден рецептор
- Сутеренна мембрана
- Колаген
- Извънклетъчна матрица
- Извънклетъчни матрични протеини
- Аксон
- Пептид
- Протеин
- Клетка адхезия
- Фибронектин
Изтеглете като PDF
За тази страница
ИЗВЪНЧЕЛНА МАТРИЦА | Сутеренни мембрани
Ламинин
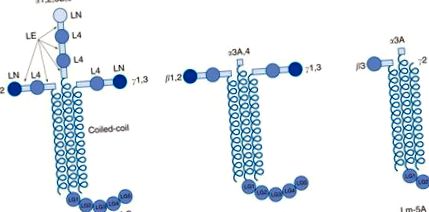
Ламинините представляват основния неколагенен компонент на BM. Ламинините са хетеротримерни гликопротеини, състоящи се от една α, една β и една γ-верига (Фигура 3). Петнадесет изоформи на ламинин са идентифицирани от комбинации от пет α-, четири β- и три γ-вериги (Таблица 1). Α-, β- и γ-веригите споделят структурни хомологии, включително N-терминални домейни на ламинин (LN), ламинин епидермален растежен фактор (EGF) -подобни повтарящи се домейни (LE), домини на ламинин 4 (L4) и Дълги рамена с спирална спирала с α-спирала. Уникални за α-веригите са големите С-терминални ламинини глобуларни (LG) домейни, които се състоят от пет по-малки единици (LG1-5). Тези α-верижни LG домейни понякога се разцепват от протеази, за да ги направят по-малки. За подгрупа от ламининови вериги (особено ламинин α3β3γ2 или ламинин-5), N-крайните къси рамена са отсечени и/или разцепени от протеази.
Фигура 3. Обща структура на ламинините. Хетеротримерите на ламинин (Lm) (с арабски числа) съществуват в три форми: кръстовидна, Y- или Т-образна и пръчковидна. Глобуларните домени на късите рамена, N-терминал на ламинин (LN) и ламинин четири (L4), са разделени от подобни на пръчки ламинини EGF-подобни повторни домени (LE). Α – β – γ веригите се тримеризират през домейните с навита спирала, за да образуват дългото рамо. С-терминалният LG домейн е уникален за α вериги.
Маса 1 . Хетеротримери на ламинин и верижен състав
| Ламинин-1 | α1β1γ1 |
| Ламинин-2 | α2β2γ2 |
| Ламинин-3 | α1β2γ1 |
| Ламинин-4 | α2β2γ1 |
| Ламинин-5А | α3Aβ3γ2 |
| Ламинин-5В | α3Bβ3γ |
| Ламинин-6А/В | α3A/Bβ1γ1 |
| Ламинин-7А/В | α3A/Bβ2γ1 |
| Ламинин-8 | α4β1γ1 |
| Ламинин-9 | α4β2γ1 |
| Ламинин-10 | α5β1γ1 |
| Ламинин-11 | α5β2γ1 |
| Ламинин-12 | α2β1γ3 |
| Ламинин-14 | α1β2γ3 |
| Ламинин-15 | α1β5γ3 |
Извънклетъчна матрица
Ламинин
Ламинините са кръстообразни молекули, които се състоят от няколко различни типа и са част от развитието на белите дробове [1, 77–79]. Анализът на развиващия се бял дроб показва експресията на някои ламининови вериги още в 10 седмици от човешката бременност [80]. Ламинините се експресират по протежение на базалната мембрана, но е документирано времево и пространствено изразяване на различни субединици на ламинин [25, 81]. Експресията на ламинин може да играе роля в диференциацията на клетките в белия дроб, както и в други тъкани. Има някои доказателства, които предполагат, че ламининът може да играе роля в алвеоларната морфогенеза [82]. Взаимодействието ламинин-хепаран сулфат може да бъде от съществено значение за образуването на лумен и разклоняващата се морфогенеза [83] .
Съображения за проектиране при проектиране на нервна тъкан от стволови клетки
2.1.3 Ламинин
Ламининът е протеин, който споделя няколко свойства с фибронектина. Например, той също има високо молекулно тегло. Ламининният протеин се състои от три субединици, включително α, β и γ вериги, както е показано на фиг. Ламинините също се считат за гликопротеини, тъй като те са функционализирани с олигозахариди [3]. В извънклетъчния матрикс ламининът може да свързва други молекули на ламинин, както и други протеини като колаген, което помага да се засили структурата на извънклетъчната матрица. Клетките също могат да се свържат с ламинин чрез интегриновите рецептори, върху които те експресират в клетъчните си мембрани [15]. Тези свойства правят ламинините привлекателни за употреба като субстрати на клетъчни култури както за плюрипотентни стволови клетки, така и за нервни клетки [16,17]. Протоколите за диференциране на стволови клетки в зрели фенотипи често изискват култура върху 2D ламининови субстрати. Ламининът също играе ключова роля в развитието на нервната система, тъй като аксоните са склонни да мигрират върху този протеин, което го прави привлекателен за регенеративна медицина [18]. И накрая, ламининът се намира в нишата на невронните стволови клетки, където допринася свойствата си на свързване на растежния фактор със специализирани структури, известни като фрактони [19] .
Фиг. 2. Молекулярната структура на ламинина. Състои се от три субединици, наречени α, β и γ.
Препечатано с разрешение от Plantman S. Прорегенеративни свойства на ECM молекулите. BioMed Res Int 2013; 2013.
Невропатология
Едоардо Малфати, Норма Беатрис Ромеро, в Наръчник по клинична неврология, 2018
Ламинин α2
Фиг. 30.10. Флуоресцентно имуномаркиране на ламинин α2. (A) Контрол, показващ оцветяване на базалната мембрана. (Б.) Намалена експресия на ламинин α2 в някои влакна и отсъстваща експресия в други при молекулярно потвърдена дистрофия, свързана с ламинин α2. (° С) Пълна липса на оцветяване.
Молекули на извънклетъчната матрица (ECM)
3.5.1 Ламинини
Кръстосан разговор между възпаление и извънклетъчен матрикс след миокарден инфаркт
Yonggang Ma,. Merry L. Lindsey, в Възпаление при сърдечна недостатъчност, 2015
4.5.4 Ламинини
Ламинините, първите ECM гликопротеини, откриваеми в ембриона, се намират в базалната мембрана. Ламинините се състоят от три пептидни вериги: α, β и γ. Протеинът на ламинин се открива в зоната на инфаркта на 3-ия ден след ИМ, достига връх в концентрацията на 7-11-ия ден и след това се връща към изходните нива [69]. Широкото съществуване на ламинини в цялата зона на инфаркта предполага, че те могат директно да регулират възстановяването на ЛН след МИ [69]. При пациенти с остър ИМ, нивото на серумния ламинин е по-високо, отколкото при пациенти със стабилна коронарна артериална болест и такива без коронарна артериална болест [70]. Този доклад предполага възможността серумният ламинин да бъде потенциален прогностичен маркер за пациенти с ИМ.
Молекулни и извънклетъчни сигнали в спецификацията и диференциацията на моторните неврони
Ламинин
Ламинините са големи (
800 kDa) Свързани с ECM гликопротеини, за които се смята, че са от съществено значение за невронната миграция и намирането на аксона по време на развитието. Те са хетеротримерни молекули, състоящи се от α, β и γ вериги. Тези вериги се представят в различни комбинации, за да се получат до 18 различни изоформи на ламинин, повечето от които присъстват в ECM на нервната система. 54 S-ламининът е хомолог на В1 субединицата на ламинин. Известно е, че улеснява MN адхезията и играе важна роля в образуването на нервно-мускулни връзки. В развиващата се ЦНС се установява, че S-ламининът и ламининът присъстват в подложката в мозъчната кора. 55 Тази ситуация се променя драстично в ЦНС за възрастни, което е белязано от изчезването на S-ламинин и ограничената експресия на ламинин към базалната мембрана, където се намира в тясна връзка с протеогликани от колаген и хепаран сулфат (HSPG). 51
Ламинините са важни съставки на базалната мембрана на ПНС, намираща се около клетките на Шван. Като интегрални адхезивни и стимулиращи растежа съставки на базалната мембрана, се смята, че те организират заедно мрежата от структурни протеини, за да образуват субстрата, върху който може да се осъществи миграцията на невроните и намирането на аксона. 56 Разнообразието от изоформи на ламинин може да бъде изгодно при регулиране на селективното свързване на MN, което се съобщава чрез S-ламинин-специфична LRE (левцин-аргинин-глутаминова киселина) аминокиселинна последователност. 57
Интегринова регулация на белодробния епител
5.1.2.1 Ламинини
Ламинините, заедно с колаген IV, осигуряват съществена структурна подкрепа за белия дроб и са основните компоненти на белодробната базална мембрана. Ламинините са хетеротримерни протеини, съставени от една α, една β и една γ верига и имат 16 потвърдени или прогнозирани човешки изоформи, образувани от пет α вериги, три β вериги и три γ вериги [30]. Феталната белодробна базална мембрана съдържа ламинини с всичките пет възможни α вериги. За разлика от тях, белодробният епител на възрастни ограничава експресията на α веригата до ламинин α3 и α5 [31–33] .
Целевите делеции или инхибиране на субединицата на ламинин демонстрират изискването за ламинини в развитието на белия дроб [34,35]. Инхибирането на ламинин α1 във феталните белодробни експланти води до разклонени дефекти на морфогенезата и нарушена епителна полярност [36]. Глобалната делеция на ламинин α5 води до загуба на плода в средата на късната бременност, свързана с нарушена лобарна септация на белия дроб [37]. Индуцируемата делеция на белодробен епител на ламинин α5 демонстрира допълнителни роли в развитието на белите дробове. Тези мишки са починали от дихателна недостатъчност малко след раждането. Въпреки това, хистологичното изследване на белите им дробове в края на развитието на белия дроб на плода разкрива дефекти на диференциация на епитела, разширени дистални въздушни пространства, повишена апоптоза и намалена пролиферация в цели белодробни секции [38] .
Ролята на ламинин 332 по време на развитието на белия дроб е изследвана с помощта на глобални и тъканно специфични миши делеции, фетални белодробни експланти и in vitro проучвания. Експресията на ламинин 332 се локализира изключително на базалната повърхност на епителните клетки във феталната белодробна базална мембрана. За разлика от ламинин а1 и а5, веригата у2 (специфична за ламинин 322) не е необходима за разклоняване на морфогенезата или диференциация на фетални белодробни епителни клетки. Хистологичният анализ на белите дробове от ламинин γ2 -/- мишки демонстрира дезорганизирани хемидесмозоми в трахеалния епител, но тези мишки запазват нормална епителна цялост и белодробна функция [39]. Ролята на ламинин γ2 в белия дроб на възрастни не е разгледана с този генетичен подход, тъй като тежките кожни дефекти в ламинините γ2 -/- мишки водят до перинатална леталност от недохранване [40]. Ламинин 322 се експресира и в белодробната базална мембрана за възрастни. В този контекст, специфичната делеция на белодробен епител на ламинин α3 демонстрира ролята на тази ламининова изоформа в развитието на белодробна фиброза [41]. Тези мишки нямат фенотип на развитието, но показват повишена смъртност, възпаление и фиброза след интратрахеално предизвикателство на блеомицин.
Намиране на Axonal Path: Роля на извънклетъчната матрица
Ламинини
С оглед на широкото разпределение на ламинините и способността на ламинин-1 да стимулира силен растеж на аксоните от много типове неврони, се смята, че ламинините функционират разрешително, осигурявайки адхезия, необходима за миграцията на конуса на растежа, но не по поучителен начин влияние върху решенията за намиране на път Ламинините и други ECM молекули могат да насърчат широко миграцията на конуса на растежа по път, чиито граници се определят не от липсата на адхезивни ECM молекули, а по-скоро чрез изразяването в съседни тъкани на отрицателни ориентировъчни сигнали, като прорези или семафорини. Това „отблъскване на съраунд“ се среща както в развиващата се ЦНС, така и в ПНС. Няколко мутационни проучвания съобщават за специфични грешки при намирането на път, когато ламинин отсъства или е блокиран. Функцията на ламинина е от съществено значение за завъртането на конуса на растежа в пъпката на крайника на скакалец, а рибите зебра с мутации във веригата ламинин-алфа-1 проявяват множество дефекти в насочването на аксона в цялата ЦНС, но не на всяко място. Тези резултати предполагат, че медиираната от ламинин адхезия е жизненоважна за навигацията на конуса на растежа поне в някои случаи.
Организационна клетъчна биология
Ламинини
Въпреки че ламининната номенклатура е претърпяла няколко повторения, настоящата председателстваща номенклатура определя всеки член на семейството на ламинините от съответния състав на субединицата. Например, ламинин 111 е съставен от α1, β1, γ1 субединици, докато ламинин 511 е съставен от α5, β1 и γ1 субединици (Aumailley et al., 2005). Ламининовите тримери се образуват чрез неслучайно сглобяване на една от петте α, четири β и три γ вериги, за да се получат най-малко 15 известни различни хетеротримери (Aumailley et al., 2005). Молекулното тегло на ламинин 111 е
Самосглобяването на ламининната мрежа се случва на клетъчната повърхност и се осъществява чрез взаимодействие на трите „къси рамена“ на ламининовата кръстообразна молекула (Hohenester and Yurchenco, 2013). За отбелязване е, че ламинините, на които липсват къси рамена, като 411 и 421, не са в състояние самостоятелно да се полимеризират, за да образуват мрежа, въпреки че могат да бъдат включени в мембраните на сутерена чрез взаимодействие с други форми на ламинин. „Дългото рамо“ на ламининовия кръст съдържа LG домейните, които са основните места за свързване на ламинин рецептор, включително интегрини, свързващи ламинин и α-дистрогликан (Yurchenco, 2011). В допълнение, протеогликанът агрин свързва γ1 на място в дългото рамо на молекулата с висок афинитет, което осигурява допълнителни връзки на ламининовите мрежи към клетъчните повърхности (Suh и Miner, 2013).
За сглобяването на базалната мембрана е необходима полимеризация на ламининната мрежа на клетъчната повърхност. Прекратяването на експресията на ламинин води до пълно отсъствие на базални мембрани в ембриона (Smyth et al., 1999). За разлика от това, делецията на колаген IV, другата основна белтъчна мембранна протеинова мрежа, не води до липса на ламининова мрежа и базалните мембрани се образуват до известна степен при нулеви мишки с колаген IV (Poschl et al., 2004). Въпреки това, базалните мембрани, произведени в отсъствието на колаген IV, в крайна сметка се провалят вероятно поради неспособност да се поддържа структурна цялост, което води до ембрионална леталност (Poschl et al., 2004).
- Непряка калориметрия - общ преглед на ScienceDirect теми
- Интеркостален нерв - общ преглед на ScienceDirect теми
- Умишлено отравяне - общ преглед на ScienceDirect теми
- Триглицерид със средна верига - общ преглед на ScienceDirect теми
- Метокарбамол - общ преглед на ScienceDirect теми