Въведение
Откриването на лептин преди петнадесет години генерира голямо вълнение, че е било открито лечение за затлъстяване и по този начин този прототипен секретиран от адипоцити протеин/цитокин е наречен лептин след гръцката дума „лептос“ за слаби. Той също така въвежда идеята, че мастната тъкан не е инертен орган за съхранение на енергия, а активен ендокринен орган. Последвалите клинични проучвания доведоха до първоначално разочарование, когато в крайна сметка беше установено, че лептинът е неефективен за лечение на затлъстяване (1). Оттогава изследователските усилия се разшириха до изясняване на ролята на лептина в човешката физиология и доведоха до фундаментално подновено разбиране за неговата роля в регулирането на енергийната хомеостаза, невроендокринната функция и метаболизма, главно в състояния на енергиен дефицит, а не на излишък на енергия (т.е. затлъстяване). В този преглед обобщаваме биологията и физиологията на лептина, неговата роля в патофизиологията на няколко нарушения и нововъзникващите терапевтични приложения на рекомбинантен човешки лептин.
Биологията на лептина
Лептинът, 167-аминокиселинен продукт на човешкия лептинов ген, първоначално е открит чрез позиционно клониране на ob/ob мишки, миши модел на затлъстяване, открит случайно в лабораториите на Джаксън (2). Установено е, че тези мишки имат хомозиготна мутация на лептиновия ген, водеща до пълен лептинов дефицит, който се проявява с хиперфагия, екстремно затлъстяване, диабет, невроендокринни аномалии и безплодие.
Лептинът се секретира главно от бяла мастна тъкан и нивата са в положителна корелация с количеството телесни мазнини (3). Подобно на много други хормони, лептинът се секретира пулсиращо и има значителна дневна вариация с по-високи нива вечер и рано сутрин (4, 5). Циркулиращите нива на лептин отразяват предимно количеството енергия, складирана в мазнини и вторично остри промени в приема на калории (4-8) (Таблица 1).
маса 1
| * Излишната енергия, съхранявана като мазнини (затлъстяване) |
| * Прехранване |
| Глюкоза |
| Инсулин |
| Глюкокортикоиди |
| Естрогени ‡ |
| Възпалителни цитокини, включително туморен фактор на некроза-α и интерлевкин-6 (остър ефект) |
| Фактори, инхибиращи секрецията на лептин |
| * Ниско енергийни състояния с намалени запаси от мазнини (стройност) |
| * Гладуване |
| Катехоламини и адренергични агонисти |
| Тиреоидни хормони |
| Андрогени ‡ |
| Пероксизомни пролифератор-активирани рецептор-γ (PPARγ) агонисти † |
| Възпалителни цитокини, включително туморен фактор на некроза-α (удължен ефект) |
Лептинът медиира своите ефекти чрез свързване със специфични рецептори за лептин (ObRs), експресирани в мозъка, както и в периферните тъкани. Алтернативното сплайсинг генерира няколко изоформи на ObRs. Смята се, че изоформата на ObRa (късата изоформа на лептинов рецептор) играе важна роля при транспортирането на лептин през кръвно-мозъчната бариера (11). Изоформата на ObRb (изоформата на дългия рецептор за лептин) медиира трансдукция на сигнала и е силно изразена в хипоталамуса, важно място за регулиране на енергийната хомеостаза и невроендокринната функция (12-14).
Свързването на лептин с ObRb рецептора активира няколко пътища за предаване на сигнала, включително Janus Kinase-Signal Transducer и Activator of Transcription-3 (JAK-STAT3), което е важно за регулирането на енергийната хомеостаза (15), и фосфатидилинозитол 3-киназа ( PI3K), което е важно за регулиране както на приема на храна, така и на хомеостазата на глюкозата (16). Други пътища, включително активирана от митоген протеин киназа (MAPK), 5'аденозин монофосфат активирана протеин киназа (AMPK) и цел за рапамицин при бозайници (mTOR), са предложени да бъдат след лептина и са в процес на разследване (17).
Хомозиготни мутации на лептиновия ген, водещи до пълен дефицит на лептин, са описани в изключително редки случаи на затлъстели хора. По-голямата част от затлъстелите хора обаче имат високи нива на циркулиращ лептин (3) и са резистентни или толерантни към неговите ефекти за намаляване на теглото (18). Предложените хипоталамусни механизми, лежащи в основата на лептиновата резистентност, включват а) дефекти в или надолу по веригата на ObRb рецептора, б) индукция на инхибитори на лептинова сигнализация (напр. Супресор на цитокиновата сигнализация-3 (SOCS-3) (19)) и в) промени в транспорт на лептин през кръвно-мозъчната бариера (18, 20). Необходими са повече проучвания, за да се изяснят изцяло сигналните пътища на лептина и механизмите, лежащи в основата на лептиновата резистентност или толерантност при хората, което от своя страна може да доведе до разработването на нови възможности за лечение на затлъстяването и метаболитния синдром.
Ролята на лептина в човешката физиология и патофизиология
Най-значимите роли на лептина включват регулиране на енергийната хомеостаза, невроендокринната функция и метаболизма. Други ефекти на лептина, включващи регулиране на имунната функция (21, 22) и костния метаболизъм, са подложени на интензивни изследвания, но са извън обхвата на този клиничен преглед.
Ролята на лептина в енергийната хомеостаза
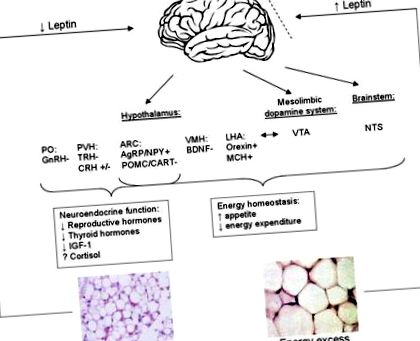
Циркулиращото ниво на лептин служи като измерител за енергийните резерви и насочва централната нервна система да регулира съответно приема на храна и енергийните разходи. Лептинът оказва незабавни ефекти, като въздейства върху мозъка, за да регулира апетита (Фигура 1). Чрез свързване на ObRb-рецептор в хипоталамуса, лептинът активира сложна невронна верига, състояща се от анорексигенен (т.е. намаляващ апетита) и орексигенен (т.е. стимулиращ апетита) невропептиди за контрол на приема на храна. Извън хипоталамуса лептинът взаимодейства с мезолимбичната допаминова система, която участва в мотивацията и възнаграждението на храненето, и ядрото на самотния тракт на мозъчния ствол, за да допринесе за ситост (17).
Съкращения: AgRP, протеин, свързан с Agouti; NPY, невропептид Y; ARC, дъговидно ядро; MCH, хормон, концентриращ меланин; LHA, странична хипоталамусна област; POMC, проопиомеланокортин; CART, кокаин и амфетамин-регулиран препис; BDNF, мозъчен невротрофичен фактор; VMH, вентромедиално хипоталамусно ядро; VTA, вентрална тегментална област; PVN, паравентрикуларно ядро; PO, преоптична зона; CRH, кортикотропин-освобождаващ хормон; GnRH, гонадотропин-освобождаващ хормон; TRH, тиреотропин-освобождаващ хормон; ACTH, адренокортикотропин.
В допълнение към непосредствените ефекти, дългосрочното приложение на лептин може да доведе до преоборудване на връзките между хипоталамусните неврони (т.е. насърчаване на синаптичната пластичност) (25, 26). По-конкретно, когато се прилага в мишки с дефицит на лептин, е доказано, че лептинът увеличава броя на синапсите върху невроните, които секретират анорексигенния невропептид Проопиомеланокортин (POMC) и намалява броя на синапсите върху невроните, които секретират орексигенния невропептид Невропептид Y (NPY) 26).
Лептинът не само сигнализира на централната нервна система да намали приема на храна, но и може да увеличи енергийните разходи. При мишки лептинът повишава симпатиковата нервна активност (27) и активира термогенезата на кафявата мастна тъкан (28, 29), но тези ефекти не са потвърдени при хора (30).
Клинично пациентите с вроден лептинов дефицит поради мутации в лептиновия ген или екстремна лептинова резистентност поради мутации на лептиновия рецепторен ген са затлъстели поради изразена хиперфагия (31, 32). За пациенти с лептинов дефицит, прилагането на лептин в заместващи дози намалява приема на храна чрез невронни вериги, които намаляват възприемането на наградата за храна и подобряват отговора на сигналите за ситост (33) и нормализират телесното тегло (34). Въпреки това, приложението на лептин във фармакологични дози при по-голямата част от хората със затлъстяване, които имат относително високи нива на лептин и са резистентни към него, води до малка загуба на тегло, ако има такава (1, 35). По този начин натрупването на доказателства предполага, че лептинът е физиологично по-важен като индикатор за енергиен дефицит и като възможен медиатор на адаптация към глада.
Ролята на лептина в регулирането на невроендокринната функция
В отговор на гладуване нивата на лептин бързо падат преди и непропорционално на всякакви промени в мастната маса (6, 7, 36), предизвиквайки невроендокринната реакция на острото лишаване от енергия (7, 36, 37). При мишки и хора този отговор включва намаляване на нивата на репродуктивен хормон, което предотвратява бременността (процес, изискващ енергия), намаляване на нивата на хормоните на щитовидната жлеза, които забавят метаболизма, увеличаване на нивото на хормона на растежа, което може да мобилизира енергийните запаси, и намаляване на инсулиноподобния растежен фактор - 1 (IGF-1) ниво, което може да забави свързаните с растежа процеси (7, 37, 38). Взаимодействията между лептин и растежния хормон и надбъбречните оси са очевидно по-малко важни при хората, отколкото при животинските модели, тъй като пациентите с вроден дефицит на лептин имат нормален линеен растеж и надбъбречна функция, за разлика от мишките (34, 38-40).
Първоначално наблюдавахме невроендокринни аномалии, когато индуцираното от глад спадане на нивата на лептин достигна средно 0,27 ng/ml, а приложението на лептин във физиологични заместителни дози възстанови промените в пулсативността на лутеинизиращия хормон, намалява нивата на тестостерон и намалява пулсирането на хормона, стимулиращ тиреоида 7). След това установихме дали има минимален лептинов праг, който да позволява репродукцията и да поддържа други невроендокринни процеси. Когато индуцирахме дефицит на лептин при жени с нормално тегло, които имат по-високи изходни нива на лептин, нивата на лептин спаднаха средно до 2,8 ng/ml (36). Наблюдавани са само умерени промени в LH пулсативността. Нашите открития показват, че прагът на лептин от n3 ng/ml е необходим, за да се предаде на мозъка съобщението, че енергийните запаси в мастната тъкан са достатъчни, за да доведат до бременност. Постигането на ниво на лептин над този праг, когато детето расте, позволява настъпването на пубертета (41) и при възрастни хора поддържа репродуктивни и други невроендокринни процеси.
Като се има предвид, че жените с нервна анорексия и индуцирана от упражнения аменорея са хронично лишени от енергия, първо направихме хипотезата, че тези състояния са свързани с хиполептинемия. Това беше потвърдено в наблюдателни проучвания (42-45). След това предположихме, че дългогодишната хиполептинемия води до невроендокринна дисфункция с последваща ановулация и остеопороза. Проведохме доказателство за концепция на лечение с лептин в заместителни дози при жени с хипоталамусна аменорея и установихме, че подобрява или напълно нормализира половите жлези, щитовидната жлеза и в по-малка степен осите на растежния хормон, както и костните маркери (46 ).
Ролята на лептина в инсулиновата резистентност и метаболитния синдром
Както ob/ob мишките, така и db/db мишките, които имат мутация на лептинов рецептор, както и хората с вроден дефицит на лептин имат инсулинова резистентност и други характеристики на метаболитния синдром. В щама ob/ob мишка лечението с лептин подобрява хипергликемията и хиперинсулинемията, преди да се постигне загуба на тегло (47). Доказано е също така, че лечението с лептин при хора с вроден дефицит на лептин подобрява не само хиперинсулинемията, но и нивата на липопротеиновия холестерол с ниска плътност, холестерола на липропротеините с висока плътност и триглицеридите (39). Тези ефекти се опосредстват чрез централни и периферни действия и механизмите все още са изяснени.
По същия начин, мишите модели на липоатрофия, при които липсва подкожна мастна тъкан, са хиполептинемични поради липса на мазнини, налични за производството на лептин, и имат метаболитни аномалии, включително хипергликемия, инсулинова резистентност и хиперлипидемия (48). Като се имат предвид подобренията в метаболитните параметри при ob/ob мишки след приложение на лептин, беше хипотезата, че липоатрофните мишки също могат да реагират на екзогенен лептин (49). Всъщност трансплантацията на мастна тъкан (48, 50), която произвежда лептин, и прилагането на екзогенен лептин (49) при липоатрофни мишки подобряват хипергликемията, инсулиновата резистентност, хипертриглицеридемията и чернодробната стеатоза. Това доведе до опити при хора с различни видове липоатрофия и свързани метаболитни аномалии (51-58), описани по-нататък в Клинични приложения.
В заключение, лептинът играе ключова роля в регулирането на енергийната хомеостаза, невроендокринната функция и метаболизма не само в състояния на излишък на енергия, но по-важното в състояния на енергиен дефицит. По този начин, липсата на лептин води до различни клинични фенотипи (Таблица 2) със свързани невроендокринни и метаболитни аномалии, за които рекомбинантен човешки лептин е нова потенциална терапия.
Таблица 2
| I. Вродени състояния с дефицит на лептин | ||
| А. Мутации на ген на лептин | ||
| Хомозиготен вроден дефицит на лептин | Редки | Ранно начало на морбидно затлъстяване, хиперфагия, хипогонадотропен хипогонадизъм, напреднала костна възраст, хиперинсулинемия и имунна дисфункция. Тези прояви се нормализират чрез лечение с лептин в заместващи дози. |
| Хетерозиготен вроден дефицит на лептин | Редки | По-малко тежко затлъстяване, което може да реагира на екзогенен рекомбинантен човешки лептин, въпреки че това остава да бъде проучено в интервенционни проучвания (59). |
| Б. Мутации, водещи до липоатрофия | ||
| Вродена липоатрофия | Редки | Липоатрофия, диабет и метаболитен синдром. Метаболитните аномалии се подобряват в отговор на приложението на лептин, но не са провеждани рандомизирани, контролирани проучвания. |
| II. Придобити състояния с дефицит на лептин | ||
| А. Генерализирано намаляване на масата на мастната тъкан | ||
| Анорексия нервна | До 2,2% разпространение през целия живот при жените (60) | Силно намалено телесно тегло и мастна маса, аменорея/безплодие, остеопороза със стрес фрактури, намалени нива на щитовидната жлеза, повишени нива на хормона на растежа и намалени нива на IGF-1. |
| Индуцирана от упражненията хипоталамусна аменорея и/или овулаторна дисфункция | Аменорея се съобщава при 60-69% при обучени жени спортисти и овулаторна дисфункция при до 78% от спортистите развлечения (61) | По-нисък процент телесни мазнини със или без намалено телесно тегло, аменорея/безплодие, остеопороза и невроендокринни аномалии, изброени по-горе. Аномалиите се подобриха в отговор на лечението с лептин в контролирано проучване с доказателство за концепция (46). Текат по-големи, рандомизирани, плацебо контролирани проучвания. |
| Неатлетични форми на хипоталамична аменорея | 7,6% при жени на възраст 15-24 години, 3,0% при жени на възраст 25-34 години и 3,7% при жени на възраст 35-44 години (62) | Относително нормално или леко намалено телесно тегло, но по-нисък процент на телесни мазнини, аменорея/безплодие и невроендокринни аномалии, изброени по-горе. |
| Б. Селективно намаляване на масата на мастната тъкан | ||
| Придобита тежка липоатрофия и инсулинова резистентност | Редки | Липоатрофия, инсулинова резистентност, хиперхолестеролемия и хипертриглицеридемия. Тези метаболитни аномалии се подобряват с заместване на лептин както в отворени (56), така и в рандомизирани, плацебо контролирани, кръстосани (55) клинични проучвания. |
| ХИВ липоатрофия | 15% - 36% от всички заразени с ХИВ пациенти (63) | |
Съкращения: IGF-1, инсулиноподобен растежен фактор-1; ХИВ, човешки имунодефицитен вирус; HAART, високоактивна антиретровирусна терапия.
- Роля на лептина при свързана със затлъстяването хипертония - Haynes - 2005 - Експериментална физиология - Wiley
- Безалкохолна мастна чернодробна болест Цироза Преглед на нейната епидемиология, рискови фактори, клинични
- Намалени нива на кърмене сред затлъстели майки преглед на допринасящи фактори, клинични
- Кожни инфекции при австралийски аборигенски деца разказ за разказ
- Хранителни вещества Без пълен текст Централната роля на желязото в човешкото хранене от народното до съвременното