Отдел по фармацевтични науки и Център за сърдечно-съдови изследвания и алтернативна медицина, Училище по фармация, Колеж по здравни науки, Laramie, WY, 82071 USA
Медицинско образование на WWAMI, Колеж по здравни науки, Университет на Уайоминг, Laramie, WY, 82071 САЩ
Департамент по математика, Университет Индиана, Пенсилвания, Индиана, Пенсилвания, 15705 САЩ
Медицински отдел, Бригам и женска болница, Харвардско медицинско училище, Бостън, Масачузетс, 02115 САЩ
Отдел по фармацевтични науки и Център за сърдечно-съдови изследвания и алтернативна медицина, Училище по фармация, Колеж по здравни науки, Laramie, WY, 82071 USA
Отдел по фармацевтични науки и Център за сърдечно-съдови изследвания и алтернативна медицина, Училище по фармация, Колеж по здравни науки, Laramie, WY, 82071 USA
Д-р Sreejayan Nair, Център за сърдечно-съдови изследвания и алтернативна медицина, Фармацевтично училище, Колеж по здравни науки, Университет в Уайоминг, Ларами, WY 82071, САЩ. Тел .: (307) 766 6138; факс: (307) 766 2953; електронна поща: [email protected]
Отдел по фармацевтични науки и Център за сърдечно-съдови изследвания и алтернативна медицина, Училище по фармация, Колеж по здравни науки, Laramie, WY, 82071 USA
Медицинско образование на WWAMI, Колеж по здравни науки, Университет на Уайоминг, Laramie, WY, 82071 САЩ
Департамент по математика, Университет Индиана, Пенсилвания, Индиана, Пенсилвания, 15705 САЩ
Медицински отдел, Бригам и женска болница, Харвардско медицинско училище, Бостън, Масачузетс, 02115 САЩ
Отдел по фармацевтични науки и Център за сърдечно-съдови изследвания и алтернативна медицина, Фармацевтично училище, Колеж по здравни науки, Laramie, WY, 82071 САЩ
Отдел по фармацевтични науки и Център за сърдечно-съдови изследвания и алтернативна медицина, Училище по фармация, Колеж по здравни науки, Laramie, WY, 82071 USA
Д-р Sreejayan Nair, Център за сърдечно-съдови изследвания и алтернативна медицина, Фармацевтично училище, Колеж по здравни науки, Университет в Уайоминг, Ларами, WY 82071, САЩ. Тел .: (307) 766 6138; факс: (307) 766 2953; електронна поща: [email protected]
Обобщение
Въведение
Сърдечно-съдовите заболявания са водещата причина за смъртност в напредналия свят, а възрастта е важен фактор, определящ сърдечната функция. Заболеваемостта и смъртността, свързани със сърдечно-съдови заболявания, са значително по-високи при възрастните хора, отколкото при младите поколения. Сърдечното стареене е сложен патофизиологичен процес, придружен от редица биологични събития, включително сърдечно ремоделиране и дисфункция (Lakatta, 1999; Boengler и др., 2009). Свързани със стареенето сърдечни аномалии се проявяват като диастолна сърдечна дисфункция, сърдечна хипертрофия и фиброза, както и нарушена контрактилна функция (Ян и др., 2005; Танейке и др., 2010; Хуа и др., 2011). Въпреки че точните механизми, допринасящи за сърдечното стареене, далеч не са ясни, бяха предложени няколко постулата. Те включват увреждане на митохондриите, предизвикано от стареене, натрупване на реактивни кислородни форми, нарушения във вътреклетъчната хомеостаза на Ca 2+ и нарушено разединяване на възбуждането и свиването (Ян и др., 2005, 2006). Последните проучвания предполагат важна роля както на каспаза-зависимата, така и на каспаза-независимата апоптоза в сърдечното стареене (Chiong и др., 2011).
Резултати
Нокаутът с катепсин К намалява телесното тегло, сърдечното тегло и увеличаването на теглото на черния дроб при стари мишки
Както е показано в таблица 1, телесното тегло, теглото на сърцето и теглото на черния дроб се увеличават при старите мишки от див тип (WT) в сравнение с младите мишки и тези увеличения се отслабват при нокаутиращите мишки с катепсин К.
| Телесно тегло (g) | 23,55 ± 0,68 | 27,1 ± 1,27а а P | 24,39 ± 0,79 | 25,96 ± 0,57 |
| Сърдечно тегло (g) | 0,125 ± 0,007 | 0,182 ± 0,006а а P | 0,134 ± 0,008 | 0,158 ± 0,006b б P -/- ‐Млада група. , ° С ° С P |
| Тегло на черния дроб (g) | 1,359 ± 0,051 | 1.602 ± 0.037a а P | 1,557 ± 0,084 | 1.409 ± 0.080 |
| Тегло на бъбреците (g) | 0,279 ± 0,011 | 0,438 ± 0,020а а P | 0,381 ± 0,026 | 0,423 ± 0,027 |
| Тегло на далака (g) | 0,088 ± 0,006 | 0,11 ± 0,009а а P | 0,099 ± 0,005 | 0,096 ± 0,015 |
| HW/BW (mg g -1) | 5.440 ± 0.146 | 6.741 ± 0.302а а P | 5,512 ± 0,292 | 6,093 ± 0,211 |
| LW/BW (mg g -1) | 59,211 ± 0,656 | 59.378 ± 0.347 | 63,996 ± 3,340 | 54,646 ± 3,619 |
- Стойностите са средни ± SEM, н = 6–10 мишки на група.
- аPбP-/- ‐Млада група.
- ° СP
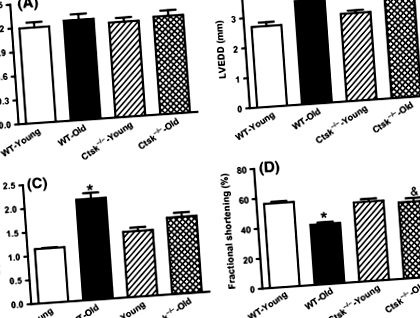
Нокаутът с катепсин К облекчава свързаните със стареенето нарушения на сърдечната дейност
Резултатите от ехокардиографски анализи показват нарушена сърдечна дейност при WT-стари мишки, което се доказва от увеличаване на крайно-диастоличното измерение на лявата камера (LVEDD), крайно-систолично измерение на лявата камера (LVESD), както и намалено фракционно скъсяване (FS) (Фиг. . 1B – D). Нокаутът с катепсин К примирява промените в LVEDD и FS, без да променя значително LVESD (фиг. 1B – D).
Нокаутът с катепсин К намалява свързаната със стареенето единична контрактилна дисфункция на кардиомиоцитите
За по-нататъшно изследване на ефекта на катепсин К нокаут върху свързаната със стареенето миокардна дисфункция беше оценена контрактилната функция на единични кардиомиоцити. Въпреки че дължината на клетката в покой не е била засегната нито от възрастта, нито от генотипа (фиг. 2А), стареенето е довело до значително увреждане на пиковото скъсяване (PS), максималната скорост на скъсяване/удължаване (± dL/dt), съкращаването от време до пик ( TPS), както и време за удължаване (TR90). Генетичната аблация на генетичния катепсин К предотврати свързаните с възрастта промени на PS и TR90 (фиг. 2B, F), без да се засягат ± dL/dt и TPS (фиг. 2C-E).
Нокаутът с катепсин К подобрява свързаното със стареенето вътреклетъчно неправилно боравене с Ca 2+ в единични кардиомиоцити
Тъй като вътреклетъчният Ca 2+ е ключовият йон, отговорен за съкратителните функции на сърцето, ние се опитахме да оценим работата на кардиомиоцитите Ca 2+ в отговор на стареенето. Както се очаква, стареенето е свързано с нарушена вътреклетъчна обработка на Ca 2+ от кардиомиоцитите (подкрепяща информация, фиг. S1). Това се доказва от повишаване на нивата на Ca 2+ в покой, както и увеличаване на скоростта на вътреклетъчно разпадане на Ca 2+. Интересното е, че тези промени се наблюдават и при нокаутиращите мишки на възраст с катепсин К (фиг. S1A, C и D). За разлика от това, нокаутът с катепсин К примирява свързаното с възрастта намаляване на вътреклетъчното освобождаване на Са 2+ (фиг. S1B).
Нокаутът с катепсин К инхибира свързаната с възрастта хипертрофия на кардиомиоцитите, без да променя фиброзата
В съответствие с повишеното сърдечно тегло, размерът на кардиомиоцитите от WT мишките се увеличава в отговор на стареенето, както се вижда от оцветяването на пшеничен зародиш с аглутинин (WGA) (Фиг. 3А, В). Интересното е, че това предизвикано от стареене увеличаване на размера на кардиомиоцитите не се наблюдава при нокаутиращите мишки с катепсин К (Фиг. 3А, В). Тъй като сърдечното стареене обикновено е придружено с повишена фиброза, следващата оценка на степента на фиброза в сърцата на тези мишки. Както се очакваше, площта на фиброзата беше значително повишена в сърцето от WT-стари мишки в сравнение с тези на WT-млади мишки. Делецията на катепсин К обаче не успя да инхибира свързаното с възрастта увеличение на сърдечната фиброза (Фиг. 3С, D).
Нокаутът с катепсин К отслабва свързаното с възрастта сърдечно натрупване на липофусцин и експресията на забавители на клетъчния цикъл
След това направихме оценка на натрупването на липофусцинови пигменти в сърцето, знакът за „стареене“ на стареенето. Нашите резултати показват силно регулиране на сърдечния липофусцин при WT-стари мишки, което е потиснато от нокаут с катепсин К (Фиг. 4А). Освен това, в съответствие с предишни наблюдения (Krishnamurthy и др., 2004; Найто и др., 2010), нивата на експресия на протеините на успокоител на клетъчния цикъл p16 и p21 бяха повишени в сърцата на WT-старите мишки, което беше отслабено от нокаут на катепсин К (фиг. 4В и фиг. S2A, B).
Нокаутът с катепсин К не променя свързания с възрастта оксидативен стрес в сърцето: повишено ниво на оксидация в сърцето на възраст
Нивата на сърдечния оксидативен стрес бяха определени с помощта на анализи за глутатион (GSH)/глутатион дисулфид (GSSG). Както е показано на фиг. 4В, свързаното с възрастта намаление на нивата на GSH е непроменено чрез нокдаун на катепсин К, което предполага, че нокаутът на катепсин К може да не отслаби оксидативния стрес.
Дефицитът на катепсин К инхибира свързаното с възрастта основно фосфорилиране на Akt и IGF-1
Тъй като се съобщава, че инсулиновият сигнален път участва в процеса на стареене, следващата оценка на сърдечните нива на фосфорилирания Akt и IGF ‐ 1, ключовите медиатори на инсулиновия сигнален път. Забелязахме повишаване на фосфорилирането на Akt и IGF ‐ 1 в отговор на стареенето, което беше отслабено при нокаутиращите мишки с катепсин К (фиг. 4D).
Дефицитът на катепсин К притъпява зависимата от каспаза и независима от каспаза апоптоза в отговор на сърдечното стареене
Дискусия
Колективно, нашите проучвания предполагат, че нокаутирането на катепсин К при мишки и siRNA-медиирано заглушаване на катепсин К в кардиомиоцитите предотвратява свързано със стареенето увреждане на клетъчната геометрия и функция. Нашите данни показват, че защитната роля на дефицита на катепсин К в сърдечното стареене се дължи на дезактивирането на свързаната със стареенето сърдечна апоптоза, включително зависима от каспаза и независима от каспаза апоптоза, и по този начин предпазва от сърдечна дисфункция (Фиг. S5). Въпреки че точните молекулярни механизми, чрез които делецията на катепсин К предпазва сърцата от стареене, се нуждаят от допълнително проучване, нашите резултати предоставят потвърждение за ролята на катепсин К в свързаните с възрастта сърдечни аномалии. Тези наблюдения са особено важни предвид факта, че инхибиторите на катепсин К, които в момента са в клинично изпитване за остеопороза, могат да имат двойни ползи от лечението на сърдечно-съдови заболявания. Това е особено важен резултат предвид бързо нарастващото ни възрастно население.
Експериментална процедура
Експериментални животни
Експерименталните протоколи са одобрени от комитета за употреба и грижи за животните към Университета на Уайоминг. 6-месечни (обозначени като „млади“) и 24-месечни (обозначени като „стари“) мишки с глобален нокаут Cathepsin K (Ctsk -/- ) и WT контролни мишки (C57BL/6J) бяха използвани в това проучване. Всички мишки бяха настанени в контролирана от климата среда (22,8 ± 2,0 ° C, влажност 45-50%) с цикъл 12/12 ‐ светлина/тъмнина със свободен достъп до храна и вода.
Ехокардиографска оценка
Изолация и механика на кардиомиоцитите
Кардиомиоцитите на мишките бяха изолирани с помощта на ензимно храносмилане на либераза; механичните свойства бяха оценени с помощта на система с мек ръб IonOptix ™ (IonOptix, Milton, MA, USA), както е описано по-рано (Hua и др., 2011). Клетъчното съкращаване и удължаване се оценяват при използване на PS, TPS, TR90 и ± dL/dt.
Вътреклетъчни преходни процеси на Ca 2+
Кохорта от миоцити беше заредена с фура-2/AM (0.5 μ m) в продължение на 15 минути и интензивността на флуоресценцията беше записана със система за фотоумножител с двойно възбуждане на флуоресценция (IonOptix). Клетките бяха изложени на светлина, излъчвана от 75W лампа, като същевременно бяха стимулирани да се свиват с честота от 0,5 Hz. Открити са флуоресцентни емисии между 480 и 520 nm; качествената промяна в интензивността на флуоресценцията на фура-2 (FFI) беше изведена от съотношението FFI при двете дължини на вълната (360/380). Скоростта на разпадане на флуоресценцията е изчислена като индикатор за вътреклетъчно изчистване на Ca 2+ (Hua и др., 2011).
Хистопатологичен анализ
Вентрикуларните тъкани се оцветяват с FITC-конюгиран WGA (Sigma, Сейнт Луис, Мисури, САЩ) и площта на напречното сечение на кардиомиоцитите се определя количествено от 100 произволно избрани кардиомиоцити. Миокардната фиброзна област беше оценена с трихромно оцветяване на Masson (Sigma).
Тунел оцветяване
Апоптотичните кардиомиоцити бяха открити с помощта на In Situ Kit за откриване на смърт (Roche, Branchburg, NJ, USA), с миоцити, оцветени от антитяло Desmin (Cell Signaling Technology, Beverly, MA, USA) и наблюдавани с помощта на конфокален микроскоп Zeiss. TUNEL-положителните клетки се определят количествено чрез броене на 1000 случайни кардиомиоцити.
Определяне на редуциран и окислен глутатион (GSH и GSSG)
Съдържанието на глутатион в сърцето беше измерено, както е описано по-горе (Guo и др., 2009). Пробите от тъкани се обработват с ултразвук в пикринова киселина и се центрофугират при 13 500 ж за 20 минути. След това супернатантата беше разделена на две аликвотни части. Единият е използван за общ GSH анализ, а другият за GSSG анализ. 100 μL супернатантни фракции с 2 μL винилпиридин се инкубират при стайна температура за 1 h, за да се почисти GSH за определяне на GSSG. GSSG се изважда от общия глутатион за оценка на нивата на GSH. GSH се определя от механизма за рециклиране на DTNB-глутатион редуктаза.
Western blot анализ
Протеинът се екстрахира с помощта на RIPA лизисен буфер и Western blot срещу антитела за р16, р21 (Proteintech Group, Чикаго, IL, САЩ), цитохром ° С, Bax, Bcl-2, разцепен PARP, AIF, COXIV (използван като контрола за зареждане на митохондриални протеини) и GAPDH (контрол на зареждането, технология за клетъчна сигнализация). Сигналът е открит с помощта на Bio-Rad калибриран денситометър (Херкулес, Калифорния, САЩ).
Анализ на липофусцин
Замразените сърдечни тъкани се хомогенизират в хлороформ – метанол (1:20, w: v). Богатият на хлороформ слой се смесва с метанол след 15-минутно центрофугиране при 15 000 ж. Флуоресценцията в пробата беше измерена при дължина на вълната на възбуждане 350 nm и дължина на вълната на излъчване 485 nm с помощта на спектрофлуорометър (Molecular Devices, SpectraMAX Gemini XS, CA, USA) (Shinmura и др., 2011). Данните са изразени като интензивност на флуоресценция на 100 mg тъкан.
Клетъчна култура и заглушаване на РНК
H9c2 миобластите се култивират в DEME среда и се отглеждат до 80% сливане. Клетките се третират с доксорубицин (0,1 μ m, 48 h), за да се предизвика преждевременно стареене (Spallarossa и др., 2009). Недостигът на катепсин К белтък беше постигнат чрез техника за заглушаване на РНК. Накратко, малки интерфериращи РНК срещу катепсин К или контролна нецелева siRNA бяха трансфектирани с помощта на трансформационен реагент DharmaFECT ® (GE Healthcare, Lafayette, CO, USA) съгласно инструкциите на производителя.
Имунооцветяване за AIF в клетки H9c2
Използвано е двойно оцветяване за AIF и DAPI, за да се посочи местоположението на AIF. Накратко, клетките бяха фиксирани в 4% параформалдехид за 15 минути, последвано от проникване с 0,2% Triton X-100 за 15 минути. След това клетките бяха блокирани в 5% BSA за 30 минути преди инкубация с антитяло срещу AIF при 4 ° C за една нощ, последвано от инкубация в анти-заешко Alexa Fluor ® 568 антитяло (Life Technologies, Grand Island, NY, USA) при 37 ° С за 60 минути. Клетките бяха оцветени от DAPI и разгледани под конфокален микроскоп Zeiss.
Статистически анализ
Данните са представени като средна стойност ± SEM (SEM = стандартна грешка на средната стойност). Статистическите сравнения бяха извършени с помощта на дисперсионен анализ (anova), последван от Tukey post hoc множество тестове за сравнение с помощта на софтуера sigmaplot (Jandel Scientific, Сан Рафаел, Калифорния, САЩ). Където и да е посочено, бяха извършени тестове за пермутация с помощта на пакета lmPerm в r статистическия софтуер (The R Foundation for Statistical Computing, Виена, Австрия), за да се потвърди статистическата значимост. Нулевата хипотеза беше отхвърлена, когато P
Информация за финансиране
Този проект беше подкрепен отчасти от безвъзмездни средства от Националния център за изследователски ресурси (P20RR016474) и Националния институт по общи медицински науки (P20GM103432).
Конфликт на интереси
Авторите нямат друг конфликт на интереси, който да декларират.
Принос на автора
YH - проектира експериментите, проведе изследването и подготви ръкописа; GPS - прегледа ръкописа и допринесе за дискусията; TJR - помогна със статистиката и с прегледа на ръкописа; YC - подпомага се със статистическата програма; JR - прегледа ръкописа, допринесе за дискусията, подпомогна ехокардиография и измервания на калций; SN - концептуализира проучването, допринесе за дискусията и подготви ръкописа.
Фиг. S1 Вътреклетъчни преходни процеси на Ca2 + в кардиомиоцитите при млад или стар див тип (WT) и катепсин К нокаут (Ctsk -/-) мишки.
Фиг. S2 Ефект на нокаут на катепсин К върху инхибитори на зависима от циклин киназа при млади срещу стари мишки.
Фиг. S3 Ефект на нокаут на катепсин К върху апоптотични маркери при млади срещу стари мишки.
Фиг. S4 Ефект на заглушаването на катепсин К върху предизвиканото от доксорубицин (DOX) преждевременно стареене в култивирани клетки H9C2.
Фиг. S5 Схема, представяща ролята на катепсин К при индуцирана от възрастта сърдечна дисфункция.
Моля, обърнете внимание: Издателят не носи отговорност за съдържанието или функционалността на която и да е поддържаща информация, предоставена от авторите. Всички заявки (различни от липсващо съдържание) трябва да бъдат насочени към съответния автор на статията.
- Ефекти от ранното отслабване на ръкавите при гастректомия върху индуцирана от диетата сърдечна дисфункция в
- Ефект от хирургично индуцирана загуба на тегло върху биомаркери на ендотелната дисфункция систематично
- Липолиза на мастните клетки и бъдещо наддаване на тегло
- ECOWAY ENERGY носи иновативни инфрачервени отоплителни системи за различни приложения 2 октомври 2015 г. -
- Ефект на метформин върху антипсихотично-индуцирана метаболитна дисфункция Потенциалната роля на мозъка на червата