Резюме
1. Въведение
Въпреки че ритмичните трептения в живота са отдавна известни, молекулните парчета, които съставят толкова точен биологичен часовник, се разкриват бавно. Циркадните ритми съществуват практически във всички организми, интегрирани са в нашата физиология и по този начин играят важни роли в ритъма на нашия живот. Следователно циркадната система е тясно свързана с човешкото здраве. Изследвания на популации върху животни и хора показват, че циркадните смущения са свързани със заболявания като метаболитен синдром (MetS) [1], захарен диабет тип 2 (T2DM), затлъстяване [2], сърдечно-съдови заболявания (CVD) [3] и рак [4]. Други проучвания показват връзка между хронобиологията и успеха в програмите за отслабване, което предполага, че хронобиологията трябва да се вземе предвид в хранителната практика [5,6,7,8].
Връзката между циркадния ритъм и клетъчната физиология е широко проучена през последното десетилетие и много съответни проучвания хвърлят светлина върху регулацията, както и върху причините и последиците от неправилното регулиране на циркадната система. Циркадният път е описан и в момента се изяснява, тъй като се намират нови осцилиращи гени и нови циркадни посттранскрипционни регулатори. Много гени и метаболити осцилират след циркаден цикъл и се регулират по циркаден начин [9,10,11].
Както споменахме, циркадните ритми са свързани с метаболитни заболявания като T2DM, затлъстяване и MetS, всички те рискови фактори за ССЗ, водеща причина за смъртност в световен мащаб. По този начин, хронобиологичната характеристика на тези заболявания е много важна за определяне на хронобиологичен подход за тяхното лечение. Генетичната и епигенетичната характеристика на хронобиологичната система е особено интересна, като се има предвид, че тя се регулира от транскрипционна/транслационна обратна връзка [12]. Някои варианти са описани в гени, свързани с циркадиан, които са свързани с риск от заболяване. Освен това за някои от тези варианти са описани някои взаимодействия между гени и диети. Освен това няколко микроРНК модулират циркадната система и някои от тях също се модулират чрез диета.
В този преглед обобщаваме състоянието на връзката между диетата и хронобиологията от гледна точка на хранителната геномика и обсъждаме потенциала на хронотерапията в персонализираното хранене.
2. Цикълът на транскрипционната/транслационната обратна връзка, който управлява циркадните ритми
Циркадните ритми се управляват от централен часовник, разположен в супраквиазматичното ядро (SCN) на хипоталамуса [3,14,15,16,17]. Този централен пейсмейкър получава входове от околната среда, които служат като стимули за синхронизиране на ритмите му с външния свят. SCN използва тези Zeitgebers за синхронизиране на периферните часовници в други тъкани като черен дроб, бели дробове, сърце, стомах или черва [18]. Сред тези сигнали светлината е най-мощната. Светлината поразява фоторецепторите на ретината и сигналът преминава през ретинохипоталамичния тракт към SCN. Температурата, гладуването/храненето и почивката/активността са други Zeitgebers [14].
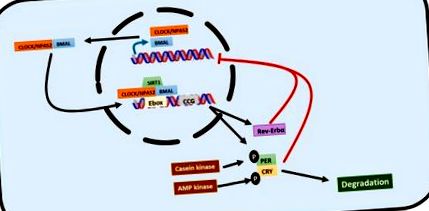
Циркадните ритми се регулират от транскрипционни/транслационни вериги за обратна връзка, в които така наречените тактови гени играят ключова роля [3,16,17] (Фигура 1). Циркадните двигателни цикли на изход kaput (CLOCK) или неговият алтернативен невронален PAS домейн протеин 2 (NPAS2) и мозъчен и мускулен ARNT-подобен протеин 1 (BMAL1), са основните тактови гени, които задействат сигналния път. CLOCK и BMAL1 се димеризират в цитозола и се преместват в ядрото, където се свързват с последователностите на E-box в промоторните области на няколко тактови гена, стимулиращи тяхната експресия. По този начин, периодични гени (PER1, PER2 и PER3), криптохромни гени (CRY1 и CRY2), обратен еритробластозен вирус α ген (REV-ERBα), свързан с ретиноиди сирачен рецептор α ген (RORα) и други контролирани от часовника гени (CCG) се изразяват. CLOCK и RORα също индуцират експресия на BMAL1. Обратно, има инхибиране на обратната връзка: гените на периода и криптохромите се димеризират в цитозола, транслокират се в ядрото и инхибират експресията на BMAL1. REV-ERBα също участва в инхибирането на BMAL1 [3,16,17].
Графично представяне на транскрипционната/транслационната обратна връзка, която управлява циркадния ритъм. Хетеродимерът CLOCK/BMAL1 представлява първата линия на действие. Той се свързва с E-кутии в промотора на целеви гени, за да ги активира. Сред неговите целеви гени има гени за криптохром и период, които образуват хетеродимер, който регулира отрицателно CLOCK/BMAL1 действието в отрицателна обратна връзка. REV-ERBα също е насочен към CLOCK/BMAL1 и също така регулира отрицателно своето действие. Тази мрежа също се регулира посттранскрипционно чрез медиирано от фосфорилирането разграждане на криптохромни и периодни гени.
Часовите гени също се регулират след транскрипция. Казеин киназата фосфорилира PER, насочвайки я към разграждане чрез комплекс убиквитин [19,20]. CRY се фосфорилира от AMP киназа и се разгражда от протеазома 26s [19]. Sirtuin 1 (SIRT1) е хистонова деацетилаза, която взаимодейства с CLOCK и BMAL1, когато те се свързват с промоторната последователност на контролирани от часовника гени, позволявайки ритмично изразяване на протеини в черния дроб и синхронизиране на клетъчния метаболизъм с циркадни ритми [20]. CLOCK също е хистонова ацетилтрансфераза, която ацетилира BMAL1 и HDAC, хистонова деацетилаза, която, заедно с REV-ERBα, регулира циркадния липиден метаболизъм [19].
3. Периферни часовници, време на хранене и метаболитни последици от хронодисрупцията
Специфични хранителни вещества също могат да променят експресията на контролирани от часовника гени. Глюкозата може да регулира BMAL1 и експресията на периода [39], а мишките, хранени с диета с високо съдържание на мазнини, показват променена генна експресия на липиден метаболизъм [13]. Изследване, проведено от Eckel-Mahn et al. показа, че повечето метаболити на черния дроб трептят след циркаден ритъм и че такова трептене се регулира от часовника и цикли на хранене/гладно и допринася за поддържане на чернодробната хомеостаза [9].
4. Варианти на гени и взаимодействия между гените и диетите в свързани с циркадиан гени, свързани с болестта
Някои генни варианти могат да предразположат индивидите към различни заболявания. Такъв е случаят с гена FTO (свързана със затлъстяването на мазнините) и неговата асоциация със затлъстяването и свързаните с него черти [41,42,43] или гена TCF7L2 и неговата връзка с T2DM [44,45,46]. Освен това, някои от добре известните генни варианти, свързани с болестта, взаимодействат с диетични и диетични съединения, за да модулират такова предразположение [47,48]. Други генни варианти модулират индивидуалния отговор на програма за отслабване по отношение на намаляване на теглото, индекса на телесна маса (ИТМ) или обиколката на талията [49,50]. Като се има предвид ролята, която хронобиологията играе в човешкото здраве и като се има предвид, че циркадната система е съставена от сложна генна мрежа, която контролира осцилиращата генна експресия, се предполага, че свързаните с циркадиан генни варианти могат да бъдат свързани с различни заболявания. Поради тази причина проучванията на хранителната геномия наскоро се фокусираха върху взаимодействията между свързаните с циркадиан гени и хранителни вещества, за да модулират риска от заболяване и индивидуалната променливост в програмите за отслабване.
4.1. Поуки от животински модели на генетично хронично разстройство
Per1 мутантни мишки показват по-висок прием на храна, но по-ниско телесно тегло и повишен метаболизъм на глюкозата [58]. Обратно, Per2 мутантните мишки са със затлъстяване, въпреки че приемът на храна не е по-висок от този при мишки от див тип [59]. Тези мутантни мишки имат засегнат глюкокортикоиден ритъм и дневен контрол на апетита. Ограничаването на съня предизвиква транскрипционно препрограмиране на бяла мастна тъкан, което води до повишена липогенеза, секреция на лептин и прием на храна, всички те отличителни белези на затлъстяването и свързаната с тях лептинова резистентност. Въпреки това, двойните мутанти Per1/Per2 изглежда са защитени от ефектите на ограничаване на съня [60].
Rev-erbα нокаутиращите мишки показват фазово изместване в експресията на гени, участващи в липидния метаболизъм, което води до нарушена регулация на метаболизма на чернодробния холестерол и жлъчните киселини [61]. Тези нокаутиращи мишки са нарушили медиирания от Srebp метаболизъм на холестерола поради нарушено инхибиране на Insig2 от Rev-erbα. И обратно, мишките с дефицит на Cry1 показаха устойчивост на индуцирано от диета затлъстяване с високо съдържание на мазнини, въпреки сходния прием на калории, отколкото мишки от див тип, хранени със същата диета [62].
4.2. Вариантите на гените в Circadian-RelatedG са свързани с метаболитни нарушения и модулират индивидуалния отговор на диетата: Изследвания на човешкото население
Прилагането на хранителна геномика към хронобиологични проучвания ни учи как генните варианти в свързаните с циркадиан гени могат да увеличат риска от метаболитни нарушения и свързани заболявания като затлъстяване, T2DM или ССЗ. Свързаните с циркадиан генни варианти също се свързват с признаци на ССЗ като хипертония (Таблица 1). Dashti и сътр. анализираха връзката на 5004 единични нуклеотидни полиморфизми (SNP) в 18 гена, свързани с циркадиан, с кръвно налягане и установиха, че въпреки че тези SNP не допринасят за индивидуалната дисперсия в диастолното кръвно налягане, те колективно обясняват 7,1% от дисперсията в систолната кръв налягане в популациите на генетиката на лекарства за понижаване на липидите и диетичната мрежа (GOLDN) и популациите от Бостън в Пуерто Рика (63). Освен това, някои от съобщените връзки между варианти на циркадни гени и метаболитни нарушения могат да бъдат модулирани чрез диета.
маса 1
Резюме на варианти на свързани с циркадиан гени, свързани със затлъстяването.
4.2.1. Варианти в гена CLOCK
4.2.2. Варианти в други гени, свързани с циркадиан
Полиморфизмите в гените на периода са свързани с циркадни и поведенчески промени. Тези промени могат да играят роля в наблюдаваната връзка между често срещаните варианти на гена PER1 и екстремното затлъстяване [83] и между rs2304672 и rs4663302 SNP в PER2 и коремното затлъстяване [84,85] (Таблица 1). Освен това, Kelly et al. показа, че алелът rs7602358 G близо до PER2 е отрицателно свързан с T2DM, докато алелът BMAL1 rs11022775 T е свързан с повишен риск от заболяване в кохортата на пенджаби. Нито една от тези асоциации обаче не е репликирана в набори от данни SAT2D или DIAGRAM [82]. rs6486121 и rs7950226 SNP в BMAL1 също са свързани с хипертония и T2DM, съответно при 1304 индивида от 424 британски семейства T2D от колекцията от проучвания Diabetes in Families (DIF). Тези асоциации обаче не са били значими след корекция за многократно тестване [86]. rs6486121, rs3789327 и rs969485 CCA хаплотиповете бяха значително свързани с хипертония [86] (Таблица 1).
Три скорошни проучвания показват връзка между вариантите на гена REV-ERBα и затлъстяването (Таблица 1). Изследване, проведено от Garaulet et al. през 2014 г. показа, че rs2314339 в REV-ERBα1 е свързан с коремно затлъстяване при две популации от европейски произход (средиземноморска и северноамериканска). Малките алелни носители имат по-ниска обиколка на талията и ИТМ и са по-малко склонни към коремно затлъстяване. Тези асоциации са модулирани от приема на MUFA в средиземноморското население (което показва по-висок прием на MUFA), тъй като по-ниският ИТМ, свързан с малкия алел, е бил значителен само когато приемът на MUFA е бил ≥ 55% от общите мазнини [87]. Ruano et al. показа, че хомозиготните носители на алела A на rs939347 са склонни към затлъстяване. Тази връзка обаче е била значима само при мъжете [88]. И накрая, Goumidi et al. показа, че незначителният алел Т на rs2071427 е свързан с по-висок ИТМ при възрастни и юноши [89].
Тези проучвания разширяват предишните ни знания за вариантите на CLOCK и затлъстяването и T2DM върху други гени, свързани с циркадиан. Въпреки това, в повечето случаи тези разлики не са статистически значими или не успяват да намерят асоциация при некавказки популации. По този начин тези резултати се нуждаят от допълнително валидиране преди включването на тези SNP в персонализирани хранителни стратегии. Освен това етническата принадлежност е важен въпрос, който предполага, че персонализираните хранителни стратегии трябва да вземат предвид етническия произход.
5. Нутримиромика на Циркадната система
МикроРНК са важни модулатори на генната експресия, които контролират много клетъчни и физиологични процеси [104] и някои от тях са свързани с болести като рак [105], T2DM, атеросклероза или дислипидемия [106,107]. Ролята на микроРНК при човешките заболявания е свързана с тяхното участие в много физиологични процеси като метаболизма на холестерола [108], инсулиновата сигнализация [109], възпалението и ендотелната функция [107], а последните доклади показват тяхното влияние в циркадния ритъм [110 ]. МикроРНК също са признати като потенциални биомаркери за възникване и прогресиране на заболяването, тъй като те присъстват в плазмата и други биофлуиди като урина или цереброспинална течност. В кръвния поток микроРНК могат да бъдат свързани с липопротеини, екзозоми и протеинови комплекси, които ги предпазват от разграждане от RNases [111].
5.1. Циркадна експресия на микроРНК
Подобно на хормоните, гените, протеините и метаболитите, много микроРНК осцилират по циркаден начин [8,10] (Фигура 2). Забележителен пример е микроРНК клъстерът, съставен от miR-96/miR-182/miR-183, който в миши модел показва дневни вариации и е замесен в производството на мелатонин в епифизната жлеза [112]. В допълнение към този ефект, регулирането на този клъстер е свързано с хепатоцелуларен карцином и рак на гърдата [113,114]. Освен това Kinoshita et al. показа значението на ритмичните трептения на miR-96-5p при регулирането на нивата на глутатион чрез възбуждащ аминокиселинен носител 1 (EAAC1), които имат защитна роля в мозъка [115].
- Мека; Chewy Oatmeal Raisin Cookies University University Health Care System
- Детска система за управление на теглото Nemours Детска здравна система
- Най-добрите пробиотични храни за вашето здраве на червата ВРЕМЕ
- Пушенето Здраве Пушенето ви помага да отслабнете
- Решете да успеете 9 принципа, преподавани в медицинската здравна система за отслабване на ледников хребет