Франсоа Мутон-Лигър
1 Национален институт на Ла Сант и де Ла Речерш Медикал, U1127, Париж, Франция
2 Национален център за научни изследвания, UMR 7225, Париж, Франция
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Париж, Франция
4 Institut du Cerveau et de la Moelle épinière, ICM, Париж, Франция
Максим Джакупи
1 Национален институт на Ла Сант и де Ла Речерш Медикал, U1127, Париж, Франция
2 Национален център за научни изследвания, UMR 7225, Париж, Франция
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Париж, Франция
4 Institut du Cerveau et de la Moelle épinière, ICM, Париж, Франция
Жан-Кристоф Корвол
1 Национален институт на Ла Сант и де Ла Речерш Медикал, U1127, Париж, Франция
2 Национален център за научни изследвания, UMR 7225, Париж, Франция
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Париж, Франция
4 Institut du Cerveau et de la Moelle épinière, ICM, Париж, Франция
5 Катедра по неврология, Национален институт на Санта и де Механика за научни изследвания, Assistance-Publique Hôpitaux de Paris, CIC-1422, Hôpital Pitié-Salpêtrière, Париж, Франция
Олга Корти
1 Национален институт на Ла Сант и де Ла Речерш Медикал, U1127, Париж, Франция
2 Национален център за научни изследвания, UMR 7225, Париж, Франция
3 Sorbonne Universités, UPMC Université Paris 06, UMR S 1127, Париж, Франция
4 Institut du Cerveau et de la Moelle épinière, ICM, Париж, Франция
Резюме
Въведение
Болестта на Паркинсон (PD) е едно от най-честите невродегенеративни заболявания, като повече от шест милиона души са засегнати по целия свят. Неговите основни двигателни симптоми (брадикинезия, мускулна ригидност и тремор в покой) са причинени от преференциалната, прогресивна дегенерация на допаминергичните (DA) неврони на SN pars compacta и стават явни, когато се загубят повече от 50% от тези неврони (Fearnley и Lees, 1991; Lang and Lozano, 1998; Damier et al., 1999). Наличието на характерни тела за включване, обогатени със синаптичния протеин α-синуклеин в невроналните процеси и клетъчните тела, невритите на Lewy и телата на Lewy, са втори белег на заболяването. Въпреки че често се пренебрегва, увреждането се простира отвъд SN до други мозъчни области, включително дорзалното моторно ядро IX/X, системата на raphe, locus coeruleus, таламуса и амигдалата, а в най-тежките случаи и неокортикалните области (Lang и Lozano, 1998; Braak and Braak, 2000; Braak et al., 2004).
Защо тези неврони умират при PD остава загадка. Една забележителна черта на уязвимите неврони е техният дълъг, извит и често разклоняващ се немиелинизиран аксон (Braak and Del Tredici, 2004). Изчислено е, че човешките DA неврони от SN pars compacta имат аксони със средна дължина 4,5 m, с изключително сложна беседка, образуваща между 1 и 2,4 милиона синапса в стриатума (Bolam and Pissadaki, 2012). Данните от изчислителното моделиране, основано на биология, показват, че такава голяма аксонална архитектура поставя невроните под изключително биоенергийно търсене за разпространение на потенциали за действие, възстановяване на мембранния потенциал и синаптично предаване (Pissadaki и Bolam, 2013). Тези уникални характеристики правят тези неврони силно податливи на смущения в снабдяването с енергия. Поради това не е изненадващо, че митохондриалната дисхомеостаза се очертава като един от водещите механизми, за които се предполага, че играят роля в патогенезата на PD.
От токсини и митохондриален комплекс I дисфункция до гени и митофагия
Дисфункция на митофагията при болестта на Паркинсон: къде стоим?
Отвъд митофагията: PINK1 и Parkin регулират други механизми, свързани с качеството на митохондриите
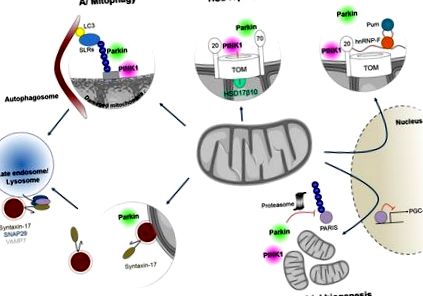
Контролът на качеството на митохондриите се отнася до поредица от координирани механизми, еволюирали за запазване на популация от здрави митохондрии в клетката, от които митофагията представлява екстремен аспект (Rugarli and Langer, 2012; Shutt and McBride, 2013). Тези механизми са жизненоважни за невроните, тъй като тяхната промяна причинява невродегенеративни заболявания. Става все по-ясно, че PINK1 и Parkin ги регулират по-широко.
Динамиката на митохондриалната мрежа е тясно свързана с поддържането на митохондриалните дейности. Той е свързан с цикли на сливане и събития на делене, регулирани от факторите на сливане на вътрешната (OPA1) и външната митохондриална мембрана (Mfn1 и Mfn2) и от деленето GTPase Drp1. Сливането на митохондриална мембрана позволява преразпределение на съдържанието на митохондриите и по този начин защита срещу натрупване на увредени компоненти, като мутантни митохондриални нуклеоиди. Той представлява компенсаторен отговор за оцеляване при условия на стрес, осигуряващ оптимално производство на АТФ и предотвратяващ автофагичното отстраняване на митохондриите (Tondera et al., 2009; Gomes et al., 2011; Shutt and McBride, 2013). Тежката митохондриална дисфункция инхибира сливането на митохондриите, което води до фрагментация на митохондриите, дължаща се на непротивопоставено делене и последваща митофагия. Съществуват съществени доказателства, че PINK1 и Parkin регулират митохондриалната динамика чрез различни преки и непреки механизми, включително чрез регулиране на Mfn1/2 и Drp1 (Lutz et al., 2009; Gegg et al., 2010; Tanaka et al., 2010; Ziviani et al., 2010; Guo, 2012; Corti and Brice, 2013; Buhlman et al., 2014; Sun et al., 2015; Pryde et al., 2016).
И накрая, ранните проучвания свързват PINK1 с фосфорилирането на митохондриалния шаперон, свързания с рецептора тумор некротизиращ фактор (TNF) протеин TRAP1 (Pridgeon et al., 2007) и митохондриалната междумембранна серинова протеаза, HtrA2 (Plun-Favreau et al., 2007). Допълнителни проучвания при дрозофила потвърждават генетичното взаимодействие между всеки от тези протеини и PINK1, макар и не винаги с постоянни резултати (Tain et al., 2009; Costa et al., 2013; Zhang et al., 2013). Трябва да се отбележи, че докато убиквитинът и подобният на убиквитин домейн на Parkin са се превърнали в неоспорими фосфорилиращи субстрати на PINK1 въз основа на най-новите открития, подкрепени от структурни проучвания (Caulfield et al., 2015; Dove et al., 2015), значението на други предполагаеми субстрати PINK1 остава да бъдат изяснени.
От просто към сложно: към интегриран анализ на клетъчния отговор на митохондриалния стрес и неговото регулиране от PINK1 и Parkin
И накрая, научихме още един основен урок от проучвания на UPR mt при C. elegans: митохондриалният стрес е тясно свързан с индукцията на гени, кодиращи вродени имунни компоненти, като антимикробни пептиди и лектини от С-тип (Melo и Ruvkun, 2012; Nargund et al., 2012; Pellegrino et al., 2014). Обратно, патогените, които нарушават митохондриалната функция, предизвикват защитен UPR mt отговор. Заедно със силните нововъзникващи връзки между PINK1 и Parkin и регулирането на пътищата за реакция на патогени при C. elegans и бозайници (Mira et al., 2004; Manzanillo et al., 2013; Chopra et al., 2014; Kirienko et al., 2015 ), тези наблюдения налагат подробен анализ на ролята на PINK1/Parkin-зависим контрол на качеството на митохондриите в клетките на имунната система, особено в централната нервна система, където тяхната дисфункция може да допринесе за невродегенерацията.
Регулаторен център на пресечната точка между митохондриите и невровъзпалението
В исторически план PARK2/Parkin първо се свързва с повишена чувствителност към инфекции от микобактерии, като M. leprae и M. tuberculosis (Mira et al., 2004; Manzanillo et al., 2013; Chopra et al., 2014). Паркин модулира отговора на гостоприемника към тези патогени, като насърчава тяхното изчистване чрез медикаментозна аутофагия, убибиквитин (Manzanillo et al., 2013). Експресията на паркин и PINK1 също се стимулира от вируси, като хепатит В вирус (HBV) и хепатит С вирус (HCV) (Kim et al., 2013a, b). HBV и HCV насърчават митохондриалната транслокация на Parkin и Parkin-зависимата митофагия (Kim et al., 2013a, b; Hara et al., 2014; Khan et al., 2016). При HBV инфекция Паркин взаимодейства с протеина на митохондриалния адаптер MAVS, насърчавайки неговата модификация чрез незакрепени линейни полиубиквитинови вериги и задействайки антивирусна сигнална каскада, свързана с производството на интерферон β (Khan et al., 2016). Взети заедно, тези проучвания предполагат, че PINK1 и Parkin модулират податливостта към инфекция, което налага по-нататъшна работа, насочена към оценка доколко този механизъм допринася за риска от PD. Доказателствата, свързващи друг PD ген с интерферонния отговор, LRRK2 (богата на левцин повторна киназа-2), подсилват тази идея (Gardet et al., 2010).
Интересното е, че активирането на инфламазома изисква набиране на NLRP3 към интерфейса ендоплазматичен ретикулум (ER) -митохондрия (Zhou et al., 2011), вероятно чрез протеина на адаптера MAVS (Subramanian et al., 2013), а калцият, получен от ER, може да бъде централен за Активиране на NLRP3 (Lee et al., 2012; Rossol et al., 2012). Наскоро показахме, че дефицитът или дисфункцията на Паркин при нокаутиращи мишки и пациенти с PARK2 PD изостря интерфейса ER-митохондрии, което води до прекомерен трансфер на калций между тези органели (Erpapazoglou and Corti, 2015; Gautier et al., 2016). Това осигурява механизъм, чрез който Паркин може да модулира активността на NLRP3.
Като цяло тези изследвания силно подкрепят ролята на пътя PINK1/Parkin в регулирането на вродения имунитет и възпаление. Един ключов въпрос, който ще трябва да бъде разгледан в бъдеще, е дали дерегулацията на пътя PINK1/Parkin в имунните клетки има вредно въздействие върху DA невроните. Създаването на системи за съвместни култури, интегриращи предварително активирани микроглии от нокаутиращи модели PARK2 или PINK1 с първични ембрионални DA неврони, може да представлява предварителна стъпка към по-глобален анализ на тези взаимодействия в PD.
Добрата митофагия, лошият диабет и връзката им с PD
По-специално, скорошно проучване предполага, че метаболитният синдром, причинен при мишки чрез делеция на гена за чувствителност T2DM TP53INP1 (индуциран от туморен протеин 53 ядрен протеин 1), участващ в супресията на тумора и регулирането на автофагията, се дължи на нарушен ПИНК1/PARKIN митофагия, свързана с оксидативен стрес и хронично възпаление (Seillier et al., 2015). Тази работа засилва връзката между дисфункция на PINK1/Parkin-зависим митохондриален контрол, диабет и PD.
Заключение
Дефектите в контрола на качеството на митохондриите засягат няколко пътища, свързани с болестта на Паркинсон. PINK1/Parkin-зависимият контрол на качеството на митохондриите, включително митофагия, пътят на MDV и митохондриална биогенеза, е от съществено значение за жизнеспособността на клетките. Промените на този процес в няколко клетъчни типа могат да бъдат свързани с 1/микроглиална активация, водеща до транскрипционна индукция на гени, кодиращи компоненти на NLRP3 инфламазома и IL-1β 2/енергийна недостатъчност в невроните, поради наличието на увредени митохондрии и 3/диабет тип 2 (T2DM) и натрупване на холестерол с липопротеини с ниска плътност (LDL). Активирането на вродената имунна система, метаболизма, дисхомеостазата и енергийните дефекти допринасят за невронната смърт, която е тясно свързана с болестта на Паркинсон.
Авторски приноси
FML и OC са написали ръкописа. MJ и JCC са извършили критична релектура. MJ реализира графичните илюстрации. Всички автори получиха окончателно одобрение на изпратената версия.
Финансиране
Тази работа беше подкрепена от безвъзмездни средства от Института за национално изкуство и медицинско изследване (INSERM), Института за фондация Cerveau et de La Moelle épinière и Agence Nationale pour la Recherche („Investissements d'avenir“, безвъзмездна помощ ANR-10-IAIHU -06), Съвместно предприятие за инициатива за иновативни лекарства съгласно споразумение за отпускане на безвъзмездни средства № 115568, ресурси от което се състоят от финансова вноска от Седмата рамкова програма на Европейския съюз (FP7/2007-2013) и от приноса на дружествата от EFPIA. Фондация от Франция (Grant ID Engt 2016 00066513) и фондация Michael J. Fox (Target Validation Awards Spring 2016 Program, Grant ID 12095).
Изявление за конфликт на интереси
Авторите декларират, че изследването е проведено при липса на каквито и да било търговски или финансови отношения, които биха могли да се тълкуват като потенциален конфликт на интереси.
- Паркинсон; s Болест и диета - Паркинсон; s Новини днес
- Безопасност на лечението с чревния гел с Levodopa-Carbidopa при пациенти с напреднала болест на Паркинсон
- Възприятие за самодвижение при болестта на Паркинсон - Halperin - European Journal of Neuroscience - Wiley
- Паркинсон; s болест - Лечение - NHS
- Борба с отслабването Яденето на круши ви помага да изгаряте мазнини, да се борите със сърдечни заболявания и рак Здраве