Xin Lu 1, Ying Li 1, Huayu Yang 1, Xinting Sang 1, Haitao Zhao 1, Haifeng Xu 1, Shunda Du 1, Yiyao Xu 1, Tianyi Chi 1, Shouxian Zhong 1, Kang Yu 2, Yilei Mao 1
* Xin Lu и Ying Li допринасят еднакво за това проучване.
Резюме
Обективен: Нарастването на индивидуализираната терапия изисква скрининг на хранителен риск се превърна в основна тема за всяко конкретно заболяване, но повечето скрининги бяха за злокачествени заболявания, по-малко за доброкачествени заболявания. Няма доклад за скрининга на пациенти с доброкачествени чернодробни тумори следоперативно. Ние се стремим да оценим стратегиите за хранителна подкрепа след операция за доброкачествени чернодробни тумори чрез скрининг на хранителен риск.
Методи: В това проспективно, рандомизирано, контролирано проучване 95 пациенти, подложени на хепатектомия за доброкачествени тумори, бяха разделени на две групи. Петдесет пациенти в контролната група получиха рутинно разрешително подхранване с хранителни количества (75 kJ/kg/d), а 45 пациенти в експерименталната група получиха по-ниска енергия (42 kJ/kg/d) в съответствие с хирургичната си травма. Рутинни кръвни тестове, чернодробна/бъбречна функция са били наблюдавани преди операцията и в деня 1, 3, 5, 9 след операцията, пациентите са били наблюдавани за времето на плоскост, усложнения, продължителност на хоспитализацията (LOH), разходи, свързани с храненето, и други клинични параметри. Това завършено проучване е регистрирано в Clinicaltrials.gov, номер NCT01292330.
Резултати: Разходите, свързани с храненето (494,0 ± 181,0 срещу 1,514,4 ± 348,4 RMB, P
Подадено на 27 октомври 2012 г. Прието за публикуване на 28 ноември 2012 г.
Въведение
Става все по-популярна практика в клиничното хранене пациентите да получават оценка на хранителния риск преди операцията като насока за предоперативната програма за хранителна подкрепа. Предишните проспективни, рандомизирани проучвания показват, че за пациентите, страдащи от рак, които са имали очевиден хранителен риск (NRS 2002 по-голям от 3 точки), е от полза за пациентите при постоперативно възстановяване и клинични резултати, ако им е била предоставена предоперативна хранителна подкрепа 3-4 дни преди операцията (1). Тези проучвания обаче не разграничават отделни заболявания; от тези проучвания е трудно да се направи заключение за индивидуално лечение. Тези проучвания са постигнали напредък в областта на хирургичното клинично хранене, но резултатите не са без противоречия. Необходими са повече проучвания, за да се получат повече доказателства за насочване на стратегията за подпомагане на храненето.
Предишни проучвания относно оценката на хранителния риск при хирургични пациенти бяха фокусирани върху пациенти с тежко заболяване или рак. Има много малко съобщения за предоперативната оценка на хранителния статус или стратегията за следоперативна хранителна подкрепа за пациенти, страдащи от доброкачествено заболяване, без вероятно хранителен риск (2-4). Не е ясно дали оценката на хранителния риск или предложената по-рано теория за „пермисивно недохранване“ все още е приложима при насочване на следоперативния състав на хранителната течност за пациенти без хранителен риск. Стратегията за следоперативна енергийна подкрепа за тези пациенти остава неясна (5).
Подобрението на чернодробната трансплантация заедно с приемането на прецизна техника за чернодробна резекция значително подобри безопасността на операцията за чернодробна резекция през последните години. Хирургичната травма при многоребрена чернодробна резекция става по-малко сериозна; има по-малко загуба на кръв и по-малко хирургични усложнения (6). Успоредно с тези подобрения е необходимо да се направи оценка на предоперативната оценка на хранителния риск и стратегията за подпомагане на следоперативното хранене за пациентите, страдащи от доброкачествен чернодробен тумор. В това проучване направихме оценка на хранителния риск за пациенти с доброкачествен тумор преди операцията и на случаен принцип разделихме пациентите на две групи за различни следоперативни хранителни подпомагания. Ние записахме и сравнихме различни следоперативни клинични параметри и клиничен резултат и установихме, че за пациенти с доброкачествен чернодробен тумор е икономически изгодно, без да се компрометира клиничният резултат, че те получават по-ниска обща енергия в следоперативната подкрепа.
Материали и методи
Субекти
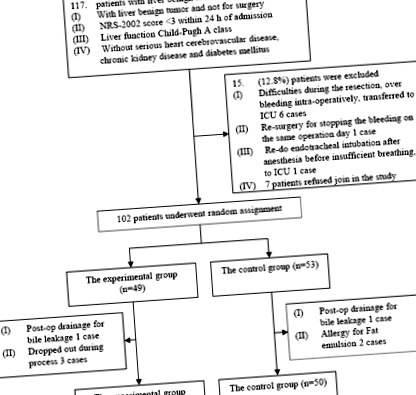
Набрахме общо 95 пациенти, които са били подложени на чернодробна резекция за доброкачествен тумор през периода от март 2010 г. до април 2011 г. в болницата в Пекинския съюз. Протоколът за изследване с хора е одобрен от Етичния комитет на PUMCH и след това е проектиран (ClinicalTrials.gov Identifier: NCT01292330) с изследователски процес, показан на Фигура 1.
Състав на NRS (2002) резултат за скрининг на хранителен риск: (I) увреждане на хранителния статус, включително: ИТМ, скорошни промени в телесното тегло и приема на храна (0 до 3 точки); (II) тежест на заболяването (0 до 3 точки): фрактури на тазобедрената става, остри или хронични усложнения на заболяването, ХОББ, хемодиализа, чернодробна цироза, обикновено болни от рак (ще бъдат назначени като 1), големи коремни операции, инсулт, тежка пневмония, рак на кръвта (2 точки), черепно-мозъчна травма, трансплантация на костен мозък, пациенти на интензивно отделение с APACHE резултат> 10 точки (3 точки); (III) възраст (≥70 години, 1 точка) (7).
Резултат по SIRS: Диагнозата SIRS е поставена, когато съществуват два от следните симптоми: (I) телесната температура е по-висока от 38 ° C или по-ниска от 36 ° C; (II) пулсът е по-голям от 90 удара/мин; (III) честотата на дишане е по-голяма от 20/min или PaCO2 е по-ниска от 32 mmHg; (IV) Броят на левкоцитите е по-голям от 12 × 10 9/L или по-малък от 4 × 10 9/L, или незрелите червени кръвни клетки съставляват повече от 10% от общите червени кръвни клетки. Всеки съществуващ симптом получава оценка 1, а тежестта на SIRS варира от 0-4.
APACHE-II се състои от APS, възраст и CPS.
Методология на изследването
Записаните хирургични пациенти бяха разделени на случаен принцип в две групи: експерименталната група (общо 45 пациенти, където 39 чернодробни хемангиома, 2 FNH, 1 чернодробен аденом, 1 цистаденома, 1 абнормни възли и 1 чернодробна киста) и контролната група (общо 50 пациенти, където 46 чернодробен хемангиом, 2 FNH и 2 ангиомиолипома). Пациентите от експерименталната група получават глюкоза, електролитна добавка; на пациенти с по-тежко тегло, диабет или по-голяма хирургична травма (като полу-хепатектомия) е дадена допълнителна липидна емулсия, общото поглъщане на енергия е 42 kJ/kg/d. Пациентите в контролната група получиха стандартна парентерална хранителна добавка, при която 30-40% от общото усвояване на енергия от 75 kJ/kg/d се състои от енергията от мазнини. Няма разлика в общия обем на iv течност, допълнителен електролит, витамини или минерална добавка между двете групи. Обемът на iv течността постепенно се намалява със същата скорост и за двете групи 3-5 дни след операцията, когато пациентите започнаха да се хранят.
Клинични наблюдения: вземането на кръв се извършва от всеки пациент в деня преди и ден 1, 3, 5 и 9 след операцията за следните тестове, включително рутинни кръвни изследвания, чернодробна и бъбречна функция, кръвосъсирване, хемоглобин, аланин аминотрансфераза, албумин, директен билирубин, индиректен билирубин, ниво на глюкоза в кръвта на гладно и протромбиново време. Пациентите също са наблюдавани по време на плоски връзки, инфекции след операция, включително дихателни пътища, пикочни пътища, рани, интраперитонеални и интравенозни катетърни инфекции. Взети са записи за отслабване на рани или трудно заздравяване. Продължителността на хоспитализацията, общите разходи за стационар и разходите, свързани с храненето, също бяха записани.
Продължителността на хоспитализацията за всеки пациент се определя като деня преди операцията до деня за премахване на конците. За пациента, напускащ болницата преди премахването на шева, денят на изписването се счита за край на болничния престой. Ако пациентът страда от инфекция или усложнения след отстраняване на бода, продължителността на престоя в болницата за лечение се отчита като част от общия болничен престой. Разходите, свързани с храненето, се определят като общите разходи минус разходите за операцията, разходите за специални лекарства и всички разходи, които не са свързани с разходите за парентерално хранене. Разходите за лечение на усложнения ще бъдат включени в общите разходи. Това завършено проучване е регистрирано в Clinicaltrials.gov, номер NCT01292330.
Статистическият анализ
Данните бяха показани като средно ± стандартно отклонение. За групово сравнение беше използван тест на студент t или хи-квадрат тест. Линейна регресия за повтарящ се дисперсионен анализ, използван за сравняване на променливите преди и след операцията между двете различни тенденции (включително WBC, HGB, ALT, ALB, TBIL, DBil, GLU, PT). Беше счетено за статистически значимо, когато P
Резултати
Общи условия
И двете групи пациенти са страдали от доброкачествени чернодробни тумори. Средната възраст на пациентите в експерименталната група и контролната група са сходни (44,2 ± 9,1 срещу 44,6 ± 9,7 години) и няма значителни разлики между групите в съотношението мъже/жени (1/3,5 срещу 1/4,5), среден ИТМ на пациента (24,1 ± 3,5 срещу 22,9 ± 3,3) или среден размер на тумора (8,8 ± 3,8 срещу 10,6 ± 5,0 cm) (Таблица 1). Няма статистически разлики в следните клинични параметри между групите преди операцията, включително: WBC, HGB, ALT, ALB, TBil, DBil, кръвна захар на гладно и PT. По време на това проучване нямаше непоносимост или нежелана реакция сред пациентите; не са включени лекарства или лечения, които биха могли да повлияят на резултатите. Всички пациенти са успели да завършат клиничните проучвания успешно.
Характер на пациентите
Промени в жизнените показатели
Пациентите от двете групи са имали повишаване на ежедневната си висока температура и пулс след операция, преди да се върнат към нормалните нива. Възстановяването на пациентите в експерименталната група е по-бързо от пациентите в контролната група. Разликата на средния пулс между двете групи (82,0 ± 12,5 срещу 87,2 ± 9,9 удара/мин, P 0,05).
Усложнения
В експерименталната група има 2 случая на втечняване на липиди в раната и 1 случай на изтичане на жлъчка и няма инфекциозни усложнения. В контролната група имаше 2 случая на втечняване на липиди в раната и 1 случай на белодробна инфекция. Пациентите с усложнения бяха успешно лекувани с честа смяна на превръзка или антибиотични полкове. Нито един от пациентите от двете групи не е развил интраабдоминални, интравенозни катетърни инфекции и инфекции на пикочните пътища.
Плътното време, продължителността на болничния престой и свързаните с лечението разходи
Средното плоско време (3,6 ± 0,8 срещу 3,6 ± 0,8 дни) и средната продължителност на болничния престой (9,7 ± 1,7 срещу 10,0 ± 2,2 дни) за пациентите в експерименталната и контролната група са сходни, няма статистически разлики.
Средните разходи, свързани с храненето за пациенти в експерименталната група, са значително по-ниски от тези за пациентите в експерименталната група (494,0 ± 181,0 срещу 1,514,4 ± 348,4 RMB, P
Дискусия
Целта на периоперативната хранителна подкрепа е да поддържа функциите на органите, тъканите и имунната система, да насърчава възстановяването на увредения орган или тъкан и да ускорява рехабилитацията на пациентите. Като цяло играе положителна и значима роля. Неподходящата хранителна подкрепа обаче няма да е от полза, а ще навреди на пациентите (13,14). Следователно са необходими повече изследвания, за да се определи подходящото време, методи и хранителни формулировки за периоперативната хранителна подкрепа за подобряване на клиничните резултати (15-17).
За повечето хирургични пациенти, които нямат хранителен риск чрез хранителен скрининг и оценка, трябва да бъде създадена безопасна, разумна програма за лечение, която се състои от прост режим на глюкозна електролитна течност. Не е необходимо да се поддържа хранителна подкрепа, която е разточителна и може да бъде потенциално рискова (18). Long и Chen et al. препоръчва методът ESPEN NRS 2002 за скрининг на хранителен риск да може да се прилага многократно по време на престоя в болница във връзка с тежестта на хирургичната травма, времето на операцията и следоперативните условия. За пациенти без хранителен риск (NRS точки
Заключения
Пациент с доброкачествени чернодробни тумори може да приеме дори по-ниска следоперативна хранителна маса, близка до тази за леки нехирургични състояния и по-ниска от следоперативния пермисивен стандарт за недохранване.
Благодарности
Това изследване беше подкрепено от безвъзмездната финансова помощ на Китайския медицински съвет в Ню Йорк (CMB) 06-837.
Разкриване: Авторите не декларират конфликт на интереси.
- Хирургия на чернодробна резекция, време за възстановяване и усложнения
- Стратегии за здравословно хранене за празник за успех след бариатрична хирургия Консултантски услуги на Siegel
- Пакет за поддръжка на черния дроб - три добавки, които поддържат здравословната функция на черния дроб Торн
- Чернодробни лезии-хемангиоми - HER2 Форуми за поддръжка на групи
- Стратегии за лечение на хипоталамусно затлъстяване Изследвана ендокринология MDedge