Резюме
Надлъжният растеж на децата се улеснява от активността на растежните плочи, хрущялни дискове, разположени близо до краищата на дългите кости. За да се удължат тези кости, растежните плочи трябва непрекъснато да генерират хондроцити. Две неотдавнашни проучвания демонстрират, че в плочата за растеж има стволови клетки и ниша на стволови клетки, които управляват генерирането на хондроцити по време на периода след раждането. Нишата, която позволява на стволовите клетки да се обновяват, се появява по същото време, когато вторичният център за осификация (SOC) узрява в костна епифиза. По този начин механизмът на генериране на хондроцити се различава съществено между неонаталната и постнаталната възраст, т.е. преди и след образуването на минерализираните епифизи. Следователно, в неонаталната възраст костният растеж се основава на консумация на хондро-предшественици, докато постнатално се основава на активността на нишата на стволовите клетки. Тук обсъждаме потенциалните последици от тези наблюдения във връзка с надлъжния растеж, включително ефектите на естрогените, храненето и растежния хормон.
Скелетен растеж и организация на епифизарния хрущял
Децата се увеличават на височина поради активността на хрущялната тъкан, разположена в епифизите (т.е. проксималните и дисталните краища) на дългите кости. По време на развитието епифизите се състоят изцяло от хрущял (фиг. 1а) и са отделени една от друга с костна тъкан в рамките на първичната спонгиоза. Малко след раждането голяма част от хрущялните клетки (хондроцити) в центъра на всяка епифиза се консумират, за да образуват вторичния център за осификация (SOC). SOC се развива в зряла костна тъкан (образуваща костната епифиза), която оставя само тесен диск с епифизен хрущял между двете костни структури (т.е. SOC и първичната спонгиоза); тези дискове се наричат (епифизни) растежни плочи 1 и остават в дългите кости през останалата част от периода след раждането (фиг. 1б, виж схемата на фиг. 2а). Това разпределение на епифизарния хрущял в пространствено отделена структура на растежната плоча от SOC е необходимо, за да се защитят хондроцитите на растежната плоча от механични изисквания, свързани с носенето на тежести по време на младежкия растеж. 2 Важното е, че епифизният хрущял непрекъснато улеснява растежа на костите преди, по време и след образуването на растежна плоча.
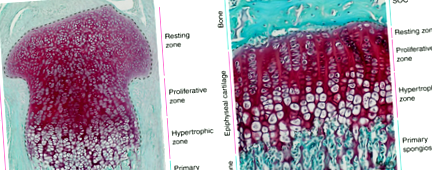
Хистологични изображения на миши епифизарен хрущял преди (а) и след (б) плочата за растеж се определя от узряването на центъра за вторична осификация. Тъкани от 3 дни (а) и на 30 дни (б) проксималните пищяли на мишката се оцветяват със Safranin O (червен, хрущял) и Fast Green (зелен, костен и съединителна тъкан).
Схематично представяне на различни етапи на костен растеж (а) и механизми на генериране на хондроцити преди и след формирането на епифизната ниша на стволови клетки (б).
По време на всички етапи на растеж на дългите кости, епифизарният хрущял може да бъде разделен хистологично на три отделни зони: зони на покой, пролиферация и хипертрофия (Фиг. 1). Зоната за почивка съдържа кръгли хондроцити в най-малко диференциран стадий (хондро-предшественици), които се делят рядко и чието потомство допринася за пролиферативната зона. 3,4,5 В пролиферативната зона хондроцитите се делят бързо и се изравняват, подреждайки се в колони, които се подреждат успоредно на посоката на растеж. След това хондроцитите излизат от клетъчния цикъл и допълнително се диференцират в големи хипертрофични хондроцити, образувайки хипертрофичната зона. Едновременно с това клетките ремоделират и калцират хрущяла, който ги заобикаля. Впоследствие хипертрофичните хондроцити претърпяват апоптоза или транс-диференциация в остеобласти, 6,7,8, които оставят празни лакуни, заобиколени от калцифициран хрущял. Лакуните са нападнати от кръвоносни съдове, придружени от остео-предшественици, които използват калцифицирания хрущялен матрикс като скеле, върху което се произвежда костната матрица. Следователно удължаването на костите е пряко свързано с размера на хипертрофичните хондроцити. 9 Целият процес се нарича ендохондрално костно образуване и важи за всички дълги кости в тялото.
Тъй като процесът на растеж на дълги кости изисква огромен брой хипертрофични хондроцити, има непрекъснато генериране на хипертрофични хондроцити при всички растящи деца.
Новите наблюдения разкриват нов механизъм на генериране на хондроцити
Взети заедно, тези проучвания показват, че има концептуална разлика между растежа на костите на новороденото и след раждането, първият се основава на консумацията на хондро-предшественици, докато вторият се основава на стволови клетки и съответна ниша на стволови клетки, което улеснява тяхното поддържане ( Фиг. 2а, б). Има няколко последици от това откритие.
Концепцията за епифизната ниша на стволови клетки
Концепцията за нишата на стволовите клетки като специфична микросреда, която насърчава обновяването на прогениторните клетки е изложена от R. Schofield през 1978 г. 17 Тези микросреди са силно променливи за различните ниши на стволови клетки и могат да повлияят на поведението на стволовите клетки по много различни начини чрез взаимодействия със съседни типове клетки, сложни мрежи и градиенти на сигнални молекули, компоненти на извънклетъчната матрица и механични сили. Например, възрастни хематопоетични стволови клетки (HSC) изискват взаимодействие с ендотелни клетки и CXC-хемокинов лиганд 12 (CXCCL12) - изобилни ретикуларни (CAR) мезенхимни стромални клетки за тяхното обновяване, както силно експресиращи CXCCL12, така и фактор на стволови клетки, 18,19, 20 междуфоликуларни епидермиса (IFE) стволови клетки изискват прикрепване към базалната мембрана, 21 и мезенхимните стволови клетки се поддържат от механични стимули. 22 Равномерният състав на една ниша може да бъде много сложен и да включва различни видове клетки и фактори на околната среда, като за нишата на HSC, върху CAR и ендотелните клетки, той включва макрофаги, остео-предшественици, ниско напрежение на кислород, немиелинизиращо Клетки на Шван и симпатикова инервация (за преглед вж. Справки 19,20).
В случай на растежната плоча, микросредата на нишата възниква едновременно с образуването на костната епифиза (т.е. след като SOC е узряло) директно над слоя хондро-предшественици (фиг. 1б). По този начин взаимодействието между костната тъкан и епифизарните стволови клетки може да доведе до тяхното обновяване или чрез директно взаимодействие, промени в извънклетъчната матрица (ECM) или дифузни морфогени. 11.
Образуването на различни ниши на стволови клетки се случва късно в развитието или дори след раждането. Например, при мишки хематопоетични стволови клетки, намиращи се в костите на ембрионален ден Е17.5, 23 се появява обновяване на космените фоликули с началото на цикъла на косата около 17, 24 ден след раждането, нишата на зародишните клетки започва да функционира правилно при полово съзряване 25 и обновяването на ставните хондро-предшественици започва след кавитация на ставите. 26,27 Формирането на епифизната ниша на стволови клетки при постнаталното развитие на костни епифизи се вписва добре в този модел.
Сливане на растежната плоча и нишата на стволовите клетки
Хормон на растежа, хранене и растеж
Растежният хормон (GH) е ключов стимулант на детския растеж и често се използва за лечение на деца със забавен растеж. Някои действия на GH обаче остават да бъдат обяснени, като относително малкото увеличение на крайната височина и неотзивчивост към терапията при някои деца. 38 Някои от ефектите на GH се медиират чрез инсулиноподобен растежен фактор I (IGF1), но също така е показано пряко действие върху растежната плоча, 39 за което се предлага да бъде специално върху клетките в зоната на покой. 40 Интересното е, че действието на GH, стимулиращо растежа, се появява при възраст между 2 и 3 седмици при мишки, 41 съвпадащо с появата на епифизарни стволови клетки и нишата. 10,11 Съчетавайки всички тези косвени наблюдения, е правдоподобно да се предположи, че GH може да действа конкретно върху епифизарните стволови клетки или да модулира тяхната ниша. Действието на GH върху епифизарните стволови клетки и състава на нишата остава да бъде изяснено.
mTOR комплекс 1 (mTORC1) е хранителен сензор 42 и ускорява диференциацията на чревните стволови клетки и невронните стволови клетки, 43,44 докато насърчава първоначалното разширяване на хематопоетичните стволови клетки. 45 В нишата на епифизарните стволови клетки активирането на mTORC1 насърчава симетричното разделяне на стволовите клетки, като по този начин увеличава броя им, 11 вероятно по начин, независим от автофагия. 46 При генетични експерименти активирането на mTORC1 не води до удължаване на костите, може би поради постепенната дезорганизация на растежната плоча. 47 Въпреки това, временното активиране на mTORC1, като например с високи нива на аминокиселини или IGF1 (и двата основни активатора на mTORC1), може на теория да увеличи броя на епифизарните стволови клетки.
Модели на растеж и еволюция
В заключение, откритието на епифизарната ниша на стволови клетки и епифизарните стволови клетки, които са отговорни за надлъжния растеж след раждането, предоставя нова перспектива за регулиране на растежа сама по себе си, както и предоставя алтернативен изглед на необясними в момента клинични наблюдения. Въпреки това, директната екстраполация на наблюденията, направени от мишки, към човешката физиология трябва да се извършва с повишено внимание, тъй като техните механизми на растеж не са идентични.
Препратки
Kronenberg, H. M. Регулиране на развитието на растежната плоча. Природата 423, 332–336 (2003).
Xie, М. и сътр. Вторичните центрове за осификация се развиха, за да направят ендохондралния растеж на костите възможен според изискванията на земната среда. bioRxiv 571612 (2019). https://doi.org/10.1101/571612.
Kember, N. F. Клетъчно делене при ендохондрална осификация. J. Bone Jt. Surg. Br. 42-Б, 824–839 (1960).
Chagin, A. S. et al. И двата G-протеиностимулиращи субединица алфа и Gq/11α G-протеини са необходими за поддържане на неподвижни стъблоподобни хондроцити. Нат. Общ. 5, 1–14 (2014).
Абад, В. и сътр. Ролята на зоната за почивка в хондрогенезата на растежната плоча. Ендокринология 143, 1851–1857 (2002).
Yang, G. et al. Остеогенна съдба на хипертрофичните хондроцити. Резолюция на клетката. 24, 1266 (2014).
Zhou, X. et al. Хондроцитите трансдиференцират в остеобласти в ендохондралната кост по време на развитие, постнатален растеж и зарастване на фрактури при мишки. PLoS Genet. 10, e1004820 (2014).
Ono, N., Ono, W., Nagasawa, T. & Kronenberg, H. M. Подгрупа от хондрогенни клетки осигурява ранни мезенхимни прародители в растящи кости. Нат. Cell Biol. 16., 1157–1167 (2014).
Cooper, K. L. et al. Множество фази на разширяване на хондроцитите са в основата на разликите в пропорциите на скелета. Природата 495, 375–378 (2013).
Mizuhashi, K. et al. Почивната зона на растежната плоча съдържа уникален клас скелетни стволови клетки. Природата 563, 254–258 (2018).
Newton, P. T. et al. Радикално превключване в клоналността разкрива ниша на стволови клетки в епифизарната растежна плоча. Природата 567, 234–238 (2019).
Zhou, B. O., Yue, R., Murphy, M. M., Peyer, J. G. & Morrison, S. J. мезенхимни стромални клетки, експресиращи лептин-рецептор, представляват основния източник на кост, образуван от костен мозък на възрастни. Клетъчна стволова клетка 15, 154–168 (2014).
Worthley, D. L. et al. Gremlin 1 идентифицира скелетна стволова клетка с костен, хрущялен и ретикуларен стромален потенциал. Клетка 160, 269–284 (2015).
Chan, C. K. F. et al. Идентификация и спецификация на скелетната стволова клетка на мишката. Клетка 160, 285–298 (2015).
Chan, C. K. F. et al. Идентифициране на човешката скелетна стволова клетка. Клетка 175, 43–56.e21 (2018).
Debnath, S. et al. Откриване на периостална стволова клетка, медиираща интрамембранозно костно образуване. Природата 562, 133–139 (2018).
Schofield, R. Връзката между образуващата колония на далака клетка и хематопоетичната стволова клетка. Кръвни клетки 4, 7–25 (1978).
Kiel, M., Morrison, S., Kiel, M. J. & Morrison, S. J. Несигурност в нишите, които поддържат хематопоетични стволови клетки. Нат. Преподобен Имунол. 8, 290–301 (2008).
Crane, G. M., Jeffery, E. & Morrison, S. J. Възрастни ниши на хематопоетични стволови клетки. Нат. Преподобен Имунол. 17, 573–590 (2017).
Hoggatt, J., Kfoury, Y. & Scadden, D. T. Ниша на хематопоетични стволови клетки в здравето и болестите. Ану. Преподобни Патол. 11., 555–581 (2016).
Hsu, Y. C., Li, L. & Fuchs, E. Възникващи взаимодействия между стволови клетки на кожата и техните ниши. Нат. Med. 20., 847–856 (2014).
Guilak, F. et al. Контрол на съдбата на стволовите клетки чрез физически взаимодействия с извънклетъчния матрикс. Клетъчна стволова клетка 5, 17–26 (2009).
Christensen, J. L., Wright, D. E., Wagers, A. J. & Weissman, I. L. Циркулация и хемотаксис на фетални хематопоетични стволови клетки. PLos Biol. 2, E75 (2004).
Blanpain, C. & Fuchs, E. Епидермални стволови клетки на кожата. Ану. Rev. Cell Dev. Biol. 22., 339–373 (2006).
Oatley, J. M. & Brinster, R. L., Нишовата единица на зародишната линия на стволови клетки в тестисите на бозайници. Физиол. Преп. 92, 577–595 (2012).
Li, L. et al. Повърхностните клетки са самообновяващи се хондроцитни предшественици, които образуват ставния хрущял при млади мишки. Faseb J. 31, 1067–1084 (2017).
Shwartz, Y., Viukov, S., Krief, S. & Zelzer, E. Развитието на ставите включва непрекъснат приток на Gdf5-положителни клетки. Представител на клетката. 15, 2577–2587 (2016).
Klein, A. M. & Simons, B. D. Универсални модели на съдбата на стволовите клетки при колоездене на възрастни тъкани. Развитие 138, 3103–3111 (2011).
Snippert, H. J. et al. Хомеостазата на чревната крипта е резултат от неутрална конкуренция между симетрично делящи се Lgr5 стволови клетки. Клетка 143, 134–144 (2010).
Hume, W. J. & Potten, C. S. Дълготраен тимидинов басейн в епителни стволови клетки. Кинет на клетъчни тъкани. 15, 49–58 (1982).
Kember, N. F. Клетъчна кинетика и контрол на растежа на дълги кости. Кинет на клетъчни тъкани. 11., 477–485 (1978).
Morrison, S. J. & Spradling, A. C. Стволови клетки и ниши: механизми, които насърчават поддържането на стволови клетки през целия живот. Клетка 132, 598–611 (2008).
Chagin, A. S. & Sävendahl, L. Естрогенни рецептори и линеен растеж на костите. Acta Pædiatrica 96, 1275–1279 (2007).
Smith, E. P. et al. Естрогенна резистентност, причинена от мутация в естроген-рецепторния ген при мъж. N. Engl. J. Med. 331, 1056–1061 (1994).
Morishima, A., Grumbach, M. M., Simpson, E. R., Fisher, C. & Qin, K. Ароматазен дефицит при мъжки и женски братя и сестри, причинен от нова мутация и физиологичната роля на естрогените. J. Clin. Ендокринол. Metab. 80, 3689–3698 (1995).
Emons, J. et al. Епифизарното сливане в човешката растежна плоча не включва класическа апоптоза. Педиатър. Рез. 66, 654–659 (2009).
Emons, J., Chagin, A. S., Savendahl, L., Karperien, M. & Wit, J. M. Механизми на съзряване на растежната плоча и сливане на епифизата. Хорм. Рез. Педиатър. 75, 383–391 (2011).
Wong, S. C. et al. Растеж и ос на растежен хормон-инсулин като растежен фактор 1 при деца с хронично възпаление: настоящи доказателства, пропуски в знанията и бъдещи насоки. Endocr. Преп. 37, 62–110 (2016).
Isaksson, O. G., Jansson, J. O. & Gause, I. A. Растежният хормон стимулира директно надлъжния костен растеж. Наука 216, 1237–1239 (1982).
Ohlsson, C., Nilsson, A., Isaksson, O. & Lindahl, A. Растежният хормон предизвиква умножаване на бавно циклиращите зародишни клетки на плочата на растежа на пищяла на плъховете. Proc. Natl Акад. Sci. САЩ 89, 9826–9830 (1992).
Zhou, Y. et al. Модел на бозайници за синдрома на Laron, произведен от целенасочено нарушаване на рецептора на миши растежен хормон/свързващия протеин ген (мишката Laron). Proc. Natl Акад. Sci. САЩ 94, 13215–13220 (1997).
Chantranupong, L., Wolfson, R. L. & Sabatini, D. M. Механизми за наблюдение на хранителни вещества през цялата еволюция. Клетка 161, 67–83 (2015).
Yilmaz, O. H. et al. mTORC1 в нишата на клетките на Paneth свързва функцията на чревните стволови клетки с приема на калории. Природата 486, 490–495 (2012).
Mahoney, C., Feliciano, D. M., Bordey, A. & Hartman, N. W. Включването на mTORC1 предизвиква неврогенеза, но не и пролиферация в нервни стволови клетки на млади мишки. Невроски. Lett. 614, 112–118 (2016).
Gan, B. et al. mTORC1-зависима и независима регулация на обновяване, диференциация и мобилизация на стволови клетки. Proc. Natl Акад. Sci. САЩ 105, 19384–19389 (2008).
Vuppalapati, K. K. et al. Целевото изтриване на автофагични гени Atg5 или Atg7 в хондроцитите насърчава зависимата от каспаза клетъчна смърт и води до леко забавяне на растежа. J. Bone Мин. Рез. 30, 2249–2261 (2015).
Newton, P. T., Xie, M., Medvedeva, E. V., Sävendahl, L. & Chagin, A. S. Активирането на mTORC1 в хондроцитите не засяга пролиферацията или диференциацията, но кара зоната на покой на растежната плоча да се разстройва. Bone Rep. 8, 64–71 (2018).
Благодарности
Благодарим на проф. Колин Фаркуарсън (Институтът Рослин и Роял (Дик) училище за ветеринарни изследвания, Университета в Единбург) за конструктивни дискусии и Олга Харченко за графична работа. A.S.C. благодари на шведския изследователски съвет (2016-02835), Karolinska Institutet, вътрешния грант за стартиране на университета Сеченов (програма 5-топ-100) и руската научна фондация (19-15-00241) за финансова подкрепа. P.T.N. благодаря на Frimurare Barnhuset i Stockholm и Barnavård stiftelse за финансовата подкрепа.
Информация за автора
Принадлежности
Катедра по физиология и фармакология, Karolinska Institutet, 17177, Стокхолм, Швеция
Андрей С. Чагин и Филип Т. Нютон
Институт по регенеративна медицина, Първи Московски държавен медицински университет (Сеченов университет), Москва, Руска федерация
Андрей С. Чагин
Отдел за здравето на жените и децата, Институт Каролинска и отделение за детска ендокринология, Университетска болница Каролинска, 17176, Стокхолм, Швеция
Филип Т. Нютон
Можете също да търсите този автор в PubMed Google Scholar
Можете също да търсите този автор в PubMed Google Scholar
Вноски
A.S.C. и П.Т.Н. замислил проучването. A.S.C. написал чернова и П.Т.Н. съдейства при писането, обсъждането и критичния преглед на проекта.
Автора за кореспонденция
Етични декларации
Конкуриращи се интереси
Авторите не декларират конкуриращи се интереси.
Допълнителна информация
Бележка на издателя Springer Nature остава неутрален по отношение на юрисдикционните претенции в публикувани карти и институционални принадлежности.
- Връзка между фракционната зона на бета-клетките на панкреаса и концентрацията на глюкоза на гладно
- Потенциални ползи от L-карнитин като хранителна добавка - Писма до редактора - Американско семейство
- Потенциални опасности от хранителни добавки Новини за безопасност на храните
- Крива на растеж на теглото на сибирски хъскита и средни тегла
- Потенциалният агент за отслабване от дърво е почти твърде добър, за да е истина - Los Angeles Times