Резюме
Цели/хипотеза
Серумната стеаринова киселина (С18: 0) е повишена при лица с хиперлипидемия и диабет тип 2. Липотоксичността, предизвикана от повишена стеаринова киселина в бета клетките, обаче не е добре описана. Това проучване има за цел да изследва неблагоприятните ефекти на стеариновата киселина върху бета клетките и потенциалните механизми, чрез които те се медиират.
Методи
Три групи мишки C57BL/6 са хранени с нормална диета или с високостеаринова киселина/диета с висока палмитинова киселина, съответно в продължение на 24 седмици. Профилите на микроРНК (miR) на островчетата се определят чрез скрининг на микрочипове. Нараняването на островче е установено при съвместно оцветяване с помощта на TUNEL анализа и инсулиновото маркиране. Лентивирусен вектор, експресиращ анти-miRNA-34a-5p олигонуклеотид (AMO-34a-5p) беше инжектиран в мишки по интрадуктален път на панкреаса.
Резултати
И в островчетата на мишки, и в култивираните INS-1 клетки на инсулином на плъх стеариновата киселина проявява по-силна липотоксична роля от другите мастни киселини поради репресията на В-клетъчен CLL/лимфом 2 (BCL-2) и BCL-2-подобен 2 (BCL- W) чрез стимулиране на miR-34a-5p със стеаринова киселина. Индуцираната от стеаринова киселина липотоксичност и намаляването на секрецията на инсулин се облекчават с AMO-34a-5p. По-нататъшни изследвания в INS-1 клетки разкриват, че p53 участва в повишаване на miR-34a-5p, предизвикано от стеаринова киселина, отчасти поради активиране на подобна на протеин киназа ендоплазмена ретикулум киназа (PERK). Обратно, заглушаването на PERK облекчава индуцираната от стеаринова киселина p53, miR-34a-5p и липотоксичността.
Заключения/тълкуване
Тези открития дават нова представа за разбирането на молекулярните механизми, които са в основата не само вредното въздействие на индуцираната от стеаринова киселина липотоксичност, но също така и апоптозата в бета клетките и прогресията към диабет тип 2.
Въведение
Липотоксичността се отнася до клетъчната дисфункция, причинена от повишено ниво на NEFA. Натрупващите се данни показват, че липотоксичността допринася за увреждане на бета клетки и играе критична роля в развитието на диабет тип 2 [1–3]. NEFA е химически класифициран на наситени и ненаситени мастни киселини. Широко разпространено е мнението, че липотоксичността се предизвиква най-вече от наситени мастни киселини с дълги вериги (SFA), като палмитинова (C16: 0) и стеаринова киселина (C18: 0), докато ненаситените мастни киселини като цяло са по-малко токсични и може дори да е защитна [4–6].
Въпреки че молекулярните механизми на индуцираната от стеаринова киселина липотоксичност не са напълно изяснени, очевидно е, че усиленият стрес на ендоплазматичния ретикулум (ER) има основен принос за липотоксичността в резултат на препрограмиране на транскрипция [12], активиране на c-Jun N-терминална киназа [13], CCAAT/енхансер свързващ протеин хомоложен протеин (CHOP) [14], p53 и митохондриални апоптозни пътища [15, 16]. Важното е, че микроРНК (miRNAs), които участват в пост-транскрипционната регулация при ER стрес, са се появили като ключови регулатори на липотоксичността на хепатоцитите и сърдечния мускул [17, 18]. В островните бета клетки участието на miRNA в медиираната от стеаринова киселина липотоксичност все още е неясно.
В това проучване ние предположихме, че увеличаването на стеариновата киселина предизвиква по-тежка липотоксичност на бета клетки от други NEFA и нейният основен механизъм е свързан с miRNA (miR) -34a-5p.
Методи
Материали
Основни разтвори на стеаринова и палмитинова киселини (Sigma, St Louis, MO, USA) се приготвят, както е описано по-горе [19]. Олигонуклеотидите и лентивирусът са описани в методите на електронния допълнителен материал (ESM).
Експерименти с животни
Всички експериментални процедури следваха насоките за грижа и използване на животните, установени от Медицинския университет в Харбин и одобрени от Комитета по етика на експеримента с животни на Медицинския университет в Харбин. Седемседмични мъжки мишки C57BL/6 са закупени от Vital River Laboratories (Пекин, Китай) и напълно рандомизирани, за да получат нормална диета, диета с високо съдържание на стеаринова киселина (HSD) или диета с висока палмитинова киселина (HPD) ) (Таблица 1 на ESM). Лентивирусен вектор, експресиращ анти-miRNA-34a-5p олигонуклеотид (AMO-34a-5p) (lenti-AMO-34a-5p) (1 × 10 8 TU/ml), се инжектира бавно в мишки през панкреатичния канал (100 μl) след хранене в продължение на 24 седмици, както е описано по-рано [20]. Допълнителни измервания бяха извършени на 4 седмици след лентивирусна инфекция. Вижте ESM методи. Експериментаторите бяха слепи за групово разпределение и оценка на резултатите.
Серумен NEFA профил и измерване на глюкоза и липиди
Кръвни проби бяха събрани за по-нататъшно откриване. Вижте ESM методи.
анализ на miRNA микрочипове
Oebiotech (Шанхай, Китай) извърши работата с miRNA микрочипове, обработвайки 12 проби от миши островчета (н = 4 на група). Вижте ESM методи.
Съвместно оцветяване с помощта на TUNEL анализ и островчета, маркирани с инсулин
Нараняването на островче е открито с комплекта за откриване на смърт In Cell (TUNEL Fluorescence Kit, Roche, Indianapolis, IN, USA). Островчетата са белязани с анти-инсулиново антитяло (Cell Signaling Technology, Минеаполис, MN, САЩ) и са разгледани чрез конфокална микроскопия. Вижте ESM методи.
Съдържание на панкреатичен инсулин
Панкреасът се екстрахира, използвайки метода на киселинния етанол, както е описано по-горе [21], и се установява нивото на инсулин.
Интравенозни тестове за глюкозен толеранс
IVGTTs се извършват на мишки, които са гладували през нощта. За измерване на нивата на инсулин и глюкоза се вземат кръвни проби на 0, 1, 5, 10, 20, 30 и 60 минути след прилагане на глюкоза (0,75 g/kg) във вената на опашката.
Бета клетъчна маса и хистохимичен анализ
Тъканите на панкреаса бяха фиксирани, вградени в парафин и оцветени с анти-инсулинови и анти-глюкагонови антитела. Вижте ESM методи.
Анализ на инсулинови гранули
Използвана е електронна микроскопия за анализ на съдържанието на гранули на инсулин във фиксирани тъкани на панкреаса, както е описано по-рано [22].
Клетъчна култура
INS-1 клетки от клетъчна линия на инсулинома от плъх се култивират и се обработват с 600 μmol/l стеаринова или други мастни киселини в продължение на 24 часа. Изолирани са миши панкреатични островчета, както е описано по-горе [23]. Вижте ESM методи. Експериментаторите бяха слепи за групово разпределение и оценка на резултатите.
Измервания на жизнеспособността на клетките
Клетъчната жизнеспособност се определя чрез оценка на освобождаването на лактат дехидрогеназа (LDH), оцветяване с пропидиев йодид (PI), 3- (4,5-диметил-2-тиазолил) -2,5-дифенил-2З.-анализ на тетразолиев бромид (MTT) и оцветяване по Hoechst. Вижте ESM методи.
Процедури по трансфекция
INS-1 клетките бяха трансфектирани с олигонуклеотиди или рекомбинантен плазмид, използвайки Lipofectamine 2000 (Invitrogen), както е описано по-горе [24], и използвани в тестове за откриване 48 часа след трансфекцията.
Анализ на активността на луциферазата
Активността на луциферазата се открива, като се използва анализ на активността на луциферазата. Вижте ESM методи.
Количествена PCR
Нивата на mRNA и miRNA се определят чрез количествена PCR (qPCR). Вижте ESM методи. Последователностите на праймера са показани в таблица 2 на ESM.
Уестърн петно
Уестърн блот процедурата е описана по-рано [25]. Вижте ESM методи.
Измервания на инсулина
Нивата на инсулин в миши серум и среда за клетъчни култури се определят чрез инсулин за мишка/плъх ELISA (Linco Research, St Charles, MO, USA). За да се оцени индуцираната от глюкоза секреция на инсулин (GSIS), клетките се инкубират в секреционен буфер (вж. ESM методи) за допълнителни 60 минути с 2,8 или 20 mmol/l глюкоза.
Статистика
Стойностите се изразяват като средна стойност ± SD. Множество групи бяха анализирани с еднопосочен ANOVA, последван от тест на Student-Newman-Keuls. Извършени са сравнения само с две групи т тест. Двустранен стр стойност
Резултати
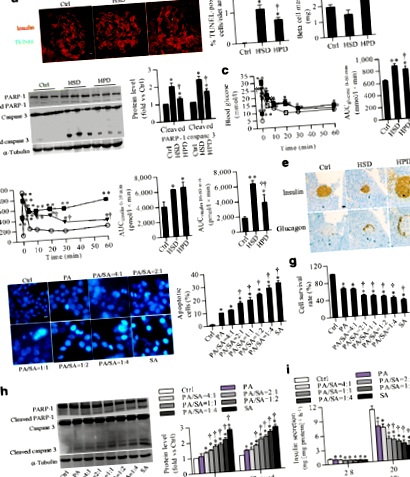
Стеариновата киселина предизвиква по-тежка липотоксичност от палмитиновата киселина
Стеариновата киселина повишава нивата на miR-34a-5p както в мишите островчета, така и в INS-1 клетките
В HSD островчетата 40 miRNAs бяха експресирани диференциално (десет нагоре и 30 регулирани надолу ≥2,0 пъти промяна и стр Фиг. 2
Количествената PCR потвърждава, че нивата на miR-34a-5p са се увеличили съответно с 191% в HSD и 97% в HPD островите, в сравнение с нормалните острови (фиг. 2b). В INS-1 клетки, изложени на различни съотношения на палмитинова/стеаринова киселина, експресията на miR-34a-5p беше значително увеличена в сравнение с контролите в клетки, изложени на по-висок дял на стеаринова киселина, (Фиг. 2в).
miR-34a-5p допринася за индуцирана от стеаринова киселина липотоксичност в островчета и INS-1 клетки
miR-34a-5p специално потиска експресията на BCL-2 и BCL-W
Експресията на В-клетъчен CLL/лимфом 2 (BCL-2) и BCL-2-подобен 2 (BCL-W) е намалена както в HSD островчета, така и в третирани със стеаринова киселина INS-1 клетки (Фиг. 4а, b). Обработката с AMO-34a-5p, или in vitro, или in vivo, значително обърна медиираната от стеаринова киселина понижена регулация на BCL-2 и BCL-W протеини (Фиг. 4в, d). В INS-1 клетките, свръхекспресиращи miR-34a-5p, нивата на BCL-2, както и BCL-W бяха намалени, но бяха ефективно спасени чрез добавяне на AMO-34a-5p (фиг. 4д). Освен това, анализът на луцифераза потвърждава, че свръхекспресията на miR-34a-5p инхибира луциферазната активност в клетки на човешки ембрионален бъбрек 293 (HEK293), трансфектирани с плазмид, носещ 3 ′ UTR на всеки от Bcl2 или Bcl2l2 ген (фиг. 4е).
p53 участва в повишаване на miR-34a-5p, предизвикано от стеаринова киселина
Количеството p53 протеин се увеличава в HSD островчета и третирани със стеаринова киселина INS-1 клетки (ESM фиг. 7а). Индуцираната от стеаринова киселина липотоксичност се отменя след заглушаване стр53 (също известен като Trp53), придружен от 75% намаление на увеличен стеаринова киселина miR-34a-5p (фиг. 5a – c). Междувременно повишеното регулиране на разцепения PARP-1 и разцепената каспаза-3 от стеаринова киселина, както и понижаването на експресията на протеини BCL-2 и BCL-W, беше спасено чрез нокдаун p53 (фиг. 5г).
PERK допринася за повишено регулиране на miR-34a-5p от стеаринова киселина и липотоксичност
Резултатите ни in vitro показаха, че трансмембранните сензори за ER стрес, включително ензим 1, който изисква инозитол (IRE1), активиращ транскрипционен фактор 6 (ATF6) и PERK, са силно регулирани чрез лечение със стеаринова киселина. По същия начин, ER протеините на стресови маркери, като CHOP и глюкозно-регулираният протеин 78 kDa (GRP78), също бяха подобрени (ESM Фиг. 7b). Генетично заглушаване Перк (също известен като Eif2ak3) чрез малка интерферираща РНК (siRNA) в INS-1 клетки значително блокира индуцираното от стеаринова киселина увеличение на експресията на p53 (фиг. 6а), нивото на miR-34a-5p (фиг. 6б) и липотоксичността (фиг. 6в, d ). Съответно, повишената със стеаринова киселина експресия на разцепен PARP-1 и разцепена каспаза 3, както и потиснати BCL-2 и BCL-W, се връщат на базалните нива след инхибиране на Перк израз (фиг. 6д). Въпреки това, генното заглушаване на нито едното, нито другото Ire1 нито Atf6 инхибира индуцираните от стеаринова киселина промени, открити по-горе (ESM Фиг. 8). Освен това, фосфорилираното ниво на фактор за иницииране на транслация на еукариот (eIF) 2α се повишава значително след излагане на стеаринова киселина (ESM Фиг. 9). Инхибиторната ефективност на таргетирането на siRNAs стр53, Ire1, Atf6 и Перк са показани на ESM Фиг. 10.
Дискусия
В това проучване ние предоставяме доказателства, че в сравнение с други NEFA, стеариновата киселина е основният фактор за липотоксичността в бета клетките, което предполага, че повишената концентрация на серумна стеаринова киселина играе основна роля в развитието на бета-клетъчна дисфункция и диабет тип 2 . Нашите механистични проучвания разкриха, че регулирането на miR-34a-5p модулира индуцираната от стеаринова киселина липотоксичност чрез инхибиране на производството на BCL-2 и BCL-W протеини. Допълнителни проучвания също демонстрират, че свързаният с ER-стрес сензор PERK допринася за повишено регулиране на miR-34a-5p от стеаринова киселина в p53-зависим сигнален път.
Предишни проучвания показват, че miR-34a-5p е тясно свързан с апоптоза чрез семейството BCL-2 в ракови клетки, тубуларни клетки и кардиомиоцити [37–39]. Семейството BCL-2 включва както анти-апоптозни членове (BCL-2, BCL-2-подобен 1 [BCL-XL] и BCL-W), така и членове с проапоптоза (свързан с BCL-2 X протеин [BAX], BCL -2-антагонист/убиец [BAK] и BCL-2-свързан агонист на клетъчна смърт [BAD]) [40, 41]. В нашето проучване потвърдихме, че BCL-2 и BCL-W са директни цели на miR-34a-5p, използвайки тестове за активност на луциферазата. Все пак как стеариновата киселина регулира нивата на miR-34a-5p все още не е ясно. Натрупващите се доказателства подкрепят p53 като класически транскрипционен фактор, регулиращ miR-34a-5p. За по-нататъшно изследване на участието на p53 в регулирането на miR-34a-5p след продължителна инкубация на INS-1 клетки със стеаринова киселина, ние заглушихме стр53 и след това изследва дали нивата на miR-34a-5p са обърнати, със свързано с това намаляване на липотоксичността, което предполага, че механизмът, лежащ в основата на HSD-индуцирана стимулация на miR-34a-5p, използва p53-зависим път.
Засиленият ER стрес, свързан с липотоксичността на бета клетки, трансдуцира апоптотични сигнали в ранния стадий на диабет тип 2 [42]. Три основни сигнални пътя, отделно инициирани от ER трансмембранни сензорни протеини, включително IRE1, PERK и ATF6, участват в ER стрес [43]. Впоследствие съборихме Ire1, Перк и Atf6 с siRNAs в третирани със стеаринова киселина INS-1 клетки и установи, че инхибирането на Ire1 и Atf6 не успя да инхибира индуцираната от стеаринова киселина стимулация на miR-34a-5p. Въпреки това, трансфекцията на siRNA за Перк отслабена липотоксичност и нива на miR-34a-5p при лечение със стеаринова киселина. Тези открития демонстрират, че miR-34a-5p може да бъде насърчаван от PERK в условия на ER стрес. Също така открихме, че PERK проявява инхибиторен ефект върху експресията на протеини p53, което предполага, че оста PERK – p53 – miR-34a-5p е механично свързана с индуцираната от стеаринова киселина липотоксичност в бета клетки.
Освен това възпалителният отговор е често срещаната реакция по време на продължително излагане на NEFA, което от своя страна води до влошаване на липотоксичността. Хроничното излагане на възпалителни състояния води до дисфункция на бета клетките и апоптоза [32, 44, 45]. Неотдавнашно разследване разкри, че нивото на miR-34a се увеличава едновременно в лекуваните с цитокини MIN6 клетки и човешките панкреатични островчета и допринася за бета-клетъчна дисфункция [32]. Следователно, ние предложихме, че HSD-индуцираното увеличаване на miR-34a-5p и по-нататъшното увреждане на панкреаса вероятно представляват важен път на възпалителен отговор. Това трябва да бъде изяснено в бъдещи проучвания.
В заключение предоставяме доказателства, че повишените нива на циркулираща стеаринова киселина предизвикват тежка липотоксичност в бета-клетките на панкреаса. Изглежда, че повишеното регулиране на miR-34a-5p и свързаното с него инхибиране на BCL-2/BCL-W играят критична роля за медииране на цитотоксичността на стеаринова киселина. Нашите резултати също така предполагат регулаторна роля за PERK в експресията на miR-34a-5p и че p53 е медиатор на индуцираната от PERK регулиране на miR-34a-5p. Като цяло тези открития ни позволяват да предложим нов сигнален път, свързващ стеариновата киселина с липотоксичността в бета клетките: стеаринова киселина-PERK-p53-miR-34a-5p-BCL-2/BCL-W. Тези открития дават нова представа за индуцираната от стеаринова киселина липотоксичност и прогресирането на диабет тип 2, при което понижаването на miR-34a-5p може да бъде ефективна стратегия за подобряване на липотоксичността в бета клетките.
- Повишената циркулираща стеаринова киселина води до основен липотоксичен ефект върху бета клетките на панкреаса на мишки
- Диференциация и трансплантация на функционални бета-клетки на панкреаса, генерирани от индуцирани
- Ефект на разширения фураж с високо съдържание на рибено масло върху растежа и състава на мастните киселини на дъгата
- Ефект на съотношението на хранителния фураж към концентрата върху абсорбцията на летливи мастни киселини и експресията
- Ефект на аскорбинова киселина върху екскрецията на N-нитрозопролин в урината на лакто-вегетарианци и