НАЗАРИИ КОБИЛЯК
1 Национален медицински университет „Богомолец“, Киев, Украйна
ЛУДОВИКО АБЕНАВОЛИ
2 Департамент по здравни науки, Университет Magna Graecia от Катандзаро, Италия
ТЕТЯНА ФАЛАЙЕЕВА
3 Национален университет на Тарас Шевченко в Киев, Украйна
ОЛЕКСАНДР ВИРЧЕНКО
3 Национален университет на Тарас Шевченко в Киев, Украйна
БЕЛЕМЕТС НАТАЛИЯ
3 Национален университет на Тарас Шевченко в Киев, Украйна
ТЕТЯНА БЕРЕГОВА
3 Национален университет на Тарас Шевченко в Киев, Украйна
ПЕТРО БОДНАР
1 Национален медицински университет „Богомолец“, Киев, Украйна
МИКОЛА СПИВАК
4 Институт по микробиология и вирусология Zabolotny, Национална академия на науките на Украйна, Киев, Украйна
Резюме
Заден план
Един от патогенните механизми на неалкохолната мастна чернодробна болест (NAFLD) е натрупването на реактивни кислородни видове, което от своя страна влошава развитието на болестта. Изследвахме нови наночастици цериев диоксид (nCeO2) поради тяхната обещаваща антиоксидантна авторегенеративна способност и ниска токсичност.
Методи
30 бели мъжки плъхове Wistar бяха разделени на 3 групи: контролни, индуцирани от наднормения глутамат (MSG) затлъстяване и MSG, третирани с nCeO2 (MSG + nCeO2) групи. Новородените плъхове от контролната група се инжектират с физиологичен разтвор (контрол). MSG- и MSG + nCeO2 групи се инжектират с MSG (концентрация 4 mg/g, 8 μl/g обем) между 2-ия и 10-ия ден от живота подкожно [13]. На възраст от 1 месец на плъхове от група II се прилага вода 2,9 ml/kg перорално, MSG + nCeO2 група получава 1 mM разтвор на nCeO2 1 mg/kg перорално. 4-месечни плъхове бяха умъртвени и черният дроб беше събран за хистологичен и биохимичен анализ. За да оценим морфологичните промени в черния дроб, използвахме NAS (оценка на активността на NAFLD). Съдържанието на продукти на пероксидация на липиди и ензимната активност на супероксиддисмутазата (SOD) и каталазата в черния дроб са изследвани със стандартни биохимични методи [Референции].
Резултати
При 4-месечни плъхове установихме значително по-нисък общ резултат (1,3 ± 0,26 срещу 3,6 ± 0,34, р. Ключови думи: безалкохолно мастно чернодробно заболяване, реактивни кислородни видове, плъхове Wistar, липидна пероксидация, наночастици
Заден план
Вниманието към световната епидемия от затлъстяване е повишено, тъй като това е петият водещ рисков фактор за глобални смъртни случаи [1]. Смъртността от всички причини при затлъстела популация е поне 20% по-висока в сравнение с нормалното тегло [2]. Честотата на затлъстяването силно корелира с широк спектър от свързани заболявания, като сърдечно-съдови заболявания (с изключение на застойна сърдечна недостатъчност) [3], диабет тип 2, всички видове рак (с изключение на рак на хранопровода при жените), астма, заболяване на жлъчния мехур, остеоартрит и хронична болка в гърба [4]. При лица със затлъстяване липидният метаболизъм е нарушен, което води до прекомерно натрупване на мазнини в организма. Едно от основните места за потенциално отлагане на мазнини е черният дроб, който е основната причина за развитието на безалкохолно мастно чернодробно заболяване (NAFLD).
NAFLD е най-честата причина за чернодробна дисфункция в западния свят поради тясната й връзка със затлъстяването, инсулиновата резистентност и дислипидемията [5]. NAFLD се определя като натрупване на липиди в хепатоцитите, надвишаващо 5% от теглото на черния дроб при липса на прекомерен прием на етанол (конвенционално дефиниран като прием на етанол 20 g/ден) и без други причини за чернодробни заболявания [6]. Механизмите, свързани с развитието на затлъстяване на черния дроб и прогресирането на заболяването, са неясни, но те могат да бъдат свързани с метаболитен профил в контекста на генетично предразположение [7]. Инсулиновата резистентност, оксидативен стрес, цитокини и затлъстяване са определени като основните рискови фактори, участващи в NAFLD/NASH патогенезата. Тези фактори могат да подпомогнат вътречернодробното натрупване на мазнини и липотоксичност, развитие на възпалителен статус, оксидативен стрес, апоптоза и фиброгенеза, които определят прогресията на заболяването [8].
Напоследък се съобщава за антиоксидантните ефекти на наночастиците на цериев диоксид (nCeO2), вид конструирани наноматериали. Понастоящем те се изследват за възможното им терапевтично значение. nCeO2 притежава каталитична активност, която произтича от наличието на две валентни състояния (Ce3 + и Ce4 +). Поради наличните в тези наночастици кислородни вакантни места, те са в състояние да реагират с околните реактивни кислородни видове, като по този начин въвеждат nCeO2 като потенциал in vivo миметик за ендогенни антиоксиданти като супероксиддисмутаза [9]. Съществуват обаче противоречиви резултати относно ефективността на антиоксидантната активност на nCeO2.
Един от патогенните механизми на NAFLD е натрупването на реактивни кислородни форми, които от своя страна влошават развитието на болестта [10]. Следователно, антиоксидантната терапия е необходима за успешното лечение на увреждането на черния дроб. По този начин ние имаме за цел да изследваме новите наночастици цериев диоксид (nCeO2), които показаха обещаваща антиоксидантна авторегенеративна способност и ниска токсичност [11,12]
Целта на това проучване е да се изследва влиянието на nCeO2 върху липидната пероксидация и активността на антиоксидантните ензими при плъхове с експериментално индуцирана NAFLD.
Методи
Уча дизайн
За разработване на експериментална NAFLD при плъхове е използван моделът на затлъстяване, индуцирано от мононатриев глутамат (MSG) [13–15]. В проучването са използвани бели мъжки плъхове Wistar (n = 30) и са разделени в 3 групи: контролна, MSG- и MSG + nCeO2 групи. Новородените плъхове от контролната група се инжектират с физиологичен разтвор (контрол). MSG- и MSG + nCeO2 групи се инжектират с MSG (4 mg/g, 8 μl/g обем) на 2-10-ия ден от живота подкожно [13]. На възраст от 1 месец на плъхове от група II се прилага вода в обем от 2,9 ml/kg през устата, MSG + nCeO2 група се третира с 1 mM разтвор на nCeO2 (1 mg/kg през устата). Леченията се провеждаха периодично в двуседмични курсове, редувани с двуседмични почивки за 3 месеца. По време на експеримента плъхове на възраст между един и четири месеца се хранят със стандартна лабораторна чау и вода от чешмата ad libitum. 4-месечните плъхове бяха жертвани и черният дроб беше отстранен за хистологичен и биохимичен анализ.
Хистологично изследване
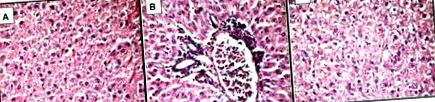
Леки микроскопични микроснимки на чернодробна тъкан на плъхове от група MSG, оцветени с хематоксилин и еозин, × 400.
А - изразена тотална микровезикуларна стеатоза;
B - микровезикуларна стеатоза с периваскуларна левкоцитна инфилтрация в зона 3 (леко лобуларно възпаление);
С - фокална некроза в резултат на дегенерация от балониране на хепатоцити - липса на ядра (център).
Леки микроскопични микроснимки на чернодробна тъкан на плъхове MSG + nCeO2, оцветени с хематоксилин и еозин, × 400.
A - единична периваскуларна лобуларна лимфоцитна инфилтрация;
B - фокална лека микровезикуларна стеатоза;
С - главно нормална хистологична структура на хепатоцитите.
Таблица I
Морфологични промени в чернодробната тъкан в експерименталните групи.
| Стеатоза (0–3) | 0,10 ± 0,1а | 2,1 ± 0,18в | 1,10 ± 0,18b | Фигура 3). Краткосрочното периодично перорално приложение на nCeO2 значително намалява липидната пероксидация в чернодробната тъкан, а именно намалява съдържанието на DC с 27% (p Фигура 4). |
Липидна пероксидация в черния дроб на плъх при условия на MSG-затлъстяване и лечение с nCeO2 (1 mg/kg). A, B, C - съдържание на конюгирани диени, TBA-продукти и Schiff основа в черния дроб, съответно. * - p Фигура 4). Лечението с nCeO2 доведе до възстановяване на активността на SOD до контролните стойности и намаляване на прекомерната активност на каталазата с 22,1% (p Фигура 4). По този начин, изследваните наночастици подобряват нарушеното про/антиоксидантно състояние в черния дроб при условия на MSG-индуцирана NAFLD.
Дискусия
Оксидативният стрес е едно от основните фундаментални явления по време на развитието на затлъстяването и NAFLD [20]. nCeO2 имитират активност на SOD и/или каталаза и са показали обещание като терапевтично приложение поради тяхната антиоксидантна авторегенеративна способност и ниска токсичност [22,23]. Електронната структура на CNPs в наномащаба подчертава тяхната антиоксидантна активност. Както голямото съотношение на повърхността към обема с намаляването на размера на частиците [24,25], така и способността за обратимо превключване между Ce 3 + и Ce 4 +, присъстващи на повърхността [26,27], водят до образуването на кислородни дефекти в кристалната решетка, която действа като „реактивни места“ или „горещи точки“ за отстраняване на реактивни кислородни видове (ROS) [28].
Физиохимичните свойства (размер, форма, състояние на агломерация в течност и покритие) на nCeO2 също могат да повлияят на биологичния им отговор и каталитичната активност. Описани са няколко нанокомпозита на CNP, които се използват за покриване на биосъвместими полимери (полиетилен гликол, декстран, полиакрилова киселина, лимонена и олеинова киселина) [29]. В нашето изследване използвахме почти оформен nCeO2 с цитратно покритие с размер на частиците 2–5 nm. Натриевият цитрат в нанокомпозитите служи не само като стабилизатор, който определя стабилността на състава на nCeO2 във вода и биологично значими среди, но също така играе важна роля във фармакокинетиката на nCeO2 в клетките. Цитратът като компонент на цикъла на Кребс осигурява nCeO2 в митохондриите, където ROS се образуват при патологични условия, което води до оксидативен стрес.
През последните години се наблюдава значителен интерес към nCeO2 като терапевтично средство и могат да бъдат намерени много примери, при които тези наночастици са тествани за лечение на няколко патологии, при които се получава дисбаланс на редокс състоянието [30]. В настоящото изследване първо изследвахме влиянието на nCeO2 върху пероксидацията на липидите в черния дроб и активността на антиоксидантните ензими при плъхове с експериментална NAFLD.
Няколко предишни проучвания ясно демонстрираха биоразпределението на nCeO2 главно в далака и черния дроб, също с следи от количества, открити в белите дробове и бъбреците, и почти никакви в сърцето или мозъка. Въпреки силното натрупване в далака и черния дроб за период от поне 30 дни, хистологичният анализ не разкрива никакви промени в цитологията на органите и показва типичната морфология на тъканите без разлика между лекуваните и контролните плъхове [31]. Само в едно проучване са открити грануломатозни образувания след 30 дни в черния дроб на плъхове, изложени на еднократна доза nCeO2 [32]. Това чернодробно увреждане обаче вероятно се дължи на високата доза администриран nCeO2 (85 mg/kg), което води до нарушен клирънс на наночастици.
Hirst и сътр. съобщава, че седмично приложение на nCeO2 в продължение на 2 или 5 седмици с 0,5 mg/kg на мишки с индуцирана чернодробна токсичност (чрез CCl4) показва подобни констатации на мишки, лекувани с N-ацетил цистин (NAC), обичайно терапевтично средство за намаляване на оксидативния стрес [31 ]. Тези данни са в съгласие с нашите открития, където демонстрираме, че отслабването на патологичното липидно пероксидиране след приложение на nCeO2 намалява вредното влияние на ROS върху чернодробната тъкан при индуциран от MSG животински модел на NAFLD.
Съществува интересно проучване, съобщено от Rocca et al, в което nCeO2 са тествани както in vitro, така и in vivo като нова фармацевтична формула против затлъстяване. Те споменаха, че nCeO2 пречи на адипогенния път, като намалява транскрипцията на иРНК на гени, участващи в адипогенезата, и като възпрепятства натрупването на триглицериди в 3T3-L1 преадипоцити. Интраперитоналното приложение на 0,5 mg/kg nCeO2 на плъхове Wistar не е имало токсични ефекти, но е причинило значително намаляване на наддаването на тегло и намаляване на плазмените нива на инсулин, лептин, глюкоза и триглицериди в сравнение с контролната група [33].
Pourkhalili et al. демонстрира, че полезните антиоксидантни свойства са присъщи само на наночастиците на CeO2 и могат да бъдат подсилени чрез допълнително приложение на натриев селенит. Подобряването на активността на антиоксидантните ензими и намаляването на нивата на холестерола, триглицеридите и липопротеините с ниска плътност са демонстрирани при индуцирани от стрептозотоцин диабетични плъхове след 2 седмична интраперитонеална инжекция на nCeO2 с натриев селенит самостоятелно или в комбинация, но металната форма на CeO2 не показва значимо подобрение [34].
Заключение
Прилагането на nCeO2 в условия на оксидативен стрес може да намали/предотврати неговите патологични ефекти. Благодарение на способността на превръщането на Ce3 + в Ce4 + nCeO2 ефективно неутрализира водородния пероксид и хидроксилния радикал, без да генерира ROS. Такова затихване на патологичното липидно пероксидиране намалява патологичното влияние на ROS върху чернодробната тъкан, което се потвърждава от значително подобряване на основните хистологични характеристики на NAFLD и възстановяване на антиоксидантната ензимна активност. В обобщение, nCeo2 може да има потенциал да се използва като лечение за NAFLD, но трябва да се тества, като се използват други животински модели на затлъстяване.
- Броят на затлъстяването е по-висок в селските райони Превенция на изследването
- Пробиотиците в превенцията и лечението на затлъстяването критичен поглед
- Прием на морски дарове и развитие на затлъстяване, инсулинова резистентност и диабет тип 2
- Загубата на Орегон с 31-28 от Станфорд показва подобрение и тежкото вдигане, което трябва да последва
- Кверцетин и епигалокатехин галат в профилактиката и лечението на затлъстяването от молекулярно до