Мери Е. Патерсън
1 Катедра по педиатрия, Медицински център Харбър-UCLA, Торанс, Калифорния
Катрин С. Мао
1 Катедра по педиатрия, Медицински център Харбър-UCLA, Торанс, Калифорния
Майкъл В. Йе
4 Отдел по обща хирургия, Медицинско училище Дейвид Гефен в UCLA, Лос Анджелис, Калифорния.
Ели Ип
2 Катедра по вътрешни болести, Отдел по ендокринология, Медицински център Harbor-UCLA, Torrance, Калифорния
Гален Кортина
5 Катедра по патология и лабораторна медицина, Медицински факултет на Дейвид Гефен в UCLA, Лос Анджелис, Калифорния.
Дейвид Баранк
3 Отдел по радиология, Отдел по ядрена медицина, Медицински център Харбър-UCLA, Торанс, Калифорния
Панукорн Васинрапей
3 Катедра по радиология, Отдел по ядрена медицина, Медицински център Харбър-UCLA, Торанс, Калифорния
Анна Павликовска-Хадал
6 Катедра по педиатрия, Отдел по ендокринология, Медицински факултет на Дейвид Гефен в UCLA, Лос Анджелис, Калифорния.
W. N. Paul Lee
1 Катедра по педиатрия, Медицински център Харбър-UCLA, Торанс, Калифорния
Дженифър К. Йе
1 Катедра по педиатрия, Медицински център Харбър-UCLA, Торанс, Калифорния
Резюме
Обективен
За да се опише необичайното представяне на хиперинсулинизъм при 8-годишно момче.
Методи
Ние описваме клиничните находки на пациента, резултатите от биохимични и образни изследвания, хирургичен подход и резултат. Дискусията обхваща преглед на литературата, която предоставя основата за диагностичния и хирургически подход, приложен в случая на този пациент.
Резултати
Затлъстяло 8,5-годишно момче първоначално е получило хипогликемични гърчове след започване на диетични промени за лечение на затлъстяване. Биохимичният анализ показва хиперинсулинизъм. Ендоскопската ултрасонография не показва панкреатични лезии, предполагащи инсулином. Генетичните проучвания не идентифицират известни мутации в гените ABCC8, KCNJ11, GCK или GLUD1. Селективната артериална калциева стимулация и вземането на чернодробни венозни проби не документират фокусен източник на хиперинсулинизъм в панкреаса, а позитронно-емисионната томография с 18-флуоро-L-3,4-дихидроксифенилаланин показва дифузно повишено усвояване в панкреаса. В крайна сметка пациентът се нуждае от частична панкреатектомия поради продължителна хипогликемия, докато приема диазоксид и октреотид. Интраоперативното наблюдение на глюкозата насочва степента на хирургична резекция. Извършена е 45% панкреатектомия, която разрешава хипогликемията, но води до нарушен глюкозен толеранс след операция.
Заключение
Необичайното представяне на хиперинсулинизма в детска възраст изисква персонализиран подход към диагностиката и хирургичното лечение, като се използва интраоперативно проследяване на глюкозата, което води до консервативна панкреатектомия.
ВЪВЕДЕНИЕ
Постоянната хиперинсулинемична хипогликемия обикновено се проявява в периода на новороденото и може да бъде резултат от фокална или дифузна хиперсекреция на панкреас β-клетки. Генетични мутации в ABCC8 (по-рано SUR1), KCNJ11 (Kir6.2), GCK (глюкокиназа) и GLUD1 (глутамат дехидрогеназа) се откриват само в 50% от случаите с хиперинсулинизъм. Бебетата, които се нуждаят от операция за дифузен хиперинсулинизъм, обикновено се подлагат на почти пълна (95% -98%) панкреатектомия (1). Някои пациенти обаче имат остатъчна хипогликемия или развиват захарен диабет. Детският инсулином, макар и необичаен, е описан в литературата (2,3). Налична е минимална информация за етиологията и лечението на хиперинсулинизма в детска възраст. Този доклад описва рядък случай на хиперинсулинизъм в детска възраст, биохимичната и радиологичната оценка, проведени в опит да се направи разлика между фокална и дифузна болест, и персонализираното хирургично лечение чрез консервативна панкреатектомия.
ДОКЛАД ЗА СЛУЧАИ
Пациентът е 8,5-годишно бяло/мексиканско момче със затлъстяване, което първоначално е получило гърчове след започване на диетични промени за затлъстяване. Извикани са фелдшерите и концентрацията на глюкозата в кръвта му, измерена при пристигането на фелдшерите, е 30 mg/dL. Ниските нива на глюкоза в кръвта продължават да съществуват въпреки прилагането на декстроза в спешното отделение. Медицинската история на пациента се отличава само със затлъстяване. Родителите не са кръвни. Няма фамилна анамнеза за хипогликемия, диабет или невроендокринно заболяване. Баща му имаше епилепсия. Констатациите от физикалния преглед бяха нормални. На пациента е предписан диазоксид, 5 mg/kg дневно (типичният диапазон на дозиране за новородени и кърмачета е 8-15 mg/kg дневно; за деца и възрастни 3-8 mg/kg дневно); инструктирани за домашно наблюдение на глюкозата; и изписани вкъщи.
Пациентът е хоспитализиран 2 месеца по-късно поради официални резултати от лабораторни изследвания, които са получени, докато пациентът е гладувал и не е приемал диазоксид. Лабораторните тестове, проведени по време на хипогликемия на гладно, разкриват следните резултати (референтни граници в скоби): глюкоза, 40 mg/dL (70-105 mg/dL); кортизол, 12 μg/dL (6.2-19.4 μg/dL); нормален профил на мастните киселини; глюкагон, 79 pg/mL (40-130 pg/mL); инсулиноподобен растежен фактор, свързващ протеин 1, 3.2 ng/mL (30-1000 ng/mL); С-пептид, 1.1 ng/mL (0.9-4.3 ng/mL); растежен хормон, 0,4 ng/ml (2 (тегло 65,7 kg). Образните изследвания на коремна компютърна томография са нормални. Пациентът е изписан у дома на диазоксид, 4,5 mg/kg дневно.
На 10-годишна възраст пациентът беше подложен на допълнителна оценка след прехвърляне на грижи в нашия медицински център. Неговият ИТМ е 44 kg/m 2 (тегло 103,5 kg) и той има акантоза нигри-кутии. Преди прием на сутрешни лекарства бяха документирани следните лабораторни резултати (референтни граници в скоби): серумна глюкоза, 55 mg/dL (70-99 mg/dL); проинсулин, 5,9 ng/ml (≤0,20 ng/ml); С-пептид, 3.8 ng/mL (0.8-4.0 ng/mL); и инсулин, 9,9 μIU/mL (1,9-23,0 μIU/mL). Когато официално гладува, неговата серумна концентрация на глюкоза е била 38 mg/dL (70-99 mg/dL) за 18,5 часа, с концентрация на инсулин 8 μIU/mL (1,9-23,0 μIU/mL) и концентрация на С-пептид от 4,2 ng/ml (0,8-4,0 ng/ml). След едновременни инфузии на инсулин (0,05 единици/кг на час) и декстроза в продължение на 180 минути, нивото на С-пептида на пациента не успява да потисне (2,0 ng/ml [0,8-4,0 ng/ml]), когато концентрацията му на глюкоза е 37 mg/dL (65-160 mg/dL). Пациентът не е имал кетони в урината или повишени нива на амоняк по време на хипогликемия и е проявил реакция на глюкагон. Екранът за серумна хипогликемия за често срещани лекарства за диабет е отрицателен. Генетичното тестване не идентифицира мутации в гените ABCC8, KCNJ11, GLUD1 или GCK (Athena Diagnostics). Ендоскопската ултрасонография на панкреаса не показва лезии, предполагащи инсулином. Нивото на хромогранин А е нормално.
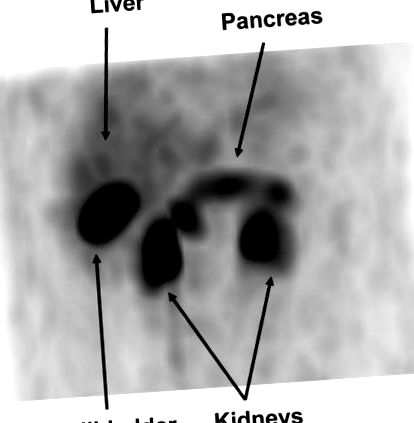
Пациентът е подложен на селективна артериална калциева стимулация и вземане на проби от чернодробни вени (4), а нивата на инсулина не показват регионален отговор на калциевите инжекции. Докато пациентът не приема диазоксид, се извършва позитронно-емисионна томография с 5,3 mCi (196 MBq) 18-флуоро-L-3,4-дихидроксифенилаланин (18 F-DOPA). Комитетът по човешки субекти към Лос Анджелисския институт за биомедицински изследвания в Харбър-UCLA одобри състрадателната употреба на 18 F-DOPA. Пациентът и неговият настойник подписаха писмено информирано съгласие. Изображенията демонстрират дифузно поемане през панкреаса и не е установена фокална лезия (Фиг. 1).
Преден изглед на 18-флуоро-L-3,4-дихидроксифенилаланин позитронно-емисионна томография 3-измерна реконструкция, показваща повишено усвояване в панкреаса.
Опит за медицинско ръководство. Състоянието на пациента първоначално се повлиява от диазоксид (4,5 mg/kg дневно). Той се опита да отслабне, като яде малки, чести хранения и достигна ИТМ от 30 kg/m 2 (тегло 78,7 kg). Когато хипогликемията на пациента в крайна сметка се влоши, се опита да се повиши дозата на диазоксид до 8 mg/kg дневно, но пациентът постепенно наддаде на тегло (най-висок BMI 48,5 kg/m 2, тегло 139,3 kg) и надрасна дозата си. Последната му доза е 4 mg/kg дневно (525 mg дневно). Добавянето на октреотид, 50 mcg два пъти дневно чрез подкожно инжектиране, не елиминира хипогликемичните епизоди, въпреки че събитията настъпват в диапазона от 40 до 50 mg/dL, вместо в диапазона от 20 до 40 mg/dL. Пациентът е бил в персонализирана образователна програма в училище, тъй като хипогликемичните епизоди редовно пречат на обучението му, но той не е имал неврокогнитивни дефекти.
Тъй като медицинската терапия се провали, пациентът претърпя 45% дистална панкреатектомия със спленектомия на възраст 15 години. Предоперативните концентрации на глюкоза са едва 48 mg/dL (65-110 mg/dL). Не са установени фокални лезии интраоперативно чрез палпация или ултразвуково изследване. Интраоперативните нива на глюкоза бяха използвани за насочване на степента на панкреатектомия (фиг. 2). Десет минути след първоначална 25% резекция на панкреаса, инфузията на декстроза временно се спира и интраоперативната концентрация на глюкоза на пациента се повишава до 115 mg/dL. За да се отчете вече получената декстроза и интраоперативният стрес, беше извършена окончателна 20% резекция и концентрацията на глюкоза се повиши до 143 mg/dL. Четири часа след операцията, кръвната глюкоза е 221 mg/dL при 5% интравенозни течности с декстроза. Резултатите от лабораторните тестове от сутринта след операцията (без декстроза) са както следва: глюкоза, 154 mg/dL (65-110 mg/dL); С-пептид, 7.4 ng/mL (0.8-3.1 ng/mL); инсулин 41, μIU/mL (5-27 μIU/mL); и проинсулин, 66,5 pmol/L (2,1-26,8 pmol/L).
Интраоперативни и следоперативни концентрации на глюкоза чрез изследване на място. Най-ниската концентрация на глюкоза преди резекция на панкреаса е била 48 mg/dL. След първоначалната 25% резекция на панкреаса, концентрацията на глюкоза се повиши до 115 mg/dL. След 20% по-нататъшна резекция, концентрацията на глюкоза се повишава до 143 mg/dL.
Грубото и микроскопско изследване на серийни хистологични разрези по 9-сантиметровото резецирано панкреатично тяло и опашка разкри нормална архитектура. Паренхимът се състои от типични панкреатични лобули с екзокринната тъкан, разделена нормално на ацини. Островчетата бяха разпръснати сред екзокринния панкреас по обичайния начин. Не е налице коалесцентна островна фокусност, неоплазия на островчета или аденоматозни огнища. Единствената аномалия беше забележимата анизонуклеоза на островчета под формата на увеличени ядра на островни клетки, наблюдавани в панкреатичните острови. Уголемените ядра са по-големи от 3 пъти диаметъра на околните по-типични островни клетъчни ядра (фиг. 3).
Островчета от пациента, демонстриращи забележима анизонуклеоза както в опашката (панел А), така и в тялото (панел В) на панкреаса (петна от хематоксилин и еозин, увеличение 600 ×). Увеличените ядра бяха открити в островчета в резецираната панкреатична тъкан.
Постоперативно пациентът вече не се нуждае от диазоксид или октреотид. В дома му концентрацията на глюкоза в кръвта варира от 88 до 262 mg/dL. Шест месеца след операцията, пациентът е имал нарушена концентрация на глюкоза на гладно от 107 mg/dL (70-99 mg/dL) с концентрация на инсулин 9,2 μU/mL (1,9-23,0 μIU/mL) (оценка на модела на хомеостазата на инсулинова резистентност, 2,43; ИТМ, 46,6 kg/m 2; тегло, 131,4 kg). Неговата 2-часова серумна концентрация на глюкоза след поглъщане на 75 g глюкоза е 196 mg/dL (65-160 mg/dL) с ниво на инсулин от 52,5 μIU/mL (1,9-23,0 μIU/mL), което показва нарушен глюкозен толеранс . Пациентът продължи да получава хранителни консултации със съвети за отслабване, за да се предотврати явен диабет. Една година след операцията, неговият ИТМ е 42 kg/m 2 (тегло 123,3 kg), а концентрацията на глюкоза в кръвта на гладно е 78 mg/dL. Неговата двучасова концентрация на глюкоза в кръвта след поглъщане на 75 g глюкоза е 190 mg/dL, с ниво на хемоглобин А1с 5,0%.
ДИСКУСИЯ
Този рядък случай илюстрира предизвикателствата в диагностиката и лечението на хиперинсулинизма от хиперсекреция на панкреатични островни клетки в детска възраст. Подходът към диагностиката обхваща техники, използвани при оценка на инсулином и фокален или дифузен хиперинсулинизъм. След потвърждаване на неподходяща хиперинсулинемия по време на гладно и потискане на С-пептида, инсулиномът е по-висок при диференциалната диагноза поради възрастта му. След като ендоскопската ултрасонография не показа подозрителни лезии, дифузният или фокален хиперинсулинизъм се превърна в водеща диагноза. Ние разгледахме възможността прекомерното хранене да е маскирало хипогликемия от вроден хиперинсулинизъм, водещо до затлъстяване. Въпреки това са докладвани случаи на хиперинсулинизъм при възрастни (5), така че заболяването в детска възраст при този пациент е вероятно. Проучването на литературата даде много малко информация за управление на фокален или дифузен хиперинсулинизъм във възрастовата група на този пациент.
Разграничаването между дифузен и фокален хиперинсулинизъм е важно, тъй като диагнозата може да насочва хирургично лечение. Селективната артериална калциева стимулация и вземането на проби от чернодробни вени не локализират засегнатата област на панкреаса при този пациент. Съобщава се, че позитронно-емисионната томография с 18 F-DOPA точно разграничава фокусното от дифузния хиперинсулинизъм при новородени (6), въпреки че този метод може да има ограничена стойност при възрастни с инсулином (7). Сканирането с 18 F-DOPA позитронно-емисионна томография при този пациент предполага намерение за дифузно заболяване.
Дългосрочната медицинска терапия е възможност за лечение на дифузен хиперинсулинизъм (8). Пациентът е бил третиран така, сякаш има дифузно заболяване, но медицинското ръководство е неуспешно и е посочена операция. Докладите показват, че много бебета с вроден дифузен хиперинсулинизъм се подлагат на почти пълна панкреатектомия (9). В редки случаи на дифузен хиперинсулинизъм при възрастни се извършва 70% панкреатектомия с лечение или някакво персистиращо заболяване (5). В литературата обаче няма налична информация за насочване на степента на панкреатектомия при пациент като този. Инсулиновата резистентност на този пациент от затлъстяване допълнително усложнява оценката на степента на необходима панкреатектомия. Изследванията при животни обаче показват, че 50% намаляване на β-клетъчната маса предизвиква нарушена глюкоза на гладно и непоносимост към глюкоза (10). Измерването на интраоперационните нива на глюкоза е клиничният подход на хирургичния екип, който служи като основно ръководство за директна степен на резекция. Четиридесет и пет процента резекция може да са били достатъчни при определяне на инсулиновата резистентност, но бъдещето ще покаже дали това е оптимално за този пациент.
Ключовият хистопатологичен диагностичен критерий за дифузен хиперинсулинизъм (11-13) е ядреното уголемяване на островните клетки, разпръснато из панкреатичните острови и липса на фокална агрегация на островната тъкан (14). Трикратното ядрено разширяване на някои ядра на островни клетки в сравнение със съседни ядра с нормален размер (анизонуклеоза), както е показано при този пациент, е визуалният знак за диагностика. Въпреки че няма проба от главата на панкреаса, която да завърши оценката, пациентът не демонстрира въздействие върху ацинарната тъкан или изкривяване на лобули от възлообразен растеж на островната тъкан, който се появява при фокална аденоматоза, извън която биха могли да се видят нормално големи ядра (13) Следователно водещата ни диагноза е дифузният хиперинсулинизъм. Описани са обаче нетипични случаи на фокално ядрено разширяване (15,16). Разглежда се възможността патологичните находки на този пациент да се отдадат на затлъстяването и инсулиновата резистентност, тъй като е описана хиперплазия на островни клетки при затлъстяване и инсулинова резистентност (17-19), но липсата на данни при хора, подкрепящи свързаното ядрено разширяване, прави тази възможност спекулативен.
ЗАКЛЮЧЕНИЕ
Този пациент е имал хиперинсулинизъм през детството. Консервативната панкреатектомия доведе до разрешаване на хипогликемия, въпреки че той остава непоносим към глюкоза. Подходът за хирургично лечение с използване на интраоперативни измервания на глюкозата трябва да се разглежда като възможен метод за оптимизиране на резултата при пациенти с хиперинсулинизъм.
ПРИЗНАНИЕ
Изказваме своята благодарност и признателност на следните лица, които са предоставили съвет: д-р Питър Бътлър (Калифорнийски университет, Лос Анджелис); Марк Сперлинг, доктор по медицина (Детска болница в Питсбърг към UPMC); и д-р Лиза Дж. Стейтс (Детска болница във Филаделфия).
- Хиперинсулинизъм и свръхрастеж без затлъстяване Архиви на детските болести
- Високо кръвно налягане при мъжете Рискове; Банер за лечение Здраве
- Високият холестерол - причини, симптоми, лечение, диагностика
- Liraglutide Нова възможност за лечение на затлъстяване - Nuffer - 2015 - Фармакотерапия The Journal
- Лираглутид е ефективно лекарство за лечение на затлъстяване и в реалния живот SpringerLink